長鏈非編碼RNA TTY15通過海綿miR337-3p上調JAK2促進舌鱗狀細胞癌的生長和轉移
張婷 鄭見寶
舌鱗狀細胞癌(tongue squamous cell carcinoma,TSCC)是口腔鱗癌(oral squamous cell carcinoma,OSCC)最常見的類型,以其高轉移、高增殖能力而著稱[1]。盡管近年來在舌鱗狀細胞癌治療管理方面取得了進展,舌鱗狀細胞癌的死亡率仍然很高[2]。長鏈非編碼RNA(long non-coding RNAs,lncRNAs)是一種長度>200 nt、無蛋白質編碼能力的非編碼RNA。據報道,lncRNAs參與了腫瘤發生的一系列調控,包括癌變、細胞增殖、遷移、侵襲和凋亡等[3]。TTTY15作為一種致癌的lncRNA,在癌癥中有被報道。例如,TTTY15可通過海綿 microRNA let-7促進前列腺癌的發展[4]。然而,與舌鱗狀細胞癌有關的TTTY15的生物學功能和機制還未闡明。研究表明miRNAs參與調節各種基本的生物學過程,并與腫瘤學的進展有關[5]。此外,研究發現miR-337-3p可通過下調Rap1A蛋白的表達抑制宮頸癌細胞的增殖、遷移和侵襲[6]。然而,miR-337-3p在舌鱗狀細胞癌中的效應尚未闡明。調控細胞凋亡和增殖的信號通路的分子往往對腫瘤進展有重要影響。JAK2是一種非受體酪氨酸激酶,參與了許多調控細胞凋亡和增殖的信號通路,是腫瘤組織中表達最顯著的基因[7,8]。有研究顯示,miR-337-3p可通過靶向作用于JAK2抑制肝癌細胞的增殖和侵襲[9]。然而,作用于JAK2的miR-337-3p在舌鱗狀細胞癌中的作用尚未完全闡明。本研究中,我們探討TTTY 15在舌鱗狀細胞癌中的潛在作用,并在體外研究TTTY15對舌鱗狀細胞癌細胞的生物學作用。
1 材料與方法
1.1 病理組織收集 選取我院收治的舌鱗狀細胞癌患者40例,通過手術獲得了40份舌鱗狀細胞癌樣本和相應的癌旁正常組織,樣本經病理檢測為舌鱗狀細胞癌。納入標準:(1)術前未接受放療、化療;(2)手術切除腫瘤,術后經病理診斷證實為舌鱗狀細胞癌;(3)臨床病理資料完整;(4)簽署知情同意書。排除標準:(1)合并慢性疾病(如冠心病、高血壓、糖尿病等)者;(2)合并其他系統惡性腫瘤者;(3)合并感染性疾病者。切除的癌癥和相應的癌旁正常組織被切割后立即儲存在液氮中直到RNA提取。
1.2 實驗材料 舌鱗狀細胞癌細胞系(SCC4, SCC1, UM1 和 Cal27)和口腔角質形成細胞系(NHOK)購自中國上海科學院細胞銀行, 在RMPI-1640培養基(美國Gibca公司)中培養,培養基含10%牛胎血清(鼎國公司,批號:TH20190412),條件為37℃,5%CO2。miR-337-3p mimics以及相應的對照組mimic陰性對照購自廣州瑞博生物科技有限公司。使用上海吉凱生物科技有限公司設計并合成的sh-TTTY15敲低TTTY15的表達和相應的對照sh-NC。pcDNA3.1-TTTY15購自Genepharma。轉染試劑Lipofectamine 2000(批號:JT20190408)購自Invitrogen公司。CCK-8試劑盒(批號:20190320)購自日本TaKaRa公司。聚合酶鏈式反應(polymerase chain reactio,PCR)試劑盒(批號:120114578ST)購自日本TaKaRa公司。
1.3 定量實時PCR分析 用Trizol試劑從組織或細胞中提取總RNA。用M-MLV RTase cDNA合成試劑盒(Takara),根據制造商的指示,將RNA反向轉錄成cDNA。在ABI PRISM 7700儀器(Thermo Fisher Science)上,用SYBR greener qPCRSuperMix(Thermo Fisher Science)進行定量實時PCR(qRT-PCR)檢測。PCR擴增首先在95℃起始變性15 min,然后95℃下進行30 s, 58℃下進行30s,72℃下進行30 s, 以及最后一步在72℃下進行10 min的35次循環。然后,用直接測序法對單個PCR反應中產生的擴增產物進行分析。以GAPDH為檢測TTTY15,miR-337-3p和JAK2表達水平的內參,采用2-ΔΔCt方法進行統計。每個實驗重復3次,測量3次。見表1。
1.4 CCK-8法 采用CCK-8法測定細胞增殖。細胞接種于96孔板中,密度為5 000個/孔,培養1、2、3和4 d。在指定的時間點加入10 μl CCK-8試劑到每孔中。37℃孵育2 h后,在450 nm處測定吸光度。每個實驗重復3次,每次測量3次。
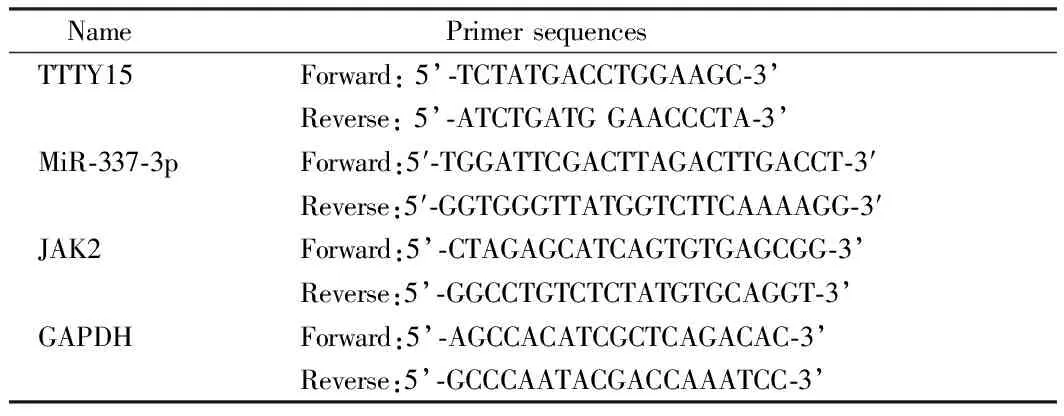
表1 qRT-PCR引物序列
1.5 Transwell 實驗 細胞接種在裝有小室的24孔板中,每組設置2個復孔。舌鱗狀細胞癌細胞懸浮在無血清培養基的上室(約105個細胞/孔,8 μm孔徑;BD Biosciences),下室內加入500 μl含10%的胎牛血清的RMPI-1640培養液。24 h后,用棉簽輕輕地拭去上室表面的細胞(即未侵入下室的細胞),侵入下室的細胞采用甲醇固定,然后用結晶紫染色。在倒置顯微鏡下隨機選取5個視野(包括膜的中央和周邊),計數侵入下室的細胞數目。侵襲實驗的Transwell小室底部覆有基質膠,其他步驟同遷移實驗。
1.6 雙熒光素酶報告基因檢測實驗 所有熒光素酶報告載體(TTTY15-WT、TTTY15-MUT)均由Ribo生物公司構建。將細胞(4.5×104)接種于48孔板中,培養至70%匯合。然后用脂質體2000將TTTY15-WT或TTTY15-MUT與miR-337-3p模擬物或陰性對照物共轉染細胞。轉染48 h后,按照制造商的說明測定熒光素酶活性。所有實驗一式三份,重復3次。
1.7 Western blot 采用RIPA緩沖液(ThermoFisher Science)對細胞進行裂解,收集總蛋白。用BCA法測定蛋白質濃度。分別采用5%的SDS-PAGE濃縮膠和10%的SDS-PAGE分離膠分離蛋白,并將其轉移到PVDF膜上。在5%的脫脂牛奶封閉后,首先用特異性抗體孵育膜:JAK2(稀釋1∶1 000,Cell Signaling Technology)和GAPDH(稀釋度1∶2 000,Santa Cruz)抗體檢測膜。然后與山羊抗兔(1∶5 000,ab6721;Abcam)進行二次抗體孵育膜。使用ECL試劑盒(Amersham Pharmacia Biotech,Little Chalfont,UK)進行顯影,采用ImageQuant LAS 4000微型生物分子成像儀(GE Healthcare)進行拍照。GAPDH被用作內部參考。用ImageJ軟件進行western blot定量分析。

2 結果
2.1 TTTY 15在舌鱗狀細胞癌組織和細胞系中表達上調 通過qRT-PCR分析發現,與正常對照組織相比,舌鱗狀細胞癌樣品中TTTY15表達顯著增加(P<0.05)。與口腔角質形成細胞系(NHOK)相比的所有四個舌鱗狀細胞癌細胞系(SCC4、SCC1、UM1和Cal27)中,TTTY15表達顯著上調(P<0.05)。見表2、3。

表2 舌鱗狀細胞癌組織和相應的癌旁正常組織中TTTY15的表達情況比較

表3 SCC4、SCC1、UM1和Cal27細胞系中TTTY15的表達情況比較
2.2 敲低TTTY 15可抑制舌鱗狀細胞癌細胞的增殖、遷移和侵襲 成功建立TTTY15低表達細胞模型,采用CCK-8實驗檢測TTTY15低表達組和對照組的細胞增殖情況。與對照組相比,TTTY15低表達組可顯著抑制細胞的增殖。使用Transwell實驗評估了TTTY15低表達對細胞遷移和侵襲的影響,與對照組相比,TTTY15低表達的遷移和侵襲能力較弱。見圖1,表4。

圖1 Transwell遷移和侵襲實驗檢測sh-TTY15對舌鱗狀細胞癌細胞的遷移和侵襲影響
表4 CCK-8實驗檢測sh-TTY15對舌鱗狀細胞癌細胞的增殖影響
2.3 MiR-337-3p在舌鱗狀細胞癌中下調并可與TTTY15結合 使用生物信息學數據庫來尋找TTTY15的潛在目標基因。TTTY15包含miR-337-3p的保守目標位點。為確認TTTY15與miR-337-3p之間的直接相互作用,采用雙熒光素酶報告法。雙熒光素酶檢測顯示miR-337-3p對TTTY15-WT的報告活性有明顯的抑制作用,但對TTTY15-MUT沒有抑制作用。TTTY15與miR-337-3p的表達呈負相關。見表5,圖2、3。
表5 熒光素酶報告基因法檢測miR-337-3p對TTTY15-WT和TTTY15-MUT的影響

圖2 TTTY15的野生型和突變型與miR-337-3p結合位點的示意圖
2.4 轉染miR-337-3p可促進舌鱗狀細胞癌細胞的增殖、遷移和侵襲 將miR-337-3p mimics轉染到細胞中,成功構建了miR-337-3p過表達模型。CCK-8實驗顯示,過表達miR-337-3p可明顯抑制細胞的增殖。通過transwell遷移和侵襲實驗,我們觀察到miR-337-3p的過表達顯著地減少了細胞的遷移和侵襲。見表6,圖4。
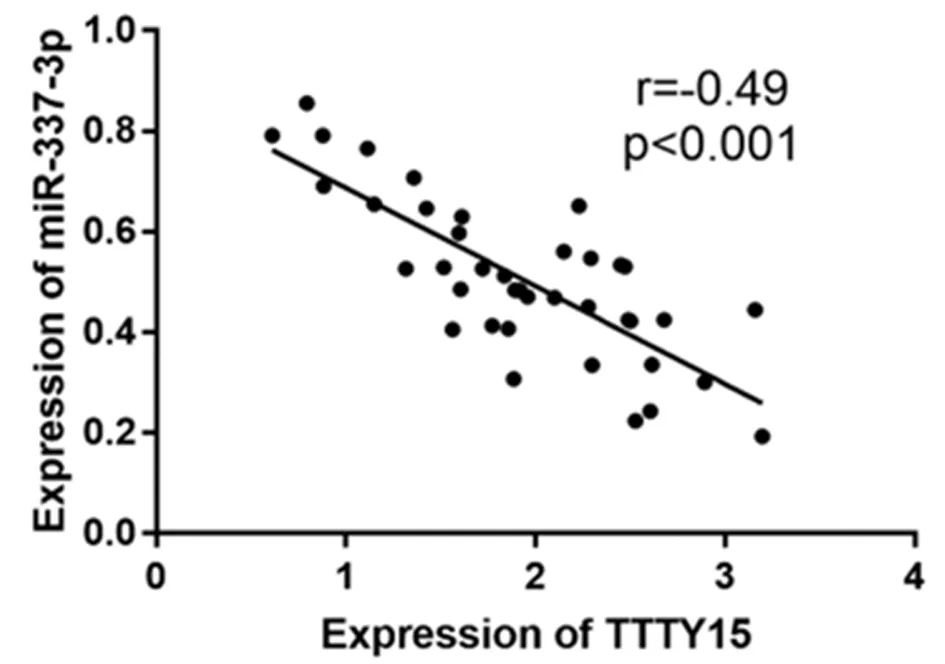
圖3 TTTY15與miR-337-3p的皮爾遜相關系數分析
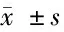
表6 CCK-8實驗檢測過表達miR-337-3p對 細胞的增殖的影響

圖4 Transwell遷移和侵襲實驗檢測miR-337-3p對舌鱗狀細胞癌細胞的遷移和侵襲影響
2.5 TTTY 15通過抑制miR-337-3p的功能,促進JAK 2的表達和舌鱗狀細胞癌的生長 將miR-337-3p mimics和TTTY15 + miR-337-3p mimics共轉染細胞。發現TTTY15在轉染miR-337-3p mimics的細胞中下調,但這一現象在共轉染過表達TTTY15和miR-337-3p mimics的細胞中逆轉。轉染miR-337-3p mimics的細胞中JAK2的mRNA和蛋白表達水平升高,而TTTY15 的過表達逆轉了該效應, 這表明TTTY15可以通過抑制舌鱗狀細胞癌細胞中的miR-337-3p誘導JAK2的表達。接下來,我們研究TTTY15是否能恢復miR-337-3p mimics轉染對舌鱗狀細胞癌細胞的影響。我們發現miR-337-3p mimics抑制了舌鱗狀細胞癌細胞增殖和轉移,而TTTY15的轉染部分地消除了miR-337-3p mimics對舌鱗狀細胞癌細胞增殖和轉移的影響。見圖5、6,表7、8。

圖5 Transwell遷移和侵襲實驗檢測TTTY15+miR-337-3p共轉染對舌鱗狀細胞癌細胞的遷移和侵襲影響
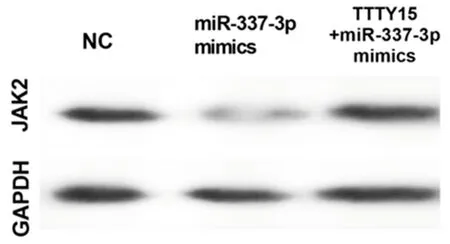
圖6 Western blot 法檢測蛋白表達水平
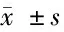
表7 CCK-8實驗檢測過表達TTTY15 + miR-337-3p對細胞增殖的影響
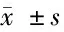
表8 Western blot 法檢測3組細胞的JAK2蛋白表達水平
3 討論
有證據表明,lncRNAs參與了許多重要的生物學過程,包括腫瘤發生和轉移,從而為大多數腫瘤提供了潛在的治療靶點[10]。因此,研究舌鱗狀細胞癌中lncRNAs的生物學功能及其機制,可為臨床治療提供有價值的治療靶點。
近年來,lncRNAs已在多種腫瘤細胞中被發現,這為腫瘤的治療帶來了戰略性的改變,lncRNAs也是如今很多研究的重點。在舌鱗狀細胞癌中曾報道過lncRNAs的調節障礙,與舌鱗狀細胞癌相關的lncRNA的研究可提供預后和疾病監測標記并可能提供潛在的新的治療靶點,例如,lncRNA GIHCG通過調節miR-429促進舌鱗狀細胞癌的進展[11]。LncRNA TUC338過表達可在體外促進舌鱗狀細胞癌細胞增殖并抑制舌鱗狀細胞癌細胞凋亡[12]。LncRNA CASC15通過靶向miR-33a-5p促進舌鱗狀細胞癌的進展[13]。受這些研究的啟發,我們試圖確定TTTY15在舌鱗狀細胞癌中的作用。我們在40例舌鱗狀細胞癌組織及癌旁正常組織對照組中檢測到TTTY15,數據顯示,TTTY15在舌鱗狀細胞癌組織中的表達明顯升高,而TTTY15高表達的患者預后比低表達者差。TTTY15在舌鱗狀細胞癌中的高表達可以促進舌鱗狀細胞癌細胞的增殖,侵襲和遷移。
miRNAs可作為促腫瘤基因或抑腫瘤基因調節腫瘤的進展。例如,雙重功能的miRNA-186-5p可靶向FGF 2和RelA抑制多形性膠質母細胞瘤的發生[14]。miR-106a-363可促進尤文肉瘤的生長[15]。另外,越來越多的證據表明miRNAs的失調與舌鱗狀細胞癌發病機制有關。例如,miR-183可促進舌鱗狀細胞癌細胞株SCC25細胞凋亡[16]。miR-22通過抑制CD147表達抑制舌鱗狀細胞癌細胞的侵襲、遷移和增殖[17]。miRNA-802通過靶向MAP2K4抑制舌鱗狀細胞癌的進展[18]。與此同時,miR-337-3p的過表達在癌癥發生和發展的許多細胞過程中起著抑癌的作用。例如,miR-337-3p通過調節CAPN4來抑制透明細胞腎癌細胞的增殖和轉移[19]。miR-337-3p可靶向STAT3和RA1A調節非小細胞肺癌中的紫杉烷敏感性,miR-337-3p表達缺失可促進胃癌的淋巴結轉移[20]。在本研究中,我們發現與癌旁正常組織相比,miR-337-3p在舌鱗狀細胞癌組織中顯著下調。miR-337-3p的過表達在體外抑制了舌鱗狀細胞癌細胞的增殖、遷移和侵襲。
miRNA和lncRNA的相互作用在舌鱗狀細胞癌發生中的確切作用尚不清楚。了解miRNA和lncRNA之間的相互作用,將極大地促進惡性腫瘤基于miRNA/lncRNA的診斷和治療的發展。例如,上調的Lnc-SNHG1通過阻斷miR-577和激活WNT2B/Wnt/β-catenin途徑促進骨肉瘤的進展[21]。LncRNA SNHG20通過調節miR-495參與乳腺癌細胞的增殖、侵襲和遷移過程[22]。Lnc-SNHG1可作為miR-497的海綿促進非小細胞肺癌的進展[23]。本研究中,我們通過生物信息學分析預測了TTTY15與miR-337-3p之間的結合位點,并用雙熒光素酶報告法證實miR-337-3p中含有TTTY15的結合位點。此外,我們還證實了TTTY15與miR-337-3p直接結合。我們還發現,在舌鱗狀細胞癌細胞中,TTTY15通過抑制miR-337-3p的表達發揮了促癌作用。表明TTTY15直接靶向并下調miR-337-3p的表達從而影響舌鱗狀細胞癌的進展。
據報道,JAK2在幾乎所有組織中表達并與許多病理進展相關,而且JAK2在一些癌癥中充當癌基因[23]。例如,JAK2過表達是鼻咽癌預后不良的預測因子[24]。JAK2基因敲除通過STATs和PI3K/AKT信號通路誘導肝癌細胞凋亡、自噬和抗增殖作用[25]。此外,JAK2是人類癌癥中多個miRNAs的直接下游靶點,例如,胰腺癌中miR-216a的下調可能導致JAK 2過度表達和/或異常激活,從而加劇胰腺癌的發展[26]。MiR-375通過靶向JAK2抑制胃癌細胞的增殖和轉移[27]。而在肝癌中,JAK2已經被證明是miR-337-3p的直接靶點。在本研究中,TTTY15的過表達抑制miR-337-3p的表達,而促進JAK2的表達。因此,我們認為TTTY15可以通過靶向miR-337-3p參與調節舌鱗狀細胞癌組織和細胞中JAK2的表達。
綜上所述,我們強調TTTY15作為“ceRNA”通過sponge miR-337-3p來促進JAK2的表達,從而在體外促進舌鱗狀細胞癌的進展。我們的研究結果為舌鱗狀細胞癌的發病機制提供了新的思路,也為舌鱗狀細胞癌的治療提供了潛在的靶點。

