核桃開花相關基因JrSOC的克隆及其在開花中的作用分析
柴 念
(武漢市龜山風景管理,湖北 武漢 430050)
1.研究的目的和意義
核桃(Juglans regia L)是胡桃科核桃屬落葉落果喬木,分早實核桃與晚實核桃兩大類群。早、晚實核桃是核桃分類中的兩大類群。由于晚實核桃播種結果需要10多年時間,嚴重影響了核桃產業的發展。如何縮短幼年期,促進早熟是核桃研究者難以解決的問題。
自然條件下,核桃的雌花在成熟期必須經具有活力的花粉粒傳送到雌蕊柱頭上完成授精,才能發育成果實。不同核桃品種的雌雄花花期相遇及花粉親和性,是配置授粉樹、提高核桃產量的重要研究內容。通過對模式植物擬南芥的多年研究,已知MADS-box基因家族在開花時間調控網絡中起著重要作用。其中的Supperssor of overexpression of CO基因是開花途徑的整合子,在四種開花途徑中受調控(陳方芳等 2009)。研究表明,SOC是一種多功能蛋白,主要調節開花時間,但也調節花型和花分生組織發育(Liu et al., 2009; Koornneef et al.,1998; Hepworth et al., 2002)。SOC基因與許多其他基因蛋白相互作用,在植物生長發育中起著重要作用。
本研究對核桃的SOC基因進行了克隆和同源性分析,利用qRT-PCR技術分析了SOC基因在植物不同部位和不同階段的具體表達情況,為分子育種研究和高產栽培提供理論依據。
2.選題依據
花是植物最重要的經濟器官。花卉的發育受到環境因素影響,本質上其實是環境因素在影響基因調控。花器官形成直接影響果實產量。從現有的文獻來看,對在核桃開花中起重要作用的SOC基因的研究很少。本研究將對核桃SOC基因進行功能分析,為進一步的克隆核桃開花同源基因奠定基礎,進一步解釋木本植物開花相關機制。
3.技術路線及擬解決問題
3.1 擬解決問題
本研究利用分子生物學的技術手段研究核桃內開花基因的功能和作用,以期從分子水平揭示核桃早實特性的機理。
3.2 技術路線
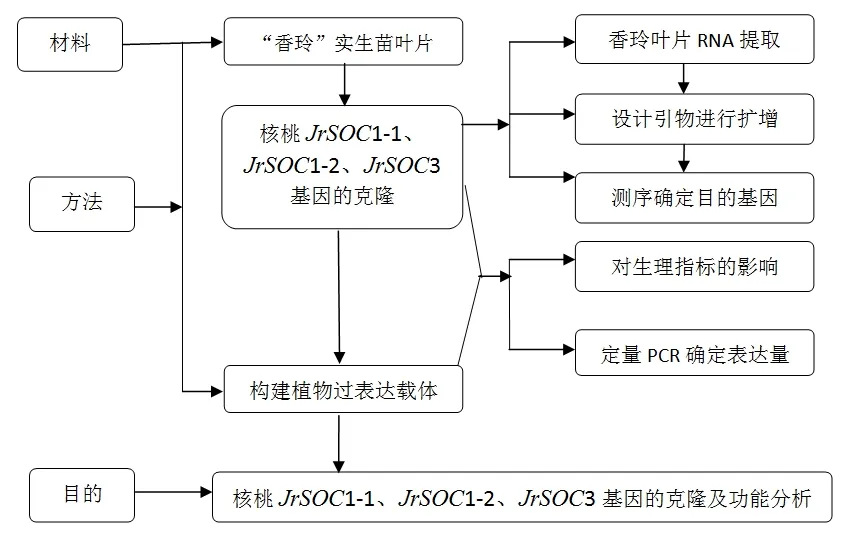
4.核桃JrSOC基因的克隆及序列分析
4.1 試驗材料
以香玲嫁接苗葉片為供試材料,在四月中旬核桃苗發芽時,采取新鮮綠色的核桃葉片。
4.2 試驗藥品
CTAB、硼砂、醋酸、LiCL3、NaCL、水飽和酚、巰基乙醇、氨芐青霉素、氯仿、無水乙醇購于楊陵化玻站。
反轉錄試劑盒、DNase1試劑、T4連接酶、膠回收試劑盒均購于TaKaRa寶生物公司;DEPC處理水、DNAMarker(DL500、2000)、Loadding buffer均購自小白生物科技有限公司。
4.3 試劑的配制
4.3.1 RNA提取液。
4.3.2 LiCL3試劑。
4.3.3 NaAc試劑。三種試劑均需要高壓滅菌后方可使用。
4.3.4 TAE緩沖液。
4.3.5 瓊脂糖凝膠。
4.4 試驗儀器與設備
振蕩儀、液氮、研缽、小藥匙、移液槍與槍頭、1.5ml離心管、離心機、PCR儀、水浴鍋、高壓滅菌鍋、鑷子、電子天平、廢液缸、橡膠手套、玻璃棒、微波爐、電泳槽、制冰機等。
4.5 核桃JrSOC家族基因的序列特征
以“Supperssor of overexpression of CO”為關鍵詞在核桃轉錄組cDNA序列庫中檢索到幾個SOC基因序列,比較分析軟件不同基因的結構特征。使用ORF查找程序確定每個基因的開放閱讀框,用以ORF基因為模板設計的PCR擴增引物進行菌液PCR,回收產物與T載體連接并轉化入大腸桿菌,出來正確條帶的目的基因序列經菌液測序證實。
4.6 總 RNA 的反轉錄即 cDNA 的合成
使用Takara公司的試劑盒,按說明書操作,反轉錄得到核桃葉片的cDNA。
4.7 JrSOC1-1、JrSOC1-2、JrSOC3 基因的擴增
按照JrSOC1-1、JrSOC1-2、JrSOC3 基因序列設計引物,用其進行菌液PCR。
PCR產物經過電泳檢測后,對于出現正確條帶使用膠回收試劑盒進行膠回收。
4.8 大腸桿菌轉化及鑒定
4.8 1 PCR純化后產物與載體連接。
4.8.2 轉化大腸桿菌。
4.8.3 隨機選擇幾個單菌落進行菌液PCR鑒定是否為陽性。
用凝膠電泳檢測反應產物,用甘油保存菌液PCR與預測長度一致的產物于冰箱零下二十攝氏度。送去公司測序后序列比對合格的菌液提取質粒,保存備用,為接下來的基因結構分析做準備。
5.結果與分析
在核桃轉錄組中獲得了JrSOC1-1、JrSOC1-2、JrSOC3蛋白家族基因的序列,通過多序列比對分析、BLAST、進化分析,對這些蛋白的序列特征進行了初步分析。得到以下結論:
這三個基因的序列特征是不同的。基因的全長是不同的。JrSOC1-1基因的序列長度為576bp,理論等電點為5.21,編碼蛋白的分子量為22.37kd,氨基酸數為188;JrSOC1-2基因的序列長度為626bp,理論等電點為9.10,編碼蛋白的分子量為24.02kd,氨基酸數分別為208;JrSOC3基因的序列長度為699bp,理論等電點為9.00,編碼蛋白的分子量為26.77kd,氨基酸數為232。
6.核桃JrSOC基因過量表達載體構建與轉化擬南芥
6.1 試驗內容
核桃JrSOC基因表達載體構建;轉化農桿菌;擬南芥植株的種植。
6.2 目的基因JrSOC表達載體構建
通過分析JrSOC1-1、JrSOC1-2、JrSOC3基因的CDS序列,選擇Sal I和Xba I為雙酶切位點,和目標表達載體pCAMBIA2300-35SN一起進行雙酶切,回收片段用T4連接酶連接,最后成功構建JrSOC表達載體pCAMBIA2300-JrSOC1-1、pCAMBIA2300-JrSOC1-2和pCAMBIA2300-JrSOC3。將表達載體進行雙酶切鑒定,并轉入到EHA105農桿菌感受態細胞后,分別用其特異性引物進行PCR擴增檢測。
6.3 JrSOC基因超表達載體的遺傳轉化和轉基因陽性檢測
采用蘸花轉化法將已構建完成的JrSOC超表達載體導入受體材料野生型擬南芥中,收獲T0代種子并繼續在含KANA的1/2 MS培養基上進行篩選,如圖(6-1)所示。

圖6-1 篩選后得到的T1代幼苗與野生型擬南芥
為了確定JrSOC基因是否成功導入擬南芥中,提取T1代擬南芥幼苗幼葉的DNA,采用特異引物進行PCR鑒定。圖(6-2)為T1代轉基因部分植株PCR檢測結果,出現了合適位置的清晰條帶,表明轉基因植株能檢測出大小一樣的基因片段,說明這些幼苗為JrSOC的陽性個體。

圖6-2 T1代轉基因擬南芥DNA的PCR檢測鑒定
觀察統計T1代植株中優良長勢的30株轉基因擬南芥的表型,發現JrSOC基因的過表達植株從移栽入穴盤到開花經過了10天,野生型植株從移栽入穴盤到開花經過了14天,轉基因植株開花時間明顯早于野生型植株,猜測JrSOC基因可能會提早開花。

圖6-3 JrSOC基因過表達擬南芥T1植株表型
6.4 結論
將構建過的表達載體pCAMBIA2300-JrSOC1-1、pCAMBIA2300-JrSOC1-2和pCAMBIA2300-JrSOC3分別轉化到野生型擬南芥中,收取T0代種子,抗生素篩選后得到抗性植株,提起抗性植株葉片的DNA經PCR檢測,最終得到T1代擬南芥共37株。觀察統計T1代植株中優良長勢的30株轉基因植株的表型,發現JrSOC基因的過表達植株從移栽入穴盤到開花經過了10天,野生型植株從移栽入穴盤到開花經過了14天,轉基因植株開花時間明顯早于野生型植株,猜測JrSOC基因可能會提早開花。
7.結論
7.1 提取“香玲”葉片總RNA,利用RT-PCR技術克隆出JrSOC1-1、JrSOC1-2、JrSOC3基因,連接載體pCambia2300、轉化JM109感受態細胞、菌落PCR后進行測序。利用生物學分析軟件對JrSOC1-1、JrSOC1-2、JrSOC3基因序列進行分析,結果如下:JrSOC1-1基因的序列長度為576bp,理論等電點為5.21,編碼蛋白的分子量為22.37kd,氨基酸數為188;JrSOC1-2基因的序列長度為626bp,理論等電點為9.10,編碼蛋白的分子量為24.02kd,氨基酸數分別為208;JrSOC3基因的序列長度為699bp,理論等電點為9.00,編碼蛋白的分子量為26.77kd,氨基酸數為232。
7.2 構建過表達載體pCAMBIA2300-JrSOC1-1、pCAMBIA2300-JrSOC1-2和pCAMBIA2300-JrSOC3,轉化野生型擬南芥觀察統計T1代植株中長勢較好的30株轉基因植株的表型,發現JrSOC基因的過表達植株開花時間明顯早于野生型,推測SOC基因與植株提早開花有關。
8.討論
通過構建表達載體pCAMBIA2300-JrSOC1-1、pCAMBIA2300-JrSOC1-2和pCAMBIA2300-JrSOC3,導入受體材料野生型擬南芥后觀察發現,轉基因植株開花時間明顯早于野生型植株,猜測JrSOC基因可能會提早開花,說明SOC1-1、SOC1-2和JrSOC3對于核桃的早實具有非常重要的作用。可推測,將這3個基因作為今后提升核桃早實率的基因之一。

