利用脫落酸和冷適應提高壇紫菜絲狀體種質的凍存效率
馬明婕 韋彩玲 朱駿凱 劉棋琴 駱其君 陳海敏 楊 銳
(1. 寧波大學浙江省海洋生物工程重點實驗室, 寧波 315823; 2. 寧波大學海洋學院, 寧波 315823)
大型海藻是海洋中重要的初級生產者和生態工程師, 具有食品、藥物、飼料和肥料等經濟價值[1]。海洋環境惡化使得海藻種群的生存和多樣性受到多種壓力的威脅[2,3]。收集并保存藻類種質資源成為保護生物多樣性和藻類育種的重要工作。組織活體繼代培養是海藻種質保存古老且常規的手段,亦是多數藻類種質庫的主要保種方式。于-196—-40℃進行冷凍保存則是藻類學家關注的另一種質保藏方法。其最大的優點在于:在凍存保護劑的作用下, 生物組織和細胞能夠在低溫導致代謝停滯的同時保持細胞結構和功能的完整性及遺傳物質的穩定性[4];并且, 凍存期間可以避免產生新的微藻、細菌或真菌污染[5]。因此, 開發和優化低溫凍存方法, 提高海藻種質的冷凍存活率一直受到藻類學家的關注。目前, 海帶、紫菜、江蘺和萱藻等很多大型經濟海藻都進行過孢子體或配子體的低溫凍存嘗試, 但大型海藻的冷凍保存普遍存在效率偏低且凍存后期恢復困難等問題[6—8]。
紫菜(Porphyrasensu lato)[9]是潮間帶重要的底棲海藻, 亦是東亞廣泛栽培的經濟藻類。與其他大型栽培海藻的情況相似, 種質退化和良種使用率不高是紫菜栽培產業面臨的主要問題[10]。保護紫菜種質資源, 擴大其收藏, 提高保種效率, 對紫菜多樣性保護、遺傳育種及產業發展至關重要。在生產中, 農戶會收集當年的成熟紫菜葉狀體作為種菜,晾干脫水后于-20℃冷凍;次年取出, 常溫復水后收集果孢子用于培育絲狀體苗。這些自然生長的紫菜群體遺傳混雜嚴重, 且冷凍大量種菜需要較多空間和能耗, 對紫菜種質的質量控制具有相當的局限性[11]。紫菜自由絲狀體是由果孢子發育而來的二倍體微觀世代, 體積小、耐受性強和遺傳性質穩定, 且易于培養和誘導調控;因此, 自由絲狀體是紫菜種質的最佳保存形式[12], 也是紫菜種質低溫凍存的重點研究對象。
影響生物組織低溫凍存的主要因素為細胞滲透壓失衡、細胞溶質濃度過度增加[13]和胞內冰晶生成[14]。凍存方法、凍存保護劑的種類、濃度和處理時間[15,16]、降溫速率、解凍溫度[12,17]及不同物種的低溫耐受能力都會影響凍存效率[18]。科學家通過凍存保護劑置換出細胞內水, 或者優化凍存程序, 其基本目的都是為了減少細胞內冰晶的形成,促使細胞形成玻璃化狀態, 以減緩凍存對細胞內膜系統的損傷[14,19]。此外, 對植物組織進行冷馴化或在低濃度玻璃化培養液中預培養也可以加強生物本身的抗冷能力, 調節細胞滲透壓、應對氧化脅迫,進而提高凍存效率[20—23]。對藻類凍存方案中凍存保護劑和凍存程序的研究已有較多報道, 而利用冷適應提高大型海藻凍存效率方案的報道則較少。
脫落酸(Abscisic acid, ABA)是一種半倍萜羧酸類植物激素, 在植物中最典型的功能為:在干旱、寒冷、高溫和失水等脅迫條件下可提高植物的抗逆能力[24]。在藻類中, ABA可以通過誘導抗氧化酶表達, 增加植物對氧化應激的耐受性以減緩失水、滲透及鹽脅迫的傷害[25]。是否可以利用ABA處理及低溫適應性培養來提高紫菜絲狀體對冷凍的耐受性, 進而提高種質冷凍保存的效率?為驗證這一假設, 本文以壇紫菜自由絲狀體為實驗材料, 擬采用ABA處理和4℃低溫誘導紫菜絲狀體自身的抗冷能力, 以期提高冷凍保存效率, 為改進紫菜種質凍存方案提供新思路和實驗參數。
1 材料與方法
1.1 實驗材料及培養
壇紫菜(Pyropia haitanensis)浙東1號(ZD-1)自由絲狀體, 由浙江省海洋生物工程重點實驗室提供。挑選色澤紅潤, 健康松散的藻團備用。培養條件:溫度20℃, 光照強度40 μmol·photons/(m2·s), 光周期12L∶12D, 寧大Ⅲ號培養液培養[26]。寧大Ⅲ號母液:990 nmol/L KNO3、57 nmol/L K2HPO4、9 nmol/L FeSO4·7H2O、54 nmol/L Na2EDTA、1 nmol/L MnSO4·H2O、0.5 mg/L VB12和5 mg/L VB1。培養液由母液與滅菌海水按1∶1000比例配置而成。
滅菌海水:鹽度為25的天然海水由0.22 μm的水系濾膜過濾并高壓蒸汽滅菌。
1.2 凍存方法
凍存保護劑由基礎溶液(0.5 mol/L山梨醇和0.01 mol/L HEPES溶于稀釋滅菌海水[12])和20%DMSO混合配置。
操作:將壇紫菜絲狀體(約1 mg鮮重)懸浮在0.75 mL的0℃的基礎溶液中。用等體積冰浴后的20%DMSO(w/v)于15min內緩慢加入懸浮液中, 使DMSO終濃度達到10%, 在4℃平衡4h。將裝有絲狀體懸液的凍存管置于程序降溫盒(Biosharp, 美國)中, 以-1℃/min的速度冷卻至-80℃, 保存24h。
解凍:在40℃水浴中迅速解凍, 管內還留有少量冰時將凍存管置于冰水浴中, 用0℃的海水在30min內逐漸稀釋7倍, 然后用200目篩絹篩去凍存液, 將絲狀體以80 mg/L的密度重懸于寧大Ⅲ號培養液中培養。解凍后1周內每天更換1次培養液。其后, 按檢測周期(10d、20d和35d)更換培養液。檢測并記錄存活率。
以此程序凍存的樣本, 作為實驗對照。
1.3 ABA和4℃冷適應處理
ABA溶液配置及處理先用無菌海水配置成1 mmol/LABA母液, 經0.22 μm濾膜過濾后稀釋成0、25、50、100、200和400 μmol/LABA溶液。取(0.1±0.02) g壇紫菜絲狀體在500 mL不同濃度的ABA溶液中恒溫搖床培養3d, 培養條件同1.1。設置3個生物學平行。
冷適應0.5 g/L壇紫菜絲狀體在4℃冰箱內黑暗處理6d, 設置3個生物學平行。
預處理后凍存實驗通過2.2的結果最終確定以100 μmol/L的ABA處理48h和4℃暗培養6d預處理后的樣本為材料, 根據1.2的凍存方法進行實驗。凍存程序完成后, 按上文進行指標的測定。設置3個生物學平行。
1.4 生理生化及分子指標檢測
藻體相對日生長率(RGR)測量不同處理組壇紫菜絲狀體初始和結束時的重量, 計算各樣品的相對日生長速率RGR, 其計算公式為[27]:
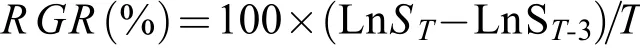
式中,ST為第T天藻體鮮重,ST-3為前一次稱量時的藻體鮮重。
PSⅡ最大光量子效率(Fv/Fm)用葉綠素熒光儀PAM(德國WAIZ公司)測定藻體的PSⅡ最大光量子效率Fv/Fm[28]。
存活率以伊文思藍染色法檢測絲狀體的存活率[29]。死細胞被染成藍色, 活細胞保持紅色。觀察統計存活的細胞(紅色)和死細胞(藍色), 計算絲狀體的存活率。

抗冷相關基因的Realtime qPCR分析參照Plant RNA Kit (OMEGA)總RNA抽提試劑盒說明書提取每個樣品的總RNA, 用TaKaRa PrieScript RT reagent Kit (TaKaRa, 中國)試劑盒反轉成cDNA。以18S rRNA基因作為內參基因, 在Light Cyber 96 System (Roche, 瑞士)儀器中檢測壇紫菜絲狀體中質膜轉運蛋白P(H+)-ATPase、酰基脂質去飽和酶(Acyl-lipid desaturase,ald)、錳超氧化物歧化酶(Mn-superoxide dismutase A,Mn-sodA)、銅/鋅超氧化物歧化酶(Cu/Zn-superoxide dismutase 1, Cu/Znsod 1)、抗壞血酸過氧化氫酶(Ascorbate peroxidase-2,apx-2)、熱激蛋白70(Heat shock protein70-4,hsp70-4)、八氫番茄紅素合成酶(Phytoene synthase-2,psy-2)、甘油醛-3-磷酸脫氫酶(Glyceraldehyde-3-phosphate dehydrogenase,gapdh)、谷胱甘肽過氧化物酶(Glutathioneperoxidase-1,gpxha-1)等編碼基因的相對表達量(表1)。不同處理設置3個生物學平行, 每個平行做3次技術重復。反應體系20 μL,擴增程序:95℃預變性3min;95℃變性5s, 60℃/55℃退火18s, 72℃延伸13s, 50個循環;在總延伸結束后, 加入溶解曲線的制備(60—95℃)步驟。用2-ΔΔCt法進行分析。

表1 目標基因的RT-qPCR引物序列Tab. 1 RT-qPCR primer sequence of the target genes
1.5 數據統計
實驗數據和統計作圖采用Origin 2018軟件, 利用SPSS 17.0進行單因素方差分析(One-way ANOVA)或雙因素方差分析(Two-way ANOVA), 采用Tukey多重比較檢驗來確定各處理間的差異顯著性。數據以平均值±標準差(Mean±SD)表示,P<0.05表示差異顯著,P<0.01表示差異極顯著。
2 結果
2.1 ABA對壇紫菜絲狀體相對日生長率的影響
ABA預處理會降低壇紫菜自由絲狀體的相對日生長率RGR(圖1), 且高濃度ABA(≥100 μmol/L)的抑制作用更為強烈(P<0.01), 當ABA濃度為200和400 μmol/L時, 絲狀體出現死亡的情況。

圖1 不同濃度ABA處理壇紫菜絲狀體的相對日生長率Fig. 1 Relative growth rate (RGR) of P. haitanensis conchocelis at treatments of different ABA concentration
2.2 ABA對壇紫菜絲狀體最大光量子效率Fv/Fm的影響
ABA抑制了壇紫菜自由絲狀體的最大光量子效率Fv/Fm(圖2)。總體看, ABA對壇紫菜的抑制作用在24h之后表現得比較明顯, 抑制強度也隨著ABA濃度的升高而加強(P<0.05)。當ABA濃度≤100 μmol/L時, 去除ABA 72h后,Fv/Fm均可恢復至正常水平(P>0.05), 但高濃度ABA(>200 μmol/L)的抑制作用則難以恢復。
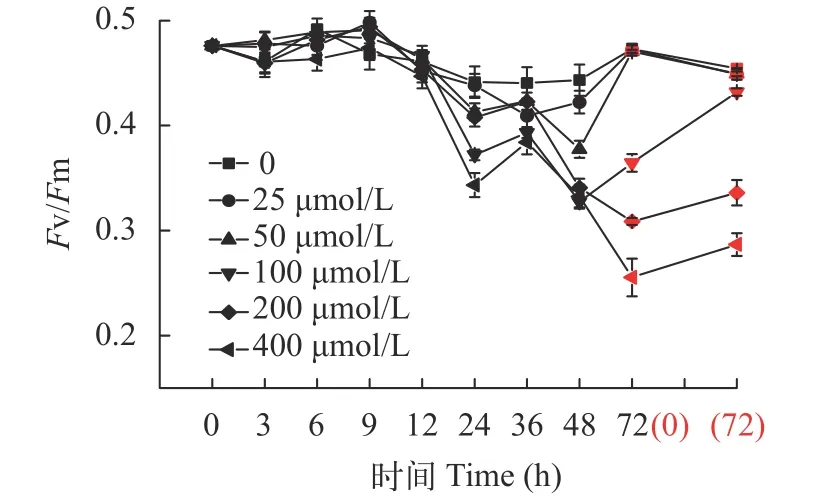
圖2 ABA對壇紫菜絲狀體的最大光量子效率Fv/Fm的影響Fig. 2 Effect of ABA on Fv/Fm of P. haitanensis conchocelis
根據既能抑制藻體生長但又不會從根本上傷害藻體生理功能的原則, 選擇100 μmol/L作為壇紫菜絲狀體凍存前預處理的ABA作用濃度。
2.3 不同處理對冷凍保存的壇紫菜絲狀體存活率的影響
在不同處理中, 壇紫菜絲狀體經-80℃凍存后的存活率及顯微形態如圖3和圖4所示。結果顯示:經4℃冷適應6d和常溫下添加外源ABA(100 μmol/L)處理48h后, 絲狀體經凍存和解凍復蘇后的實時存活率顯著高于常規凍存組(CK;P<0.05)。ABA組存活率穩定在59%, 冷適應組存活率平均穩定在89%(圖3)。反觀常規凍存組, 隨著培養時間的延長, 存活率不斷下降, 到35d時存活率僅為17%。可見即使有保護劑的保護, 冷凍仍舊會對藻體產生傷害。這些傷害會在后續培養中逐漸顯現, 最終導致種質衰亡。經過4℃冷適應和ABA處理的壇紫菜絲狀體在存活率和細胞狀態等表現上均明顯優于常規凍存組(P<0.01), 4℃冷適應組又顯著優于ABA處理組(P<0.05), 4℃冷適應6d的絲狀體細胞在凍存中受到的傷害最小, 恢復最快(圖4)。
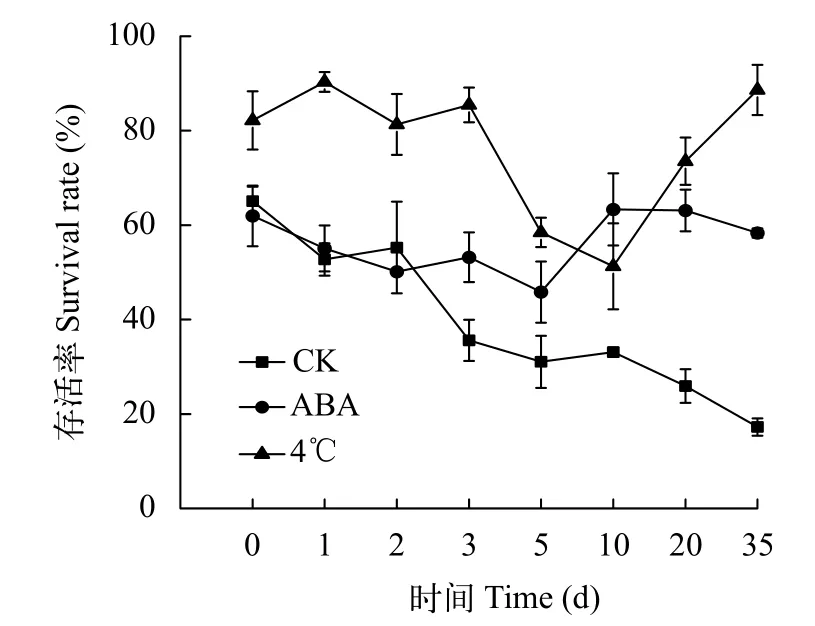
圖3 不同處理下壇紫菜絲狀體的凍存存活率Fig. 3 Survival rate of P. haitanensis conchocelis under different treatments
圖4 不同處理下壇紫菜絲狀體的顯微觀察Fig. 4 Microscopic observation of P. haitanensis conchocelis under different treatments
2.4 ABA和冷適應處理及凍存后壇紫菜絲狀體的最大光量子效率Fv/Fm
壇紫菜絲狀體經-80℃冷凍保存及解凍后, 在20℃恢復培養并測量PSⅡ最大光量子效率(Fv/Fm;圖5)。隨著培養時間的延長, 所有樣本的Fv/Fm均逐步回升, 說明凍存過的絲狀體在適宜條件下可以恢復光合作用。F: 0表明凍存完全抑制了壇紫菜絲狀體的光合作用。經ABA和冷適應處理的絲狀體在恢復過程中, 光合作用的恢復速率顯著高于對照組(P<0.05)。在培養35d時, 4℃冷適應組Fv/Fm完全恢復正常。
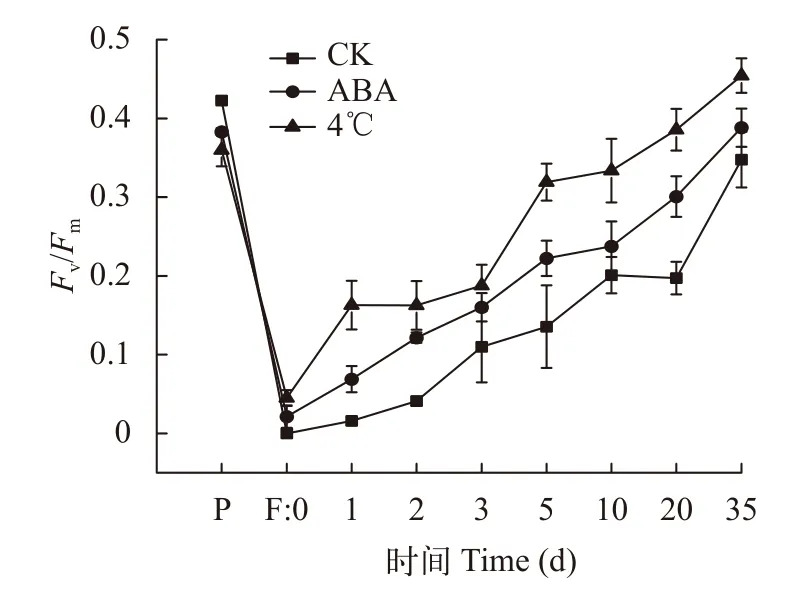
圖5 不同處理組壇紫菜絲狀體最大光量子效率Fv/FmFig. 5 Fv/Fm of P. haitanensis conchocelis under different treatments
2.5 ABA和冷適應處理對壇紫菜絲狀體抗冷相關基因表達的影響
我們以正常培養的絲狀體為對照, 對9個冷適應及抗逆相關基因進行了qRT-PCR的檢測(圖6)。結果顯示:在ABA處理組和4℃冷適應組的絲狀體中P(H+)-ATPase、Mn-sod A、Cu/Zn-sod 1、psy-2和gapdh等基因的表達均顯著上調(P<0.01), 且冷適應組上調的幅度遠大于ABA處理組(P<0.01)。2個處理組ald的表達量均顯著高于對照組(P<0.01), 但ABA處理組和冷適應組的差異不明顯(P>0.05)。ABA處理組中的hsp70-4表達量顯著高于對照組和4℃冷適應組(P<0.01)。ABA也上調了藻體apx-2基因的表達(P<0.01), 但在4℃冷適應組中該基因則表現為下調(P<0.05)。在所有組別中,gpxha表達量均無顯著變化。
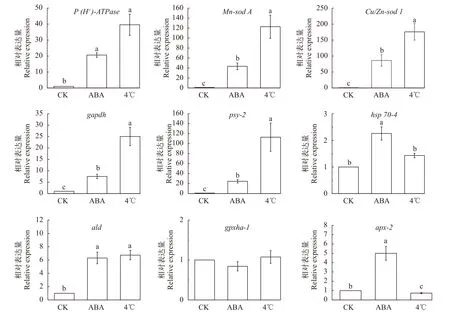
圖6 不同處理下壇紫菜絲狀體抗冷相關基因的相對表達量Fig. 6 Relative expression of cold-resistance genes of P. haitanensis conchocelis under different treatments
3 討論
3.1 強化藻體抗冷能力可提高冷凍保存的存活率
在已報道的紫菜冷凍保存研究中, 多種紫菜絲狀體凍存復蘇后的存活率最高達77%[30,31], 也有部分研究表明凍存的絲狀體存活率可達80%以上[15],葉狀體的冷凍存活率更是高達94.6%[32]。然而, 我們重復了這些方法, 發現經解凍復蘇后, 絲狀體的實時存活率雖然可以達到70%以上, 但是隨著恢復培養時間的延長, 絲狀體存活率呈顯著下降的趨勢。可見凍存對藻體的傷害可能會在復蘇后期逐漸顯現。馬寧寧等[33]報道, 生長旺盛的紫菜絲狀體凍存后存活率較低, 冷馴化的絲狀體有一定的存活率, 低光高溫誘導形成的殼孢子囊枝(即膨大藻絲)的冷凍存活率最高, 可達60%以上。然而, 在低溫和低光照的保種條件下, 殼孢子囊枝的狀態難以長期維持;且從細胞結構上看, 此階段的藻細胞液泡增大、線粒體體積增大且數量增多[34], 并不適于作為種質保存的材料。此外, 初始的藻體狀態及操作中的物理傷害(如剪碎絲狀體)也可能會影響藻體的冷凍存活率。因此, 對于提高凍存效率, 增強藻體自身對冷凍脅迫的適應能力與改善凍存方法同等重要。
采用冷馴化(-1—4℃黑暗培養8—12h)可以提高植物在液氮中冷凍的存活率[35]。Ben-Amotz等[20]發現在4℃暴露4周以上可以誘導出微藻的抗寒性,光周期和光強改變或者營養鹽缺乏也可以增強藻的抗凍能力及提高存活率。ABA對植物抵御非生物逆境脅迫起著極其重要的作用, 通過外源添加ABA可以顯著提高植物的抗逆能力[36]。例如ABA可以誘導水稻(Oryza sativaL.)[37]和萊茵衣藻(Chlamydomonas reinhardtii)[38]體內抗氧化基因的表達和抗氧化防護酶的活性, 來緩解滲透脅迫導致的氧化損傷, 從而提高整體的抗氧化防護能力。在本實驗中, 4℃低溫的抗寒鍛煉和ABA預處理使得壇紫菜絲狀體的生理狀態得到了調整, 藻體的存活率較常規凍存組提高了35%—72%。
3.2 ABA和冷適應促進了紫菜抗冷相關基因的表達
在低溫下, 細胞膜由液晶相過渡到凝膠相(玻璃化狀態), 伴隨著膜流動性降低、離子滲漏和膜蛋白失活等現象, 最終會導致細胞冷休克死亡[39]。研究發現, 嗜冷微生物和南極微藻可通過增加膜轉運蛋白和不飽和脂肪酸的含量及提高抗氧化防護酶的合成等, 達到提升細胞膜流動性、降低細胞質冰點和增強抗氧化防護, 最終降低冷凍對細胞影響的目的[40,41]。也有研究報道, 增加膜轉運蛋白P(H+)-ATPase含量和使膜脂中的脂肪酸去飽和可以提高細胞膜流通性并調節細胞內外離子的平衡[42], 最終提高紅藻的抗寒能力[43]。酰基脂質去飽和酶(Acyl-lipid-desaturase, ALD)在植物的抗寒性中亦有重要作用, 被認為是適應溫度變化時最有效的調節膜脂不飽和程度的酶[44]。在擬南芥(Arabidopsis thaliana)和煙草(Nicotiana tabacum)中,ald基因上調能夠增強植物的抗寒性[45,46]。甘油醛-3-磷酸脫氫酶(GAPDH)不僅在糖酵解和光合作用中起重要作用, 還參與膜融合和膜轉運等多種亞細胞水平的活動[47]。植物中的gapdh基因參與抑制氧化脅迫下活性氧的積累, 控制電子傳遞鏈中的電子轉運應答氧化脅迫等, 幫助抵御不良環境對植物造成的傷害[48]。在本研究中, 經過ABA和冷適應處理, 壇紫菜絲狀體的P(H+)-ATPase基因、ald基因及gapdh基因均顯著上調;由此推測, 在壇紫菜絲狀體中, 可能通過調控膜脂的飽和度和跨膜離子運輸效率來調節藻體的滲透性, 從而增強抗凍能力。
類胡蘿卜素是重要的光合色素, 在植物逆境調控中起重要作用。例如, 極地微藻可大量合成和積累類胡蘿卜素來提高抗逆能力[49]。八氫番茄紅素合成酶(PSY)是類胡蘿卜素——番茄紅素合成的關鍵酶之一[50], 已有研究表明,PSY的過表達可以提高類胡蘿卜素的含量[51]。劉欣[52]發現外源ABA(100 μmol/L)處理壇紫菜48h, 對壇紫菜類胡蘿卜素的積累有積極作用。在本研究中, ABA和冷適應均可以顯著促進壇紫菜絲狀體psy-2基因的表達, 有助于提高絲狀體的抗凍能力。
植物在非脅迫狀態下, 自由基處于動態平衡。當脅迫發生, 植物體內積累大量的活性氧(ROS), 導致膜脂過氧化, 造成細胞損傷[53]。植物中的抗氧化酶防御系統由超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、過氧化氫酶(POD)、谷胱甘肽過氧化物酶(GPX)及抗壞血酸過氧化氫酶(APX)等多種成分參與, 與非酶保護系統共同調節氧自由基代謝的平衡[54]。植物的抗寒能力與抗氧化酶系統的活性成正比[55]。藻類的SOD分為4種同工型:Fe-SOD、Mn-SOD、Cu/Zn-SOD和Ni-SOD。其中, Mn-SOD主要與光系統Ⅱ和線粒體相關聯, Cu/Zn-SOD主要存在于葉綠體中[54]。SOD和APX是植物葉綠體中主要的ROS清除酶, 有研究表明ABA對光系統Ⅱ復合體有保護作用, 而且能夠提高SOD、APX等抗氧化酶的活性[56], 這與我們的實驗結果是一致的。谷胱甘肽過氧化物酶在很多動植物中起自由基清除作用。壇紫菜的gpx基因在高溫脅迫下表現為先上調后下調的趨勢, 當壇紫菜失水達到40%時, 該基因也明顯下調[57]。然而, 在本研究中gpxha-1的表達未發生顯著性變化。APX是利用抗壞血酸為電子供體的H2O2的清除劑, 在壇紫菜葉狀體的光脅迫應答中發揮重要作用[58], 在高等植物中, APX也常用以提高植物對強光、極端溫度和鹽脅迫等的抗性[59]。但在本研究中,apx-2基因在冷適應后下調, 可能是因為冷適應是在黑暗條件下進行所導致, 具體原因有待進一步驗證。
熱激蛋白hsp70也是常見的抗逆相關基因, 在植物體內發揮分子伴侶的作用, 幫助合成防御及修復所需的各類物質, 增強植物的抗逆性[60]。ABA可以促進龍須菜hsp70大量表達, 幫助龍須菜應對高溫脅迫, 而且在壇紫菜中hsp70基因對于熱激脅迫的反應非常敏感[61]。在本研究中, ABA顯著上調了壇紫菜絲狀體hsp70-4的表達。但在冷適應組,hsp70-4基因表達變化不明顯。這說明壇紫菜絲狀體的hsp70基因對冷適應并不敏感。
hsp70-4和apx-2基因的表現提示, 壇紫菜絲狀體對ABA和冷適應的響應機制是不同的。但綜合而言, ABA處理和4℃冷適應均可提高壇紫菜絲狀體的冷凍存活率。推測, 經兩種方法預處理后, 壇紫菜絲狀體可能通過提高質膜的離子運輸效率及抗氧化酶的活性、促進細胞膜脂肪酸去飽和和增加保護色素的合成等方式調整藻體自身狀態, 提前適應即將進入的超低溫冷凍環境, 并在解凍后迅速恢復正常生理狀態, 從而提高凍存藻體的存活率。
4 結論
利用ABA(100 μmol/L)和4℃冷適應預處理壇紫菜絲狀體, 然后進行-80℃常規凍存, 能夠顯著提高紫菜絲狀體種質保存的效率。4℃冷適應法操作簡單, 效果顯著, 易于推廣, 具有較好的應用潛力。

