C8芳烴異構化徑向床反應器模型
高寧晗,唐曉津,康承琳,徐 建
(1.中國石化石油化工科學研究院,北京 100083;2.中國石油大學(北京)化學工程與環境學院)
對二甲苯(PX)是C8芳烴異構化反應的主要產物之一,廣泛應用于農藥、醫藥、香料和聚酯工業[1]。工業上,對二甲苯的生產一般采用C8芳烴異構化的方式進行[2]。C8芳烴異構化反應是在催化劑的作用下,將C8芳烴異構體鄰二甲苯(OX)、間二甲苯(MX)和乙苯(EB)轉化為高附加值PX的反應過程。目前,工業上C8芳烴異構化反應器多采用大型徑向床反應器,相比于軸向床反應器,其具有流通截面積大、流速低、費用低和經濟效益高等優勢,因而在工業上廣泛應用[3]。大型徑向床反應器是實現C8芳烴異構化工業化的核心單元設備,而建立準確的反應器模型對徑向床反應器的設計與放大具有重要的實用價值。
建立反應器模型,首先需要確定反應網絡。例如:黃劍等[4]提出將PX,MX,OX構建成三組分順序反應網絡;陳金仙等[5]在HZSM-5分子篩上驗證了二甲苯異構化三組分順序反應網絡的反應動力學,得到了最佳反應條件。此外,關于C8芳烴異構化反應網絡的組分數,徐歐官等[6]認為應增加甲苯、三甲苯、乙苯和C8環烷烴等組分;而且,考慮到體系中也含有C8直鏈烷烴,因而將C8直鏈烷烴和C8環烷烴集總為一個非芳烴混合物組分,使得模型預測的C8烴類化合物的收率與實際生產數據更加接近,模擬結果更加精確[7]。
在確定了反應網絡和組分數之后,求解C8芳烴異構化體系的反應速率常數是反應器建模的關鍵。Iliyas等[8]采用特征向量法、特征值法和試差距陣法對C8芳烴異構化反應體系的動力學參數進行了估算。陳賢峰[3]采用最小二乘法對C8芳烴異構化反應體系的動力學參數進行了估算。上述方法計算較為復雜,計算量也較大,模擬退火算法[9]具有良好的算法性能和效率,用于反應動力學參數的估算,可以快速找到多峰函數的全局最優解,近年來得到廣泛應用。
本研究采用順序反應網絡,建立C8芳烴異構化徑向床反應器模型;并基于文獻[3]中的工業運行數據,采用模擬退火算法對C8芳烴異構化反應網絡的反應速率常數進行回歸計算,分析可逆反應網絡和不可逆反應網絡對計算結果的影響。
1 模型構建
1.1 C8芳烴異構化反應網絡
將C8芳烴異構化反應系統中存在的C8環烷烴和C8直鏈烷烴集總為組分C8(N+P)[3],并將反應所得的副產物集總為組分A,加上系統中的EB,PX,MX,OX組分,構建6組分不可逆反應網絡和可逆反應網絡如圖1所示,其中由于A生成量較少且反應較溫和,故將PX生成A的反應視為不可逆反應[6]。

圖1 C8芳烴異構化反應6組分不可逆反應網絡和可逆反應網絡
1.2 反應動力學
C8(N+P),OX,MX,PX,EB之間的反應均為擬一級反應,而PX生成副產物A的副反應為擬一級不可逆反應[3]。根據反應網絡可以得到各組分的反應動力學方程,如式(1)所示。
(1)
式(1)中:a=(a1,a2,a3,a4,a5,a6)T,ai(i為組分編號,i=1~6)為組分i的質量分數;K為6×6階速率常數矩陣。
對于不可逆反應網絡,速率常數矩陣如式(2)所示。
(2)
對于可逆反應網絡,速率常數矩陣如式(3)所示。
(3)
式(2)和式(3)中,kij(i為組分編號,i=1~6;j為組分編號,i=1~5)分別對應圖1(a)和圖1(b)中反應Mj→Mi過程的反應速率常數。
1.3 反應器模型
假定徑向床反應器內溫度均一、軸向各組分濃度均一、無返混且忽略催化劑內擴散,因而可建立一維均相平推流反應器模型[6],并將徑向床反應器沿半徑方向劃分為100個等厚度的管狀體微元(最內部為圓柱體),每個微元的厚度(最內部為柱體半徑)為Δr。
根據物料平衡方程,對反應器進行物料衡算,其表達式如式(4)所示。
(4)
式中:Fi0為反應器進口物料質量流量,kg/h;Fi為反應器出口物料質量流量,kg/h;v為各組分的反應速率,kg/(m3·h);ΔV為所取微元的體積,m3;Wi為系統內各組分的質量,kg。
由于處于穩定操作狀態的反應器中物料無積累,故式(4)中的dWi/dt=0,式(4)變為式(5)。
Fi0-Fi-vΔV=0
(5)
對微元進行物料衡算,如式(6)所示。
Fi,r+Δr-Fi,r-vΔV=0
(6)
由于ΔV=Δr×S(S為微元的面積,m2),代入式(6)中,移項可得式(7)。
(7)
式中:Fi,r+Δr為進入微元的物料質量流量,kg/h;Fi,r為出微元的物料質量流量,kg/h;Δr為微元的厚度,m。
對式(7)求極限,如式(8)所示。
(8)
式中:r為所取微元距離反應器中心的距離,m;H為催化劑的填裝高度,m。其中,Fi和v可由式(9)~式(10)計算得到。
Fi=ai×VC×LHSV×ρ
(9)
(10)
式中:VC為催化劑的填裝體積,m3;LHSV為液時空速,h-1;ρ為液體物料反應溫度下的密度,kg/m3。
將式(9)代入式(8),可以得到關于組分質量分數和微元半徑的微分方程,再將式(10)帶入整理,得到式(11)。
(11)
LHSV與質量空速(MHSV)、液體物料密度(ρ)和催化劑密度(ρC)的關系如式(12)所示。
(12)
式中:MHSV為質量空速,h-1;ρC為反應溫度下催化劑的密度,kg/m3。
將式(12)代入式(11)可得:
(13)
令L=r/R,對微元距中心距離r進行無因次歸一化處理,得到式(14)。
(14)
式中:R為反應器半徑,m。
通過數值離散對式(14)進行求解,可得到各組分在反應器中不同位置的分布。當L=1時,計算得到的數值為反應器出口處各組分含量的理論計算值。
1.4 反應速率常數
求解反應速率常數是反應器建模的關鍵環節,因而本研究以計算反應器出口產物濃度與反應器工業實際出口濃度一致為原則,采用模擬退火算法對上述反應網絡中各反應的反應速率常數進行回歸計算。模擬計算選擇反應器出口各組分質量分數的計算值與工業實際值的差異程度(δ)為目標函數,通過編程進行迭代計算,使反應器出口各組分含量的計算值更接近工業運行值。當目標函數達到最小值時,即得到反應速率常數的解。再將計算得到的反應速率常數帶入模型,以求得各組分在反應器中不同位置的分布。
目標函數的計算式如式(15)所示:
(15)
式中:aexp,i、acal,i分別為由工業運行和理論計算得到的反應器出口各組分的質量分數,%;n為組分數。
2 結果與討論
2.1 模型的準確性
依據文獻[3]中的工業運行數據,在質量空速3.6 h-1條件下,采用上述模型對不可逆反應網絡與可逆反應網絡中的組分PX,MX,OX,EB,C8(N+P),A在反應器中的濃度分布進行模擬計算。不可逆反應網絡中各反應速率常數的計算結果如表1所示;可逆反應網絡中各反應速率常數的計算結果如表2所示。
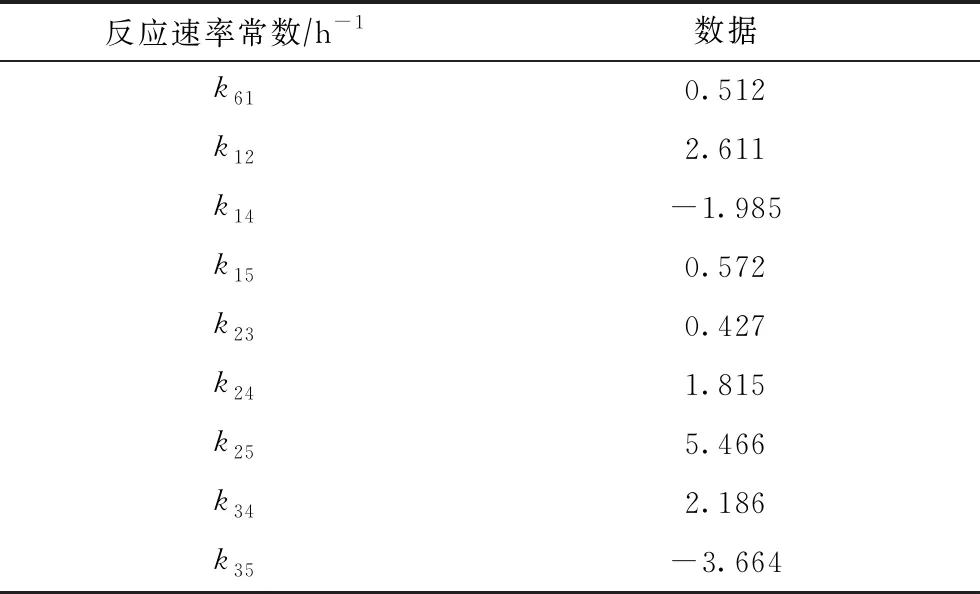
表1 不可逆反應網絡中各反應的速率常數

表2 可逆反應網絡中各反應的速率常數
從表1可以看出:k14和k35為負值,說明在不可逆反應網絡中EB→PX和C8(N+P)→OX的反應趨勢較小;比較k15,k25,k35可知,C8(N+P)轉化生成MX的反應速率比生成OX和PX的反應速率更大,說明在不可逆反應網絡中C8(N+P)主要轉化為MX;比較k34,k24,k14可知,相比于轉化為MX和PX,EB轉化為OX的反應速率更大,說明在不可逆反應網絡中EB主要轉化為OX。因此,C8(N+P)和EB均可用以增產二甲苯。
從表2可知:比較k34、k24與k43、k42可知,在可逆反應網絡中EB轉化為OX和MX的反應速率大于逆向反應速率,說明EB可用來增產二甲苯;比較k12,k14,k15可知,與C8(N+P)和EB轉化為PX的反應速率相比,MX轉化為PX的反應速率更大,說明MX→PX反應在PX生成過程中占主導。此外,不同二甲苯之間的轉化速率比二甲苯與C8(N+P)之間的轉化速率大,這是因為該反應是在催化劑的酸性活性位點上進行的,不同二甲苯間的轉化主要通過甲基轉移來實現。
將表1、表2中各反應速率常數代入反應器模型[式(14)],可以分別得到不可逆反應網絡和可逆反應網絡對應反應器出口各組分的質量分數,及其相應的工業實際運行數據,結果如表3和表4所示。
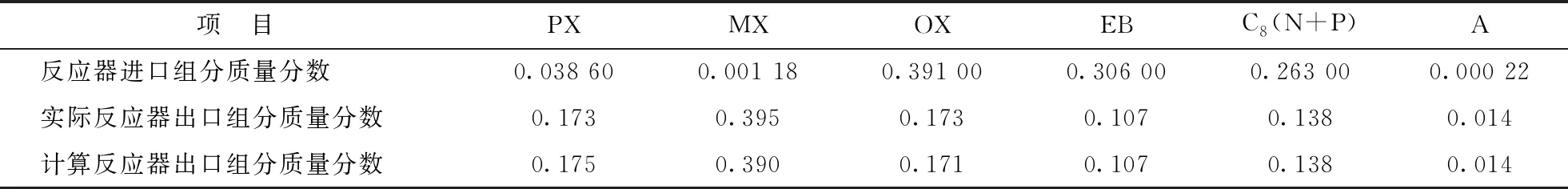
表3 不可逆反應網絡對應反應器進口、出口各組分的含量
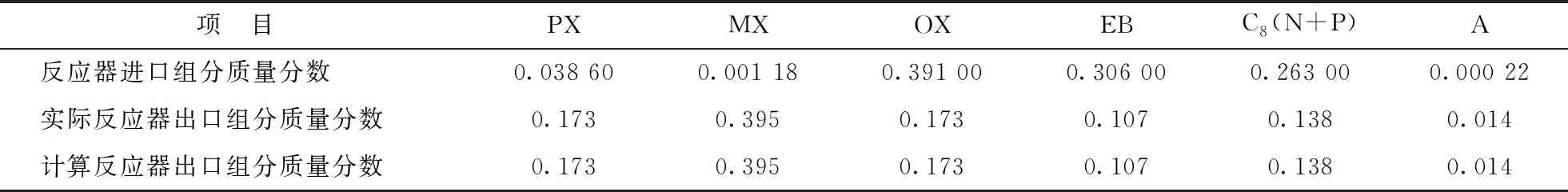
表4 可逆反應網絡對應反應器進口、出口各組分含量
由表3和表4可見,對于不可逆反應網絡,通過模型計算得到反應器出口各組分的含量與實際反應器出口各組分含量基本一致;對于可逆反應網絡,通過模型計算得到反應器出口各組分的含量與實際反應器出口各組分含量相同。這說明,對于不可逆反應網絡和可逆反應網絡,所建模型的計算結果準確性均較高;而模型對于可逆反應網絡的計算結果的準確性更好。
利用所建反應器模型,計算得到不可逆反應網絡和可逆反應網絡中各組分在反應器內徑向分布,結果如圖2所示。
由圖2可知:在不可逆反應網絡中,各組分含量從反應器中心沿徑向呈現逐漸變化的趨勢;在可逆反應網絡中,各組分含量從反應器中心沿徑向先快速變化,然后逐漸趨于平穩。在實際工業應用中,為了防止催化劑快速失活,會增加催化劑的裝填量,以保證反應器的長期穩定運行。與不可逆反應網絡相比,可逆反應網絡更符合工業實際情況。
由圖2(b)可以看出:在可逆反應網絡中,EB和C8(N+P)的含量隨著反應的進行先快速降低后趨于穩定,而MX和PX的含量先快速增加后趨于穩定,說明EB和C8(N+P)在反應過程中轉化成二甲苯;副產物A的含量隨著反應的進行持續緩慢增加,這與工業實際情況相符。
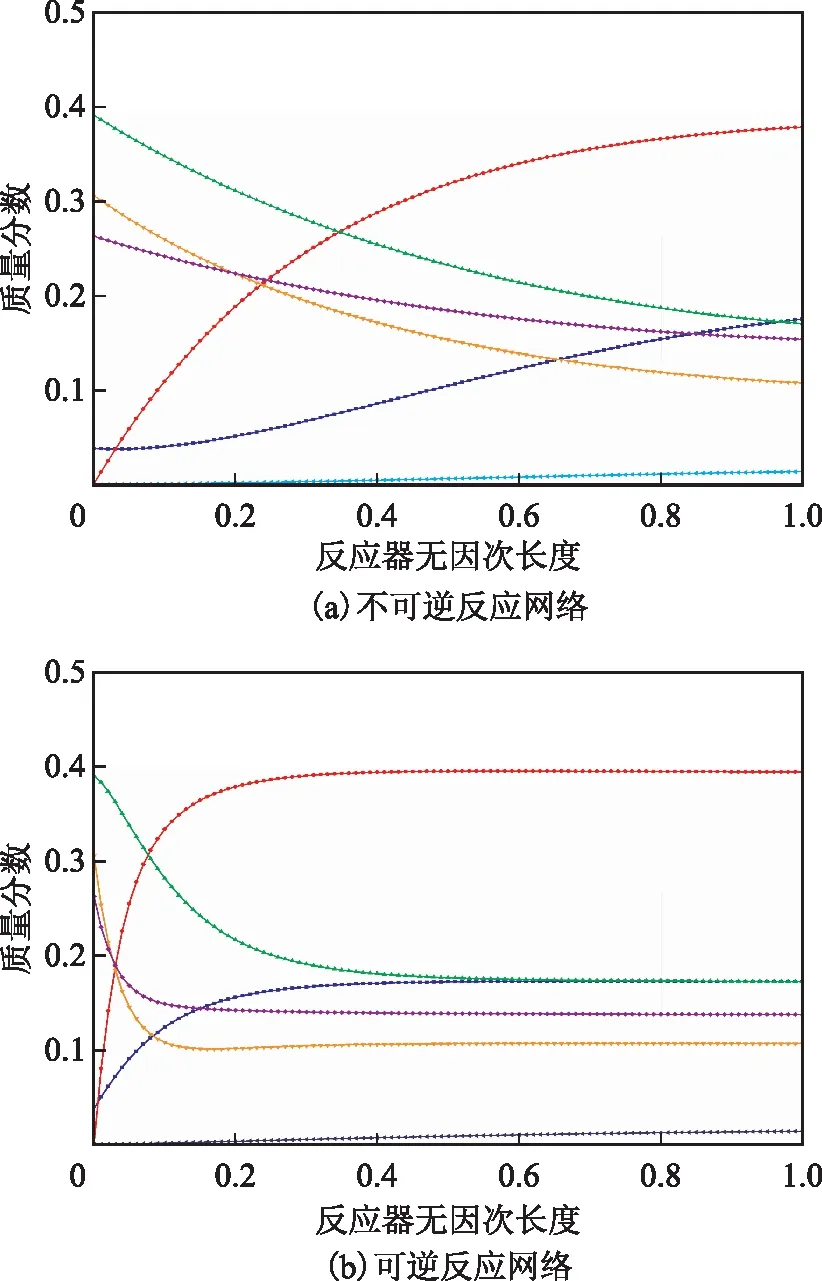
圖2 不可逆反應網絡和可逆反應網絡中各組分在反應器內的徑向分布■—PX; ●—MX; ▲—OX; ◆—C8(N+P);
2.2 反應空速對反應器內組分分布的影響
可逆反應網絡模型中,在相同溫度和壓力條件下,考察MHSV分別為1.6,3.6,5.6,9.6 h-1時反應器進口、出口各組分的含量,結果如表5所示。由表5可知,隨著空速的增大,反應物在催化劑表面上停留的時間縮短,反應器出口副產物A的含量降低,說明增大空速有利于控制芳烴加氫裂解為小分子的鏈烴,減少副產物的生成;反應器出口PX的含量先增大后減小,在MHSV為3.6 h-1時達到最大值,達到了工業生產要求,而空速過高或過低時,反應器出口PX的含量均較低,因此適宜的反應質量空速為3.6 h-1。
進而,采用所建模型模擬得到不同反應空速下各組分在反應器內徑向的含量分布,如圖3所示。
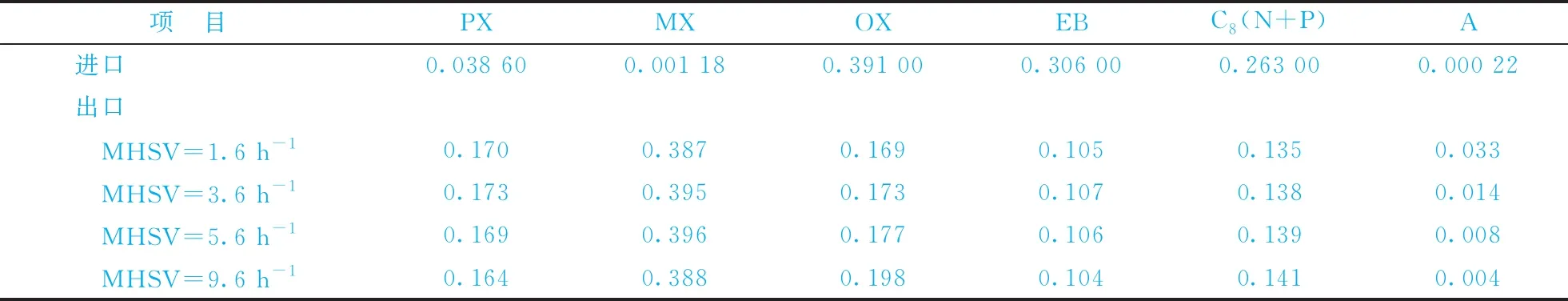
表5 不同質量空速時反應器進口、出口各組分質量分數
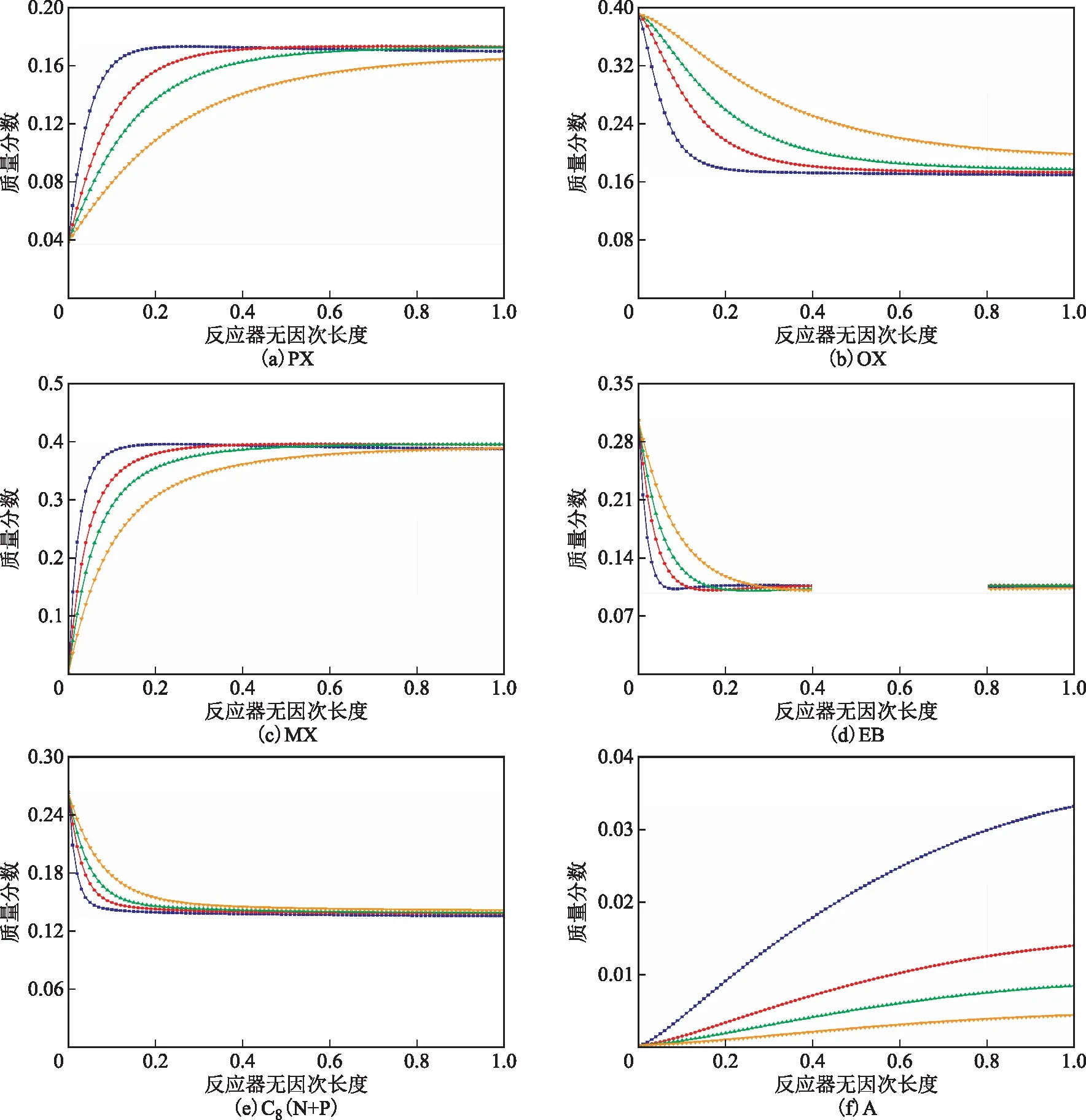
圖3 不同質量空速下反應器內各組分的徑向分布■—MHSV=1.6 h-1; ◆—MHSV=3.6 h-1; ▲—MHSV=5.6 h-1; h-1
由圖3可以看出:隨著反應空速的降低,各組分的含量沿反應器徑向的變化越來越快;當MHSV為1.6 h-1時,相比于其他反應空速,反應器內各組分的含量達到穩定狀態最快。此外,由圖3(f)可知,隨著反應空速的降低,反應物在反應器內停留的時間增加,發生副反應的可能性增大,因此隨著反應空速的降低副產物A的含量快速增長,且沿反應器徑向變化幅度逐漸增大,且一直未達到穩定狀態。
3 結 論
針對C8芳烴異構化反應過程,采用六組分順序反應網絡,建立了大型徑向床反應器模型。基于文獻中的工業運行數據,使用模擬退火算法,對反應速率常數進行了回歸計算。通過與工業實際數據的對比,模型計算得到的結果與工業實際情況基本吻合,說明所建立的反應器模型具有良好的準確性。
利用所建立的模型,分別計算了可逆反應網絡和不可逆反應網絡中各組分在反應器內各處的分布,以及反應空速對各組分分布的影響。可逆反應網絡模型計算值更接近工業實際生產情況;適宜的反應質量空速為3.6 h-1,反應空速較低會導致副產物增加,反應空速過高則會使產物中PX的含量降低。

