睫狀體平坦部濾過術與小梁切除術治療新生血管性青光眼的比較
索 龍,張 舒,馬 嚴,蔣 沁,曹國凡
0引言
新生血管性青光眼(neovascular glaucoma,NVG)的特征是虹膜出現新生血管,前房角堵塞,眼壓升高和劇烈疼痛[1]。缺血缺氧是NVG的驅動因素,常見的導致NVG的原因有增殖性糖尿病視網膜病變(proliferativediabetic retinopathy,PDR)、視網膜靜脈阻塞(retinal vein occlusion,RVO)和眼部缺血綜合征(ocular ischemic syndrome,OIS)等[2]。對于NVG的治療除了控制原發疾病之外,降眼壓藥物難以奏效,需要手術干預[3]。以往作為NVG可選手術有前房濾過性手術[包括小梁切除(trabeculectomy,TRA)、青光眼閥植入]、睫狀體破壞性手術(包括睫狀體光凝術、睫狀體冷凍術)等[4]。但是,睫狀體破壞性手術最終以眼球萎縮、失明而告終[5];而前房濾過性手術往往難以控制眼壓,最終因疼痛、失明而眼摘[6]。因此,尋找更好的治療NVG的手術方法成為青光眼醫生追求的目標。受后鞏膜切除及睫狀體上腔引流理念[7]在多種難治性青光眼手術中運用的啟發,本研究選擇睫狀體平坦部濾過術(pars plane filtering,PPF)在部分NVG患者中運用,報道如下。
1對象和方法
1.1對象回顧性病例對照研究。收集2020-04/2021-04在南京醫科大學眼科醫院治療的NVG患者27例27眼,將行睫狀體平坦部后房濾過手術的患者12例12眼納入PPF組,將行小梁切除手術的患者15例15眼納入TRA組。納入標準:(1)術前根據《中國新生血管性青光眼診療專家共識(2019年)》[8]診斷為NVG;(2)術前眼壓≥21mmHg且經藥物治療無法控制眼壓;(3)年齡31~81歲。排除標準:(1)近3mo內接受抗青光眼手術、抗血管內皮生長因子(VEGF)治療、激光治療(包括視網膜光凝、睫狀體光凝);(2)伴有影響眼部治療效果評價的病史、治療史和全身性疾病。兩組患者年齡、性別、致新生血管的原發病、術前最佳矯正視力(best corrected visual acuity,BCVA)差異均無統計學意義(P>0.05,表1),其中PPF組原發病為PDR患者8例8眼,視網膜中央靜脈阻塞(CRVO)患者4例4眼;TRA組中原發病為PDR患者9例9眼,CRVO患者3例3眼,慢性葡萄膜炎患者1例1眼,其他原因2例2眼。本研究遵循《赫爾辛基宣言》,并得到本院倫理委員會批準。術前均向患者及家屬交代手術方式,并簽署手術知情同意書。

表1 兩組患者術前一般情況
1.2方法
1.2.1手術方法
1.2.1.1PPF術常規消毒鋪巾,暴露術眼,球結膜浸潤麻醉,開瞼器開瞼。上方角鞏膜緣作固定縫線向下固定眼球。作以穹窿部為基底的球結膜瓣,電凝止血(圖1A)。制作以角膜緣為基底的鞏膜瓣,大小約5mm×5mm,厚度約1/2鞏膜厚度(圖1B)。鞏膜瓣下與球結膜瓣下使用0.02%的絲裂霉素濕敷3min,生理鹽水完全沖洗干凈。距角膜緣約4mm處鞏膜瓣下切除約2mm×1mm深層鞏膜組織(圖1C),行睫狀體平坦部穿透切除,大小約2mm×1mm(圖1D)。10-0線縫合淺層鞏膜瓣,瓣下注射黏彈劑少許;10-0線縫合球結膜瓣。術畢球結膜下注射頭孢拉定50mg+地塞米松2mg。阿托品凝膠散瞳,結膜囊涂妥布霉素地塞米松眼膏。

圖1 PPF手術步驟 A:作以穹窿部為基底的球結膜瓣;B:制作以角膜緣為基底的鞏膜瓣;C:切除深層鞏膜組織;D:切除睫狀體平坦部組織。
1.2.1.2TRA術結膜瓣、鞏膜瓣制作,絲裂霉素處理同PPF術。鼻側角膜緣作輔助側切口,切除鞏膜瓣下大小約2mm×2mm的小梁與角膜組織。10-0線縫合淺層鞏膜瓣,瓣下注射黏彈劑少許;10-0線縫合球結膜瓣。從側切口注入適量消毒空氣,形成前房。后續處理同PPF術。
1.2.2觀察指標隨訪至術后3mo,采用非接觸式眼壓計檢測眼壓的變化;裂隙燈顯微鏡觀察濾過泡、角膜、虹膜、前房等情況;眼底鏡觀察玻璃體、視網膜等情況;眼前節照相、超聲生物顯微鏡(UBM)觀察并記錄濾過泡及濾過通道情況,并根據UBM檢查記錄圖像分別從不同軸向觀察前房形態改變情況;采用標準對數視力表測量BCVA,結果轉換為LogMAR視力進行統計學分析,其中數指記為1.6,手動為2.0,光感為2.5,無光感為3.0[9]。根據術后眼壓及并發癥的情況評價手術治療效果,以未用降眼壓藥物的情況下眼壓≤21mmHg且未發生任何嚴重術后并發癥為手術完全成功[4]。參照Sihota等[10]利用短縫燈光束改進的Van Herick方法,根據裂隙燈顯微鏡下垂直短光束照射下的周邊前房深度(PACD)與周邊角膜厚度的比值,將PACD分為四級:<1/4為Ⅰ級,1/4~1/2為Ⅱ級,>1/2~1為Ⅲ級,>1為Ⅳ級。
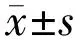
2結果
2.1兩組患者手術情況術后3mo,PPF組患者手術完全成功率(92%,11/12)高于TRA組(53%,8/15),差異有統計學意義(P=0.043)。
悠悠揚揚:是的,老師,現在這種想法被察覺出來了,也有一些改變。但是有些時候,還是會陷入這種失落的情緒里。
2.2兩組患者手術前后眼壓情況術前,兩組患者平均眼壓比較差異無統計學意義(t=0.294,P=0.771)。手術前后兩組患者平均眼壓比較具有時間差異性(F時間= 43.111,P時間<0.001),但無組間差異性(F組間= 0.492,P組間= 0.489),時間與分組間無交互作用(F交互= 0.636,P交互= 0.675)。兩組患者術后不同時間點平均眼壓較術前均降低,差異均有統計學意義(P<0.05),見表2。兩組患者手術前后眼壓變化曲線見圖2。

圖2 兩組患者手術前后眼壓變化曲線。
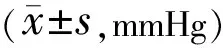
表2 兩組患者手術前后眼壓的比較
2.3兩組患者手術前后視力情況術后3mo,兩組患者BCVA分別與術前比較、組間比較差異均無統計學意義(P>0.05),見表3。
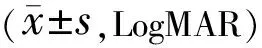
表3 兩組患者手術前后BCVA比較
2.4兩組患者手術前后PACD分級情況術前兩組間PACD分級情況比較差異無統計學意義(P>0.05);術后1wk,PPF組PACD較術前加深,差異有統計學意義(P<0.05),而TRA組PACD較術前差異無統計學意義(P>0.05),但PPF組PACD較TRA組加深,差異有統計學意義(P<0.001),見表4。

表4 兩組患者手術前后PACD分級情況比較 (Ⅰ級/Ⅱ級/Ⅲ級/Ⅳ級,眼)
2.5兩組患者術后前房形態情況根據UBM前房檢查記錄圖像,分別從不同軸向觀察前房形態,PPF組患者術后房角開放、前房加深,散瞳狀態下周邊虹膜往往向下塌陷呈L形;而TRA組患者術后前房形態與術前比較無變化(圖3)。

圖3 兩組患者手術前后UBM圖像 A:PPF組術前;B:PPF組術后1mo;C:TRA組術前;D:TRA組術后1mo。
2.6兩組患者術后眼前節情況術后1d,兩組患者虹膜新生血管均開始減少,術后1wk睫狀充血消失,角膜變透明,虹膜表面新生血管基本消退,見圖4。

圖4 兩組患者手術前后眼前節情況 A:PPF組術前;B:PPF組術后1d;C:TRA組術前;D:TRA組術后1d。
2.7兩組患者術后濾過泡和濾過通道情況術后1wk,兩組患者均有濾過泡形成,見圖5。術后1mo,UBM示兩組患者濾過通道通暢,PPF組濾過通道位于睫狀體平坦部,而TRA組位于房角,見圖6。

圖5 兩組患者術后濾過泡情況 A:PPF組;B:TRA組。

圖6 兩組患者術后濾過通道UBM檢查圖像 A:PPF組;B:TRA組。
2.8兩組患者術后并發癥情況隨訪至術后3mo,PPF組術后前房出血發生率較TRA組低,差異有統計學意義(P<0.05),但兩組脈絡膜脫離、術后低眼壓發生率差異無統計學意義(均P>0.05),見表5。隨訪期間兩組患者均未發生眼內炎、視網膜脫離等并發癥,無眼球萎縮。

表5 兩組患者術后并發癥情況 眼(%)
3討論
術后眼壓狀況是評判青光眼濾過性手術成功與否的關鍵指標。本研究中,術后隨訪期內,雖然PPF組與TRA組術后眼壓平均水平都顯著下降,但PPF組在術后3mo與TRA組手術完全成功率有顯著差異,證明PPF在NVG術后長期維持眼壓方面相較于TRA的優越性(圖2)。有學者利用動物模型進一步分析了PPF術后房水引流的主要途徑[15]:(1)經濾過口至結膜下,由結膜血管吸收;(2)經前房角進入睫狀體外側和鞏膜內側之間的Fantana間隙,被海綿狀組織吸收;(3)經葡萄膜鞏膜途徑,由脈絡膜上腔、睫狀體、前鞏膜、后鞏膜、脈絡膜吸收。以上引流路徑保證了PPF能夠有效引流房水,降低眼壓。該模型與本研究中眼壓降低的機制較吻合。此外,PPF手術以睫狀體平坦部為切口,此部位寬約4mm,術中可操作空間大,能夠作出較大的濾過孔,增加房水的濾過[16]。NVG濾過術后眼內新生血管生長因子、炎癥因子往往通過濾過孔進入鞏膜瓣下、球結膜下,導致鞏膜瓣及球結膜的瘢痕增生、濾過口堵塞,這也是導致常規TRA術應用于NVG失敗的原因之一。PPF術濾過孔在角鞏膜緣后4mm,濾過液主要在Tenon囊及其后疏松的筋膜吸收,術后濾過孔瘢痕化及堵塞的概率低,能夠在較長時間內保持濾過孔的有效濾過[17]。本研究中患者術后均出現濾過泡(圖5),UBM檢查顯示有濾過通道(圖6),證明不僅濾過有效,而且能維持較長時間。眼壓的降低使眼前節缺血得到改善[18],本研究中兩組患者均在術后出現虹膜新生血管減少、充血減輕(圖4)。兩組患者術后視力與術前相比差異均無統計學意義,多數患者視力保持穩定,說明PPF手術通過控制眼壓,阻止了NVG的發展以及視力減退。
術后淺前房是TRA為代表的前房濾過性手術術后常見的并發癥,也是誘發惡性青光眼的常見原因[19]。本研究發現,PPF組術后周邊及中央前房深度較術前加深,術后各隨訪時間點周邊前房深度較TRA組加深,術后前房形態發生改變(圖3)。其動力學原因是房水經后房引流時,后房較前房壓力首先降低,兩者間存在壓力差,推動晶狀體虹膜隔向后房移動,前房深度因此加深;而在TRA組,由于房水經角鞏膜緣濾過,前房壓力相較于后房降低幅度大,前后房壓力差會推動晶狀體虹膜隔向前房移動,這是前房濾過手術后淺前房的原因之一[20]。由此可見,PPF術后能夠增加前房深度,減少了惡性青光眼的發生率[21]。
眼內出血是青光眼術后的另一常見并發癥[22-23]。本研究中,PPF組患者術后眼內出血發生率較TRA組低,分析原因有以下兩點:(1)該手術方式不選擇充血嚴重的前房作為手術入路,避開了損傷有新生血管的虹膜及房角,減少出血的可能性;(2)作為手術切口的睫狀體平坦部沒有較大動脈供應[24],只有極少管腔極小的血管,而且手術切口周圍睫狀肌收縮時也會壓迫血管,起到了止血作用。此外,脈絡膜脫離、眼內感染、眼球萎縮等也是青光眼濾過性手術術后常見的并發癥[25]。本研究中,PPF組有1例、TRA組有3例患者發生術后脈絡膜脫離,經治療后好轉。兩組患者隨訪期內均未出現眼內感染及眼球萎縮。
綜上所述,PPF術能夠有效降低并維持NVG患者的眼壓,術后前房加深,阻止患者視力進一步喪失,而且術后前房出血發生率低,未觀察到嚴重并發癥,是NVG治療有效且安全的手術方式。此外,PPF術的操作難度與復雜程度與TRA術相當(圖1),對于已掌握TRA手術的醫生均易開展。但本研究為回顧性研究,樣本量較小,故存在局限性。而且,我們認為PPF術目前尚不能代替TRA術作為其他類型青光眼手術的首選方式。隨著對PPF術原理、機制的深入研究,該手術方式有望擴大應用范圍。

