基于GC-MS分析短波紫外線處理采后香蕉揮發性組分
陳銘中 ,秦小明,鐘旭美,林海生
1廣東海洋大學食品科技學院,湛江 524088;2陽江職業技術學院食品與環境工程系; 3陽江市功能性食品研發與質量評價重點實驗室,陽江 529566
香蕉(Musaspp.)是世界上第四大消費水果,在中國水果產量位居第五,其中廣東、廣西和海南等地是主要產區[1]。香蕉營養豐富,含多種人體所需的微量元素,其收獲后不耐貯藏,容易腐爛變質,而揮發性組分是評價香蕉等果蔬的新鮮程度的重要品質指標。固相微萃取(solid phase microextraction,SPME)具有無污染、成本低、操作簡單方便等優點[2],是目前樣品中揮發性組分測定的一種常用的前處理技術。SPME與GC-MS聯合測定樣品的揮發性組分是廣泛應用的一種模式,要得到研究樣品的揮發性組分并準確地鑒定混合物的化學成分,其關鍵的技術包括合適的萃取頭、萃取條件、獲取的質譜數據的質量、豐富的質譜庫和良好的定性鑒定參數。目前關于香蕉揮發性組分的報道較多,Tao等[3]應用PDMS萃取頭分析鑒定出成熟香蕉的揮發性組分39個;Zhu等[4]采用SPME-GC-MS對不同成熟階段香蕉的揮發性組分進行了鑒定分析,確定了黃熟階段香蕉的揮發性組分主要有41個;Shen等[5]以SPME-GC-MS分析成熟與未成熟香蕉中的揮發性組分,比較了二者的化學成分差異,鑒定出成熟香蕉有30個揮發性組分。近年來根據報道,應用合適劑量的短波紫外線(short-wave ultraviolet,UV-C)用于水果和蔬菜的保鮮,能夠增強果蔬的防御系統,減少外界因素的傷害,提高果蔬的品質和延長其貯藏時間[6]。盡管已有采用SPME-GC-MS分析香蕉揮發性組分的報道,但有關UV-C處理后貯藏至黃熟期的香蕉揮發性組分差異的研究尚未見報道。
本研究將在正交試驗設計優化組合得到尋找SPME萃取的最優參數基礎上,采用MS-DIAL軟件減少重疊峰、背景信號的干擾,鑒定出香蕉的揮發性組分,進而通過數理統計分析手段比較UV-C處理后香蕉的揮發性組分差異,評價UV-C處理采后香蕉的貯藏對其香氣的影響效果。
1 材料與方法
1.1 材料與試劑
本實驗以成熟香蕉果肉為實驗材料。氯化鈉(國藥集團化學試劑有限公司);分析純 2-辛醇(上海源葉生物科技有限公司);標準品正構烷烴混標(C7~C40,1 000 μg/mL;GC≥99.5%)(上海安譜實驗科技股份有限公司)。
1.2 儀器與設備
QP2020型氣相色譜-質譜聯用儀(GC/MS;日本島津儀器有限公司);島津 SH-Rxi-5Sil MS 氣相色譜柱;50/30 μm DVB/CAR/PDMS、100 μm PDMS、65 μm PDMS/DVB、75 μm CAR /PDMS萃取頭,SPME手動進樣器(美國Supelco公司);SPME專用襯管(島津(上海)有限公司);90-2A磁力加熱攪拌器(天津市賽得利斯實驗分析儀器制造廠);SHT -060SD超聲波清洗機(深圳市深華泰超聲洗凈設備有限公司);FA224電子天平(上海舜宇恒平科技儀器有限公司);A11分析研磨機(德國IKA公司)。
1.3 實驗方法
1.3.1 SPME萃取頭的選擇[7]
準確稱取4份2.0 g經均勻研磨的香蕉果肉,分別置于20 mL 的頂空瓶中,加入飽和氯化鈉溶液5 mL,蓋上頂空瓶蓋,放入恒溫加熱磁力攪拌器中,在40.0 ℃、800 rpm轉速磁力攪拌器上攪拌5 min。均勻后,在超聲波清洗機中超聲平衡20 min,在40.0 ℃水浴,用4種老化后不同的萃取頭DVB/CAR/PDMS、PDMS、PDMS/DVB、CAR/PDMS分別插入頂空瓶中萃取40 min。萃取結束后,注入GC儀解析3 min,進行GC-MS分析。根據總峰面積結合鑒定峰數目,分析不同萃取頭的影響。
1.3.2 SPME萃取前超聲平衡時間的影響[8]
準確稱取5份2.0 g經均勻研磨的香蕉果肉,分別置于20 mL的頂空瓶中,加入飽和氯化鈉溶液5 mL,蓋上頂空瓶蓋,放入恒溫加熱磁力攪拌器中,在40.0 ℃、800 rpm攪拌器攪拌5 min。均勻后,分別在超聲波清洗機中超聲平衡10、15、20、25、30 min,用“2.1”項優選的萃取頭插入頂空瓶中萃取40 min。萃取結束后,注入氣相色譜儀解析3 min,進行GC-MS分析。根據總峰面積結合總峰數目,分析超聲平衡時間的影響。
1.3.3 SPME萃取樣品量的影響[9]
準確稱取2.0、3.0、4.0、5.0、6.0 g經均勻研磨的香蕉果肉,分別置于20 mL的頂空瓶中,加入飽和氯化鈉溶液5 mL,蓋上頂空瓶蓋,放入恒溫加熱磁力攪拌器中,40.0 ℃,轉速為800 rpm磁力攪拌器上攪拌5 min,均勻后,分別于在超聲波清洗機中超聲平衡20 min,用“2.1”項優選的萃取頭插入頂空瓶,40.0 ℃水浴萃取40 min。萃取結束后,注入氣相色譜儀解析3 min,進行GC-MS分析。根據總峰面積結合總峰數目,分析樣品加入量的影響。
1.3.4 SPME萃取溫度的影響
準確稱取5份2.0 g經均勻研磨的香蕉果肉,分別置于20 mL的頂空瓶中,加入飽和氯化鈉溶液5 mL,蓋上頂空瓶蓋,放入恒溫加熱磁力攪拌器中,40.0 ℃,轉速為800 rpm磁力攪拌器上攪拌5 min,均勻后,在超聲波清洗機中超聲平衡20 min,用“2.1”項優選的萃取頭插入頂空瓶,分別于30.0、40.0、50.0、60.0、70.0 ℃水浴萃取40 min。萃取結束后,注入GC-MS聯用儀解析3 min,進行GC-MS分析。根據總峰面積結合總峰數目,分析萃取溫度的影響。
1.3.5 GC-MS條件
參考Dou等[10]的實驗條件,并稍做修改。
色譜條件:SHIMADZU SH-Rxi-5sil MS(30 m×250 μm×0.25 μm)毛細管色譜柱,載氣為氦氣,其他色譜條件進行比較篩選后確定。程序升溫,初始溫度40 ℃,保持1 min;以2 ℃/min的速率升至60 ℃;保持2 min;再以5 ℃/min的速率升至150 ℃,保持2 min;以10 ℃/min的速率升至180 ℃,保持1 min;載氣為高純氦(He),流速為1.0 mL/min;進樣口溫度為220 ℃,不分流。
質譜條件:EI電離源;電子能量70 eV,電壓350 V,掃描范圍m/z35~400。
1.4 正交試驗設計
根據單因素試驗結果,確定SPME萃取的超聲時間、樣品量和溫度3個水平(見表1),選用L9(34)正交表進行超聲時間、樣品量和萃取溫度三個參數優化組合,以總峰面積為評價指標進行分析,由正交試驗的結果得到的組合進行驗證試驗。
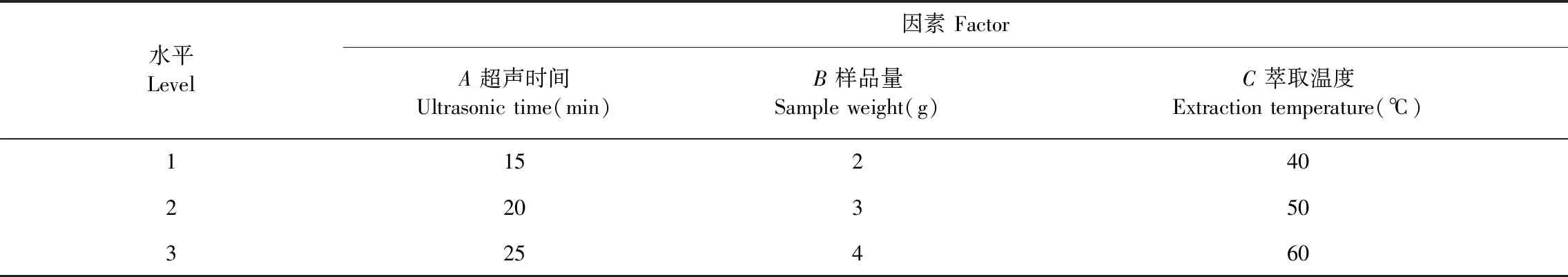
表1 正交試驗因素與水平Table 1 Factors and levels of orthogonal experiment
1.5 UV-C處理組和對照組香蕉的揮發性組分定性和定量分析
1.5.1 香蕉樣品
綠熟香蕉采摘于廣東省陽春市果園,八成熟,挑選大小一致、無病害、無損傷的香蕉,當天運回實驗室,把香蕉去柄分開,用自來水緩慢清洗香蕉果實表面物理雜質,再用蒸餾水潤洗三遍,風扇晾干,隨機分為對照組和UV-C處理組。根據前期實驗,確定UV-C處理組照射劑量為0.02 kJ/m2劑量。先將UV-C燈(飛利浦,20 W)打開,待能量穩定后,用0.02 kJ/m2劑量的紫外線照射香蕉,對照組不照射。對照組和處理組香蕉放置于恒溫恒濕箱(溫度25 ℃、濕度85%)中避光貯藏,在第18天采對照組和處理組樣品,將香蕉果肉快速切碎,用液氮預冷后研磨成勻漿,用于GC-MS測定。
1.5.2 Kováts保留指數(RI)測定
取稀釋濃度至100 μg/L的正構烷烴C7~C40混合標準溶液1.0 μL,按“1.3.5”的GC-MS條件測定,在AMDIS軟件建立本實驗的保留指數校正庫(RIcal),采用Kováts程序升溫公式[11]計算揮發物的實際保留指數值(RIact),RIact計算公式如式(1)。
(1)
式中,RIact為本實驗條件下的實際保留指數值,n為正構烷烴的碳原子數,tR(x)為待鑒定的揮發性組分的保留時間,tR(n)、tR(n+1)分別為最鄰近揮發性組分x的正構烷烴的保留時間,tR(n)位于組分x的左側,tR(n+1)位于組分x的右側。
1.5.3 定性和定量分析
應用正交試驗優化后的參數進行香蕉揮發性組分的HS-SPME萃取和GC-MS測定,將原始數據在島津GC-MS工作站中轉為CDF格式,導入MS-DIAL ver 4.48軟件進行色譜峰解卷積、匹配、對齊等處理[12]后,得到MSP文件,導入NIST 17質譜庫進行組分搜索與鑒定,鑒定選取的參數是未知組分在NIST 17質譜庫中的正向匹配度(match factor,MF)、反向匹配度(reverse match factor,RMF)均≥800,同時參考未知組分的RIact值與NIST 17質譜庫的RI參考值(RIref)最接近原則,確定該組分名稱。將組分信息數據導入SIMCA 14.1軟件進行正交偏最小二乘法判別分析(OPLS-DA),根據P<0.05與差異倍數(fold change,FC)>1.2或FC<0.83篩選出對照組和處理組的差異組分,應用R言語繪制火山圖。
采用內標法進行半定量分析,內標物2-辛醇的濃度為0.99 mg/mL,加標體積為5.0 μL,計算公式如式(2):
(2)
式中:Cx為某揮發性組分的濃度,Ax為某揮發性組分的峰面積,Cs為添加到香蕉樣品中的內標物2-辛醇的濃度,As為內標物2-辛醇的峰面積。
2 結果與分析
2.1 SPME萃取頭的選擇
SPME聯合GC-MS進行揮發性組分測定能夠有效地分析出食品中的揮發性組分,是目前最常用和有效的分析方法,而選擇合適的SPME萃取頭是十分關鍵的步驟[2]。SPME萃取頭的纖維涂層不同,極性和吸附對象也不同,對研究對象的萃取效果會有很大差異。本研究應用DVB/CAR/PDMS(50/30 μm)、PDMS(100 μm)、PDMS/DVB(65 μm)、CAR/PDMS(75 μm)4種不同極性的SPME萃取頭萃取香蕉果肉揮發性組分,以確定最合適的萃取頭。4種不同的SPME萃取頭萃取香蕉揮發性組分的GC-MS總離子流圖、總峰面積和鑒定物質數量見圖1,圖1B的鑒定峰數是根據各種萃取頭得到的GC-MS圖,在島津GC-MS工作站中設定匹配相似度≥80%,進行定性鑒別篩選出來的目標化合物的數量。由圖1A可知,CAR/PDMS萃取頭得到的離子流信號明顯強于其他3種萃取頭,結合圖1B,4種萃取頭萃取得到的香蕉揮發性物質的總峰面積順序是CAR/PDMS>DVB/CAR/PDMS>PDMS>PDMS/DVB;鑒定峰數順序是CAR/PDMS(90個)>PDMS(70個)>DVB/CAR/PDMS(68個)>PDMS/DVB(54個),CAR/PDMS萃取頭得到的總峰面積大于其他3種的總峰面積之和,同時可良好地鑒定出化合物的數量(峰數)明顯大于其他3種萃取頭,因此在后續的SPME操作中,采用CAR/PDMS萃取頭。

圖1 4種不同SPME萃取頭萃取香蕉揮發性組分的影響Fig.1 Influence of four different SPME extraction heads on banana volatile components extraction注:(A)GC-MS總離子流圖;(B)總峰面積和鑒定峰數量。Note:(A)GC-MS total ion chromatograms;(B)Total peak area and number of identified peaks.
2.2 SPME萃取前的超聲時間影響
研磨后的香蕉果肉在加入飽和氯化鈉溶液后,具有較大的粘稠性,不利于揮發性組分的逸出,在SPME萃取前采用一定時間的超聲處理,利用超聲波震蕩產生的強烈空化效應、熱效應等可以提高分子運動速度,加快傳質過程,使揮發性組分快速逸出至頂空瓶液面上空達到平衡,有利于后續SPME萃取[13]。SPME萃取前的超聲波震蕩平衡的影響見圖2,由圖2可知,隨著超聲平衡時間增大,總峰面積也增大,在超聲平衡時間達到20 min時,總峰面積達到最大,再增加超聲時間,總峰面積反而下降,可能是超聲時間過長,導致溫度過高,造成揮發性組分分解和重新溶于溶液中;離子流圖的總峰數也是隨超聲時間增加而增長,在25 min時達到最大值。綜合總峰面積和總峰數情況,本試驗采用超聲時間為15、20、25 min進行正交試驗。
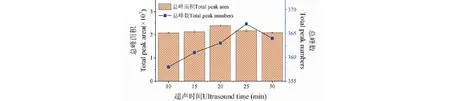
圖2 超聲時間對SPME萃取香蕉揮發性組分的總峰面積和總峰數的影響Fig.2 Effect of ultrasonic time on total peak area and peak number of volatile compounds extracted from banana by SPME
2.3 樣品量
樣品量對SPME萃取香蕉揮發性組分的總峰面積和總峰數的影響如圖3所示,總峰面積從2.0 g到3.0 g是增加的過程,且3.0 g的總峰面積為最大,從4.0 g到6.0 g,總峰面積呈下降趨勢,主要是因為剛開始隨著樣品用量的增加,逸出的揮發性組分富集在頂空瓶內液面上部的濃度增加,萃取頭富集的揮發性組分的量也增加,但隨著樣品量的增加,樣品溶液明顯粘稠,特別是樣品量增加到6.0 g時,磁力攪拌均勻變得相當困難,不能再增加樣品用量,粘稠的樣品溶液不利于揮發性組分的逸出,因此萃取頭能夠富集的揮發性組分總量下降,總峰面積相應變小;總峰數也有總峰面積類似的變化趨勢,在樣品量為4.0 g時,離子流圖的總峰數最大。綜合總峰面積和總峰數情況,本試驗采用樣品量為2.0、3.0、4.0 g進行正交試驗。
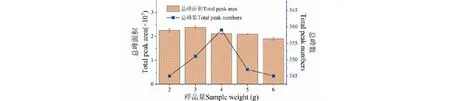
圖3 樣品量對SPME萃取香蕉揮發性組分的總峰面積和總峰數的影響Fig.3 Effect of sample weight on total peak area and peak number of volatile compounds extracted from banana by SPME
2.4 萃取溫度
溫度對HS-SPME萃取效果影響較大,一般來說提高溫度可以加快揮發性組分逸出至頂空瓶上部空間,增加液面以上空間的揮發性組分濃度,縮短平衡時間,可提高萃取效率,但增加至一定溫度后,過高溫度反而影響揮發性組分在氣相和萃取涂層的分配比例,降低萃取頭的揮發性組分吸附量。萃取溫度對HS-SPME的影響見圖4。由圖4可知,隨著SPME的萃取溫度升高,總峰面積逐漸增大,當萃取溫度為50 ℃時,總峰面積達到最大值,溫度繼續升高,總峰面積反而下降。而相應的總峰數在40 ℃時最大,溫度繼續升高,總峰數也下降了。可能是溫度過高引起化合物發生分解或化學變化,造成化合物的分配和種類發生變化,進而影響萃取頭的萃取效果。綜合總峰面積和總峰數情況,本試驗采用萃取溫度為40、50、60 ℃進行正交試驗。
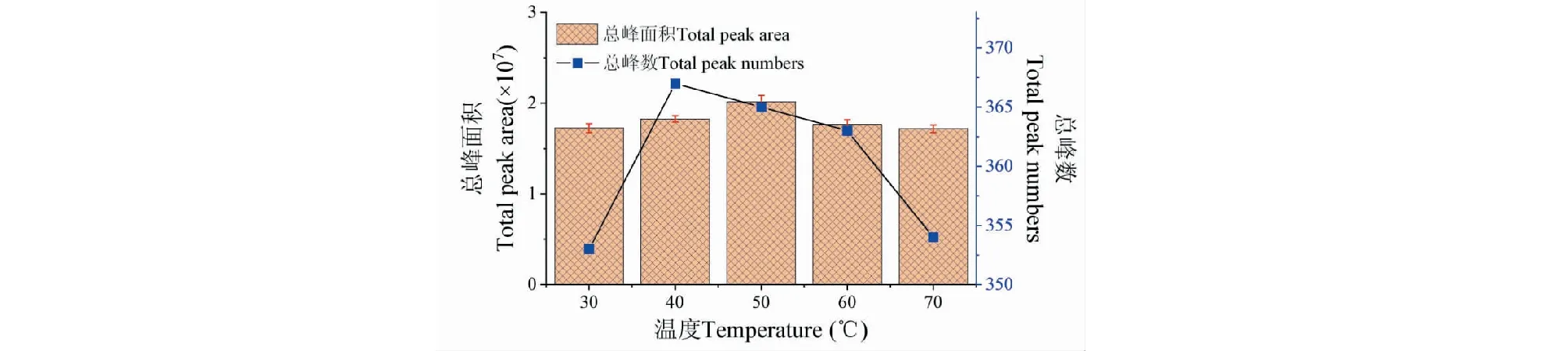
圖4 萃取溫度對SPME萃取香蕉揮發性組分的總峰面積和總峰數的影響Fig.4 Effect of extracting temperature on total peak area and peak number of volatile compounds extracted from banana by SPME
2.5 正交試驗分析
SPME以超聲時間、樣品量、萃取溫度為因素變量,總峰面積為評價指標的正交試驗設計方案及結果(見表2)。
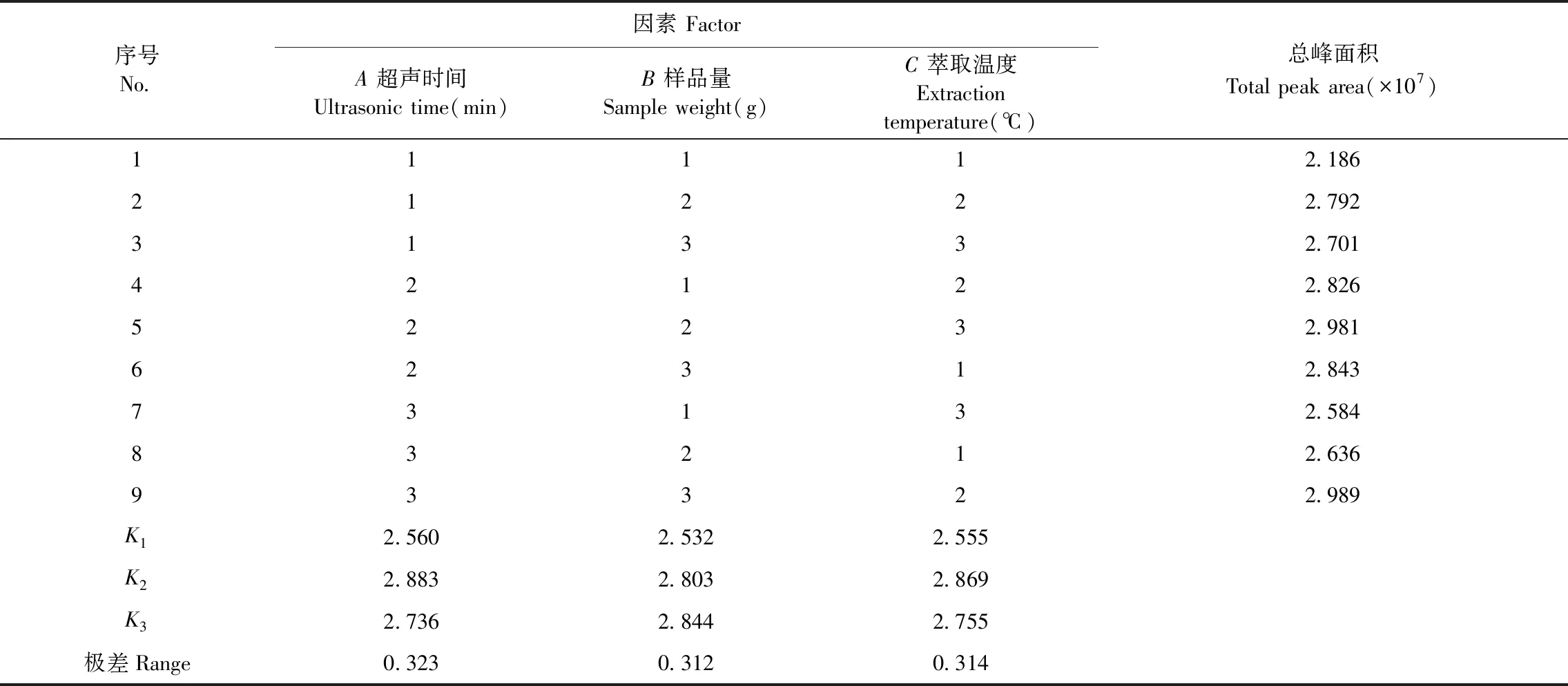
表2 正交試驗設計與結果表Table 2 design and result of orthogonal experiment
由表2可知,SPME各因素對總峰面積的影響依次表現為:超聲時間>萃取溫度>樣品量,SPME最佳工藝條件:A2B3C2,即正交試驗得出SPME條件為:超聲時間為20 min,樣品量為4.0 g,萃取溫度為50 ℃。根據正交試驗結果的最佳工藝參數進行驗證試驗,結果為總峰面積2.992×107(n=3)。
2.6 兩組香蕉揮發性組分的定性和定量分析
2.6.1 香蕉樣品情況
采用UV-C合適的照射劑量照射后的處理組(UV-C組)與無照射的對照組(CK組)在25 ℃貯藏18天后采樣,兩組香蕉的外觀情況見圖5。由圖5可知,UV-C處理組香蕉色澤青黃、飽滿、有光澤,個別香蕉果實出現很少黑點,剛好處于成熟期,而對照組香蕉色澤淡黃,已經出現大量黑點,同時部分香蕉果實開始有腐爛斑塊,處于過成熟狀態,兩組香蕉的外觀狀態存在明顯差異,UV-C處理后延長了香蕉的貯藏時間。

圖5 UV-C組和對照組香蕉常溫貯藏18天后香蕉果實的外觀狀況Fig.5 Appearance of banana fruits in UV-C group and CK group stored at 25 ℃ for 18 days
2.6.2 兩組香蕉揮發組分的OPLS-DA分析
揮發性組分變化不僅是判斷果實采后貯藏及貨架壽命的一個重要指標,還是評價果實品質的一個重要依據。圖6為UV-C香蕉樣品與CK香蕉樣品的GC-MS總離子流圖,將原始數據在MS-DIAL軟件進行預處理后,導入NIST 17質譜庫進行組分鑒定。從本研究的UV-C組和CK組香蕉揮發性組分共鑒定出169個組分,將169個組分數據導入SIMCA 14.1軟件,進行OPLS-DA分析(見圖7)。由圖7A可見OPLS-DA很好地區分兩組間的差異,說明經UV-C處理后兩組香蕉之間的代謝途徑發生變化,相應的揮發性代謝組分有差異。OPLS-DA模型的R2X=0.464、R2Y=0.999、Q2=0.992、R2Y和Q2均>0.99,說明建立的模型穩定,數據可靠。OPLS-DA模型200次迭代驗證結果見圖7B。其中截距R2=(0.0,0.647),截距Q2=(0.0,-0.854),圖中所有左邊的Q2值都比右邊的原始點低,且Q2回歸直線的截距<0,可知OPLS-DA模型沒有過度擬合,說明此模型的建立是有效的,可用于本研究的差異代謝揮發性組分的篩選[14]。
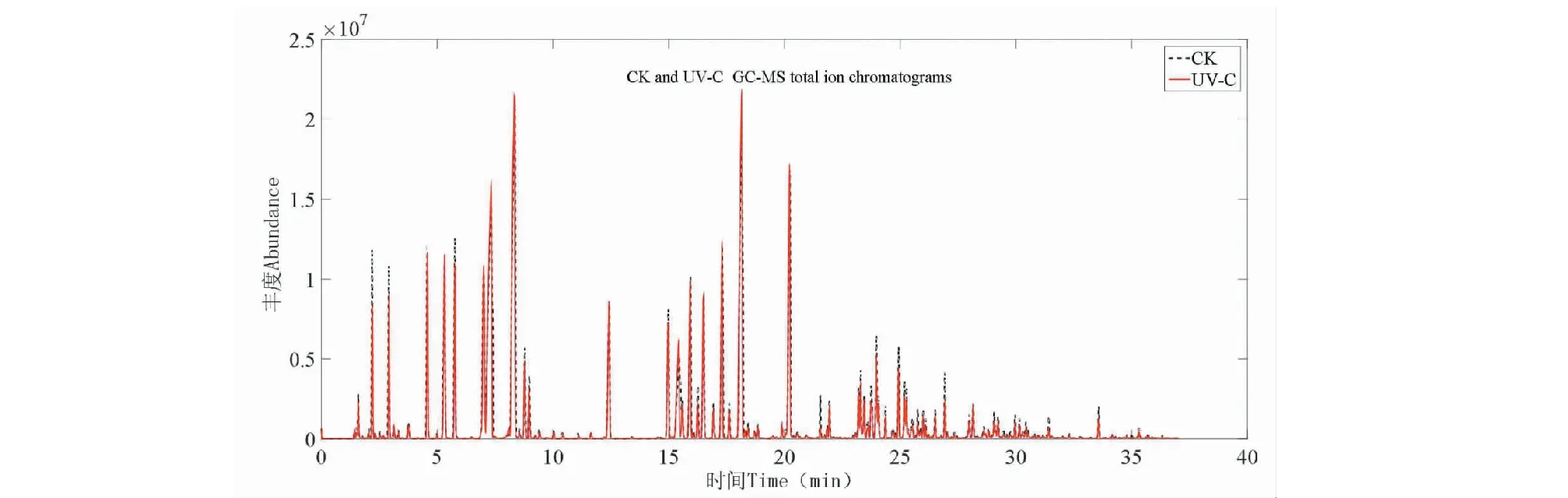
圖6 UV-C與CK香蕉樣品的GC-MS總離子流圖Fig.6 GC-MS total ion chromatograms of UV-C and CK banana samples
2.6.3 兩組香蕉揮發組分的顯著差異組分
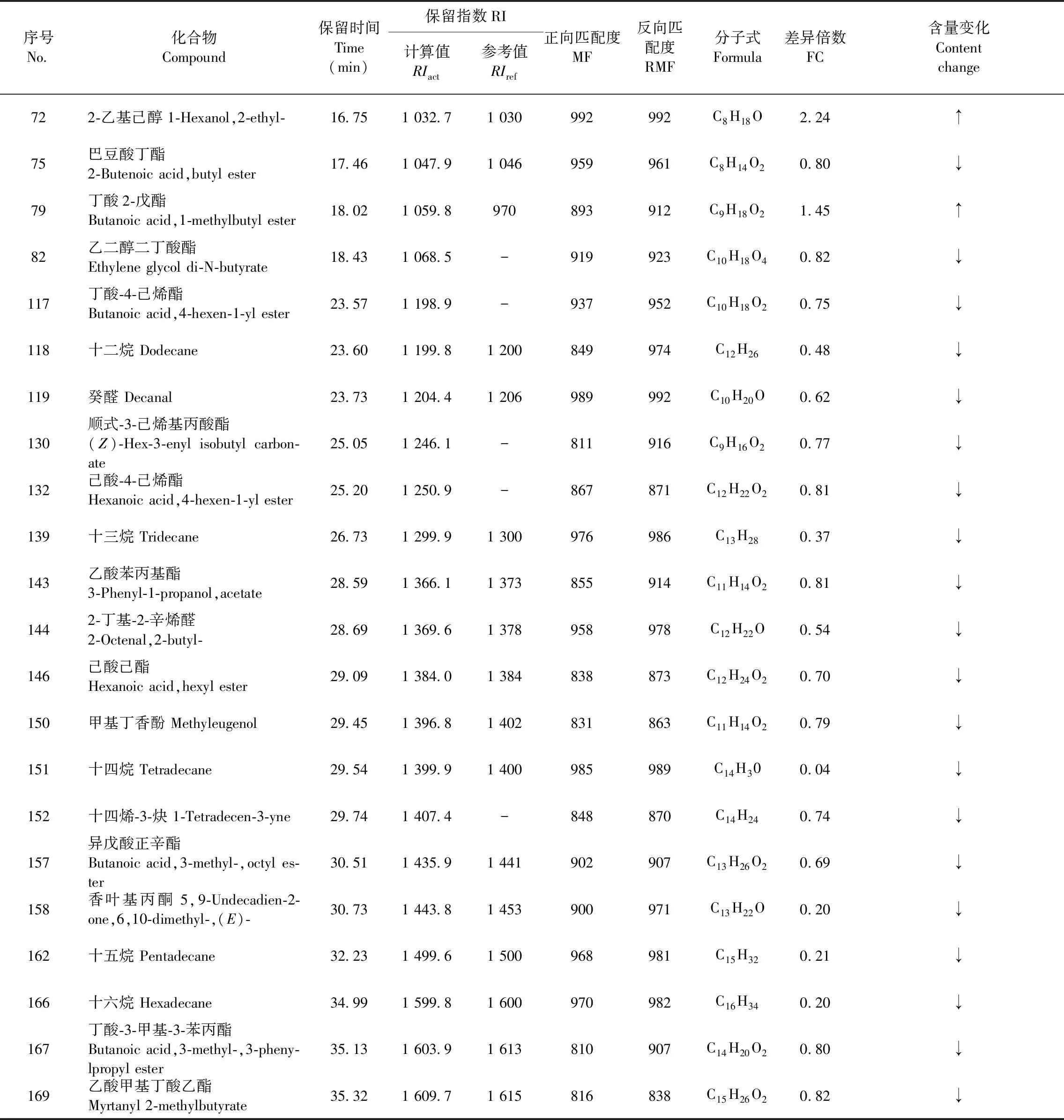
根據上述建立的OPLS-DA模型,得到了兩組香蕉169個揮發性組分的FC值和T檢驗(Student’s t-test)的P值(P-value),采用P<0.05與FC>1.2或FC<0.83篩選差異代謝揮發性組分[15],共篩選出38個香蕉顯著差異的揮發性代謝組分,圖8為篩選結果的火山圖(Volcano plot),圖中綠色的點和數字代表顯著下調的組分,紅色的點和數字代表顯著上調的組分。38個顯著差異組分占169個鑒定組分含量的8.72%,其中含量顯著下調的有34個組分,顯著上調的組分有4個,具體組分見篩選結果(見表3)。
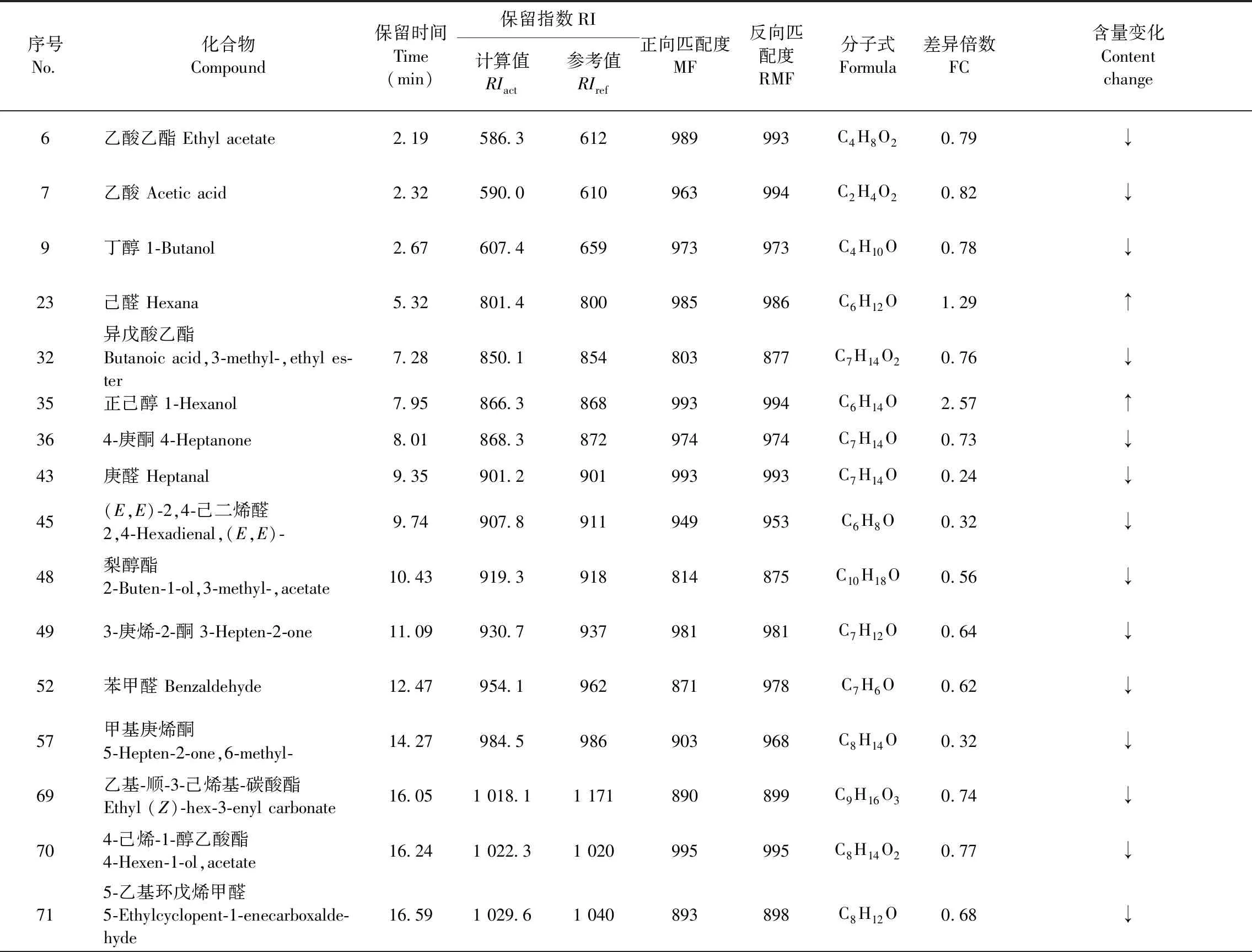
表3 UV-C組和CK組香蕉中的差異代謝揮發性組分Table 3 The difference of volatile components in banana metabolism between UV-C group and CK group
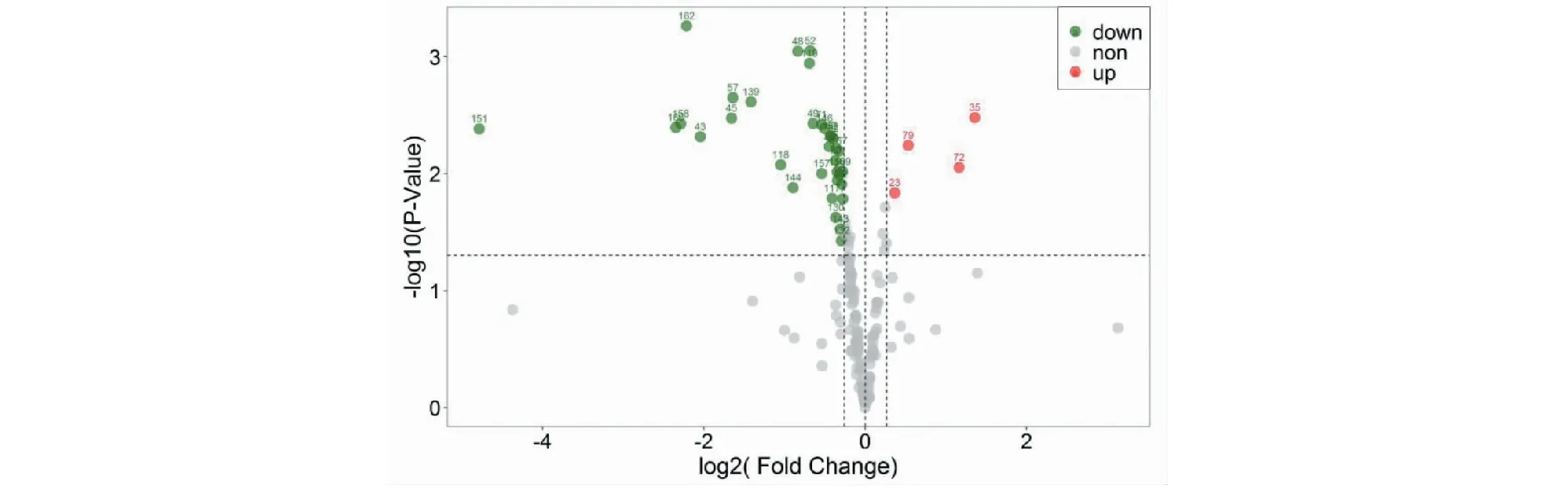
圖8 UV-C組和CK組香蕉差異代謝揮發性組分的火山圖Fig.8 Volcanic map of the difference in volatile components metabolism between UV-C group and CK group
3 討論
3.1 香蕉揮發性組分的鑒定
由于SPME聯合GC-MS具有環境友好、使用簡易和受樣品基質干擾低而被廣泛應用于果蔬等的揮發性組分(或香氣成分)的研究,其用于香蕉的揮發性組分分析的研究早有報道,主要集中于討論選擇合適的SPME萃取頭、不同時期的香蕉揮發性組分的鑒定。選擇合適的SPME纖維頭對于香蕉揮發性組分的測定和后續的組分鑒定是十分重要的,可以更有效地富集揮發性組分和得到更準確的定性和定量結果。Liang等[16]應用DVB/CAR/PDMS萃取頭,分析“桂蕉1號”香蕉的綠熟期、黃熟和過熟期的揮發性成分,共鑒定出44個揮發性成分。Dou等[10]應用DVB/CAR/PDMS萃取頭,分析不同季節黃熟期“巴西”香蕉和“廣粉1號”粉蕉的揮發性組分,共鑒定出63個揮發性組分,不同季節的組分含量有差異,其中3月份的樣品的揮發性組分含量更高。Li等[17]用DVB/CAR/PDMS萃取頭,探討了整個采后貯藏后熟過程黃熟期的“巴西”香蕉和“廣粉1號”粉蕉的揮發性組分,分別共檢測到45個和27個揮發性組分,其中“巴西”香蕉在黃熟期的揮發性組分主要是酯類和醛類。
續表3(Continueed Tab.3)
上述關于香蕉揮發性組分的研究報道,在SPME萃取頭使用種類上多應用DVB/CAR /PDMS萃取頭,在組分定性鑒別上主要根據工作站配套的NIST質譜庫進行相似度檢索,原始質譜數據存在信息干擾、重峰等鑒定的不足,因此其鑒定出來的組分數量較少,一般少于50個,而香蕉果實中已鑒定的揮發性組分有250多個[18],因此如何選擇和優化實驗條件,應用圖譜預處理軟件(如AMDIS或MS-DIAL等)對測得的原始質譜圖進行“減少重疊峰、背景信號的干擾等”處理,得到“純化”的質譜圖,增加與目標質譜庫的匹配程度,提高鑒定組分能力和數量,是十分必要的。MS-DIAL軟件能夠對GC-MS總離子流圖(TIC)解卷積,消除干擾峰和重疊峰,得到相對純凈的質譜圖,提高待鑒定組分與質譜庫組分的匹配度,使未知組分鑒定的結果更準確和可靠[12]。本研究在綜合前人報道的基礎上,比較了DVB/CAR/PDMS、PDMS、PDMS/DVB、CAR/PDMS四種萃取頭聯合GC-MS測定成熟期香蕉揮發性組分,根據豐度大小和鑒定出組分數量篩選出CAR/PDMS萃取頭用于本研究后續SPME條件優化和兩組香蕉揮發性差異組分比較。為了使質譜鑒定結果更加可靠,先用MS-DIAL軟件對原始質譜圖進行圖譜預處理,然后導入NIST 17質譜庫中進行鑒定,由檢索的正向匹配度(MF)、反向匹配度(RMF)均≥800和正構烷烴得到的Kováts保留指數(RI)相結合,鑒定出兩組香蕉的揮發性組分共169個。
3.2 UV-C處理后的香蕉揮發性組分的變化
UV-C應用于農產品、食品的保鮮,主要集中在提高果蔬的抗氧化性、抗菌性和生物活性成分的變化等研究,對于UV-C處理后貯藏的果蔬等的揮發性組分(或香氣成分)變化研究較少。S?beli等[19]使用合適UV-C劑量降低牛腰肉排中微生物數量,延長保存時間,發現牛排的有些揮發性組分含量增加了,主要是己醛和2-庚醛等。Severo等在2015年報道對草莓進行采后UV-C處理,表明UV-C能夠通過基因激活誘導草莓的相關酶類,增加草莓的生物活性和酯揮發性化合物含量,導致果實更結實,生物活性分子水平更高,以及更強的香氣。Severo等[20]在2017年報道UV-C輻射采前草莓,影響草莓代謝物含量和揮發性有機化合物產量,UV-C處理增加了總揮發性有機物的產量,主要是總揮發性酯,但減少了草莓特征香氣物質呋喃和間甲基呋喃的產量。
本研究應用前期實驗得到合適的香蕉保鮮UV-C劑量處理香蕉后,對對照組和UV-C組的揮發性組分的差異進行了深入探討。香蕉果實各揮發性組分的相對含量通過內標法(2-辛醇為內標)計算得到,169個組分主要由酯、醛、酮、醇和其他類物質組成,其中酯類有58個(占CK組和UV-C組含量分別為75.98%±0.39%、76.61%±0.25%)、醛類有34個(占CK組和UV-C組含量分別為8.09%±0.08%、8.29%±0.05%)、酮類有27個(占CK組和UV-C組含量分別為7.72%±0.11%、6.78%±0.07%)、醇類有17個(占CK組和UV-C組含量分別為2.46%±0.07%、2.36%±0.04%)、其他類有33個(占CK組和UV-C組含量分別為5.75%±0.09%、5.49%±0.06%),酯類是成熟香蕉果肉主要的揮發性組分[3-5]。圖9為兩組香蕉的揮發性組分中相對含量較高的前10個組分,可見兩組香蕉的前10個組分的種類是相同的,分別是乙酸異戊酯、丁酸異戊酯、1-甲基乙酸丁酯、異戊酸異戊酯、乙酸-2-庚酯、乙酸異丁酯、乙酸丁酯、3-甲基-2-丁酮、乙酸乙酯、乙酸己酯,除了第2組分(丁酸異戊酯)、第9組分(乙酸乙酯)含量有顯著性差異,其他8個組分無顯著性差異。這些相對高含量的酯類構成了香蕉果實的特征香氣,同時是香蕉揮發性組分中的主要類別,與Wendakoon[21]和Boudhrioua[22]的研究一致。通過對兩組香蕉的169個組分展開OPLS-DA建模分析,篩選差異代謝組分,由表3和圖8可知,經UV-C處理后,處理組和對照組香蕉有38個差異代謝揮發性組分,含量下調的有34個,含量上調的有4個(分別是己醛、正己醇、2-乙基己醇、丁酸2-戊酯)。Zhu等[23]研究低溫貯藏對香蕉果實揮發性物質的影響,結果表明低溫抑制了揮發物的生物合成相關的關鍵基因MaHPL、MaLOX和MaAAT的表達來減少在貯藏期內揮發性物質的產生。可能本實驗選擇的合適劑量的UV-C處理香蕉在一定程度上抑制了MaHPL、MaLOX和MaAAT 3種基因的部分表達,起到類似低溫貯藏的作用,但同時引起了香蕉的抗逆性,激活誘導了苯丙氨酸解氨酶等酶類的活性[24],因此沒有表現出完全統一的揮發性組分含量的增加或下降。UV-C處理后香蕉的揮發性組分有部分的含量顯著降低了,也有部分的含量下降了,但因為香蕉的香氣來源主要是酯類組分,乙酸異戊酯、丁酸異戊酯這兩個組分是揮發性組分含量較高的前2個,同時也是香蕉的主要特征香氣成分,對比處理前后這兩個組分含量均提高了,乙酸異戊酯含量提高不顯著(P>0.05),而丁酸異戊酯含量提高顯著(P<0.05,差異倍數FC=1.19),同時UV-C組總酯含量略高于對照組,因此總體而言,UV-C處理后的香蕉氣味會略有增強。
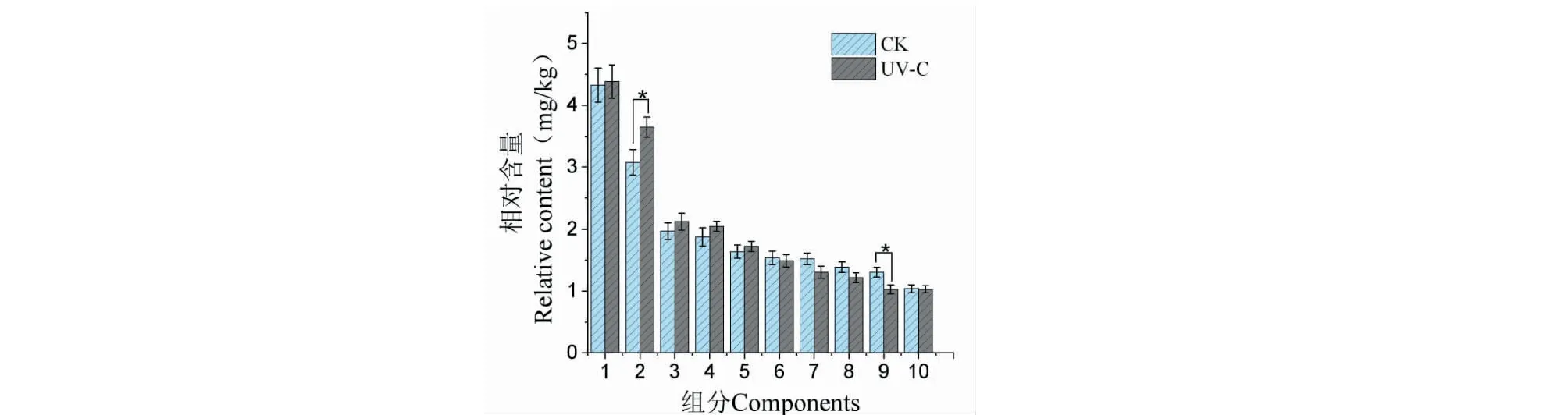
圖9 UV-C組和CK組香蕉前10個揮發性組分相對含量Fig.9 Relative contents of the first 10 volatile components of banana in UV-C group and CK group注:組分1~10分別代表乙酸異戊酯、丁酸異戊酯、1-甲基乙酸丁酯、異戊酸異戊酯、乙酸-2-庚酯、乙酸異丁酯、乙酸丁酯、3-甲基-2-丁酮、乙酸乙酯、乙酸己酯。Note:Components 1-10 represent isoamyl acetate,isoamyl butyrate,2-pentylacetate,isopentyl isopentanoate,2-heptyl acetate,isobutyl acetate,butyl acetate,3-methyl-2-butanone,ethyl acetate,hexyl acetate,respectively.
4 結論
本文優選CAR/PDMS萃取頭進行SPME操作,應用正交試驗設計對SPME的萃取條件進行了優化組合,得到香蕉揮發性組分測定的SPME萃取優化條件為:超聲時間為20 min、樣品量為4.0 g、萃取溫度為50 ℃。在此基礎上,通過測定經UV-C處理后具有保鮮效果的處理組香蕉和對照組香蕉的揮發性組分,實驗結果表明兩組香蕉的代謝途徑發生了變化,共有38個差異代謝揮發性組分、34個差異代謝揮發組分的相對含量下調了,4個差異代謝揮發性組分相對含量上調了,經UV-C處理后貯藏的香蕉總酯含量、主要特征香氣成分乙酸異戊酯和丁酸異戊酯均高于對照組香蕉,而酯類是成熟香蕉果肉主要的揮發性組分和香氣組成,因此應用UV-C處理香蕉進行保鮮貯藏,不僅不會造成香蕉的香氣成分下降,反而有利于香蕉香氣的產生,本研究結果可為SPME-GC-MS測定農產品等食品中揮發性組分提供定性參考和UV-C處理保鮮水果后的香氣變化提供借鑒。目前對于香蕉等果實香氣成分的物質代謝途徑、果實貯藏和加工過程揮發性成分變化、相應基因和酶的生理功能的機理等方面的研究還不完善,對于本研究中的UV-C處理后導致香蕉相關揮發性組分的上調或下調的相關基因和酶類變化的機理還有待進一步探索。

