轉基因大豆MON87751品系特異性實時熒光定量PCR檢測方法建立
劉二龍 鄭冠津 王毅謙 李志勇 魏霜 關麗軍 盧麗 蔣湘 劉金華 王振華





摘要 [目的]為完善我國轉基因檢測方法體系,建立轉基因大豆MON87751品系特異性實時熒光聚合酶鏈式反應(real time polymerase chain reaction,PCR)檢測方法。[方法]根據MON87751的3′端鄰接區序列設計特異性引物和探針,建立MON87751品系特異性實時熒光PCR檢測方法,并測定該方法的靈敏度、特異性及可重復性。[結果]靈敏度測試顯示,其定量下限為40拷貝;重復性試驗顯示其相對標準偏差在可接受范圍內。[結論]該研究建立的MON87751品系特異性實時熒光PCR檢測方法特異性良好,靈敏度高,有良好的可重復性,適合對轉基因大豆MON87751品系進行檢測鑒定。
關鍵詞 實時熒光PCR;轉基因大豆MON87751;品系特異性
中圖分類號 S 565.1文獻標識碼 A
文章編號 0517-6611(2022)04-0102-04
doi:10.3969/j.issn.0517-6611.2022.04.027
開放科學(資源服務)標識碼(OSID):
Establishing an Event-specific Real-time Polymerase Chain Reaction Detection Method for Genetically Modified Soybean Event MON87751
LIU Er-long1,ZHENG Guan-jin1,WANG Yi-qian2 et al (1.Huangpu Customs Technology Center,Guangzhou,Guangdong 510730;2.Animal Plant and Food Inspection Center of Nanjing Customs,Nanjing,Jiangsu 210019)
Abstract [Objective]In order to improve the genetically modified detection method system in China,a real-time polymerase chain reaction (PCR) detection method specific to the genetically modified soybean MON87751 was established.[Method]The specific primer pairs and probe based on the sequence of the 3' adjacent region of MON87751 were designed and then the real-time PCR detection method was established.The specificity,sensitivity and repeatability were analyzed.[Result]The real-time PCR method was specific for detecting MON87751.The limit of quantification (LOQ) was 40 copies MON87751 genomic DNA.Repeatability of the established event-specific real-time PCR method was assessed and the relative standard deviation (RSD) was within the acceptable range.[Conclusion]The established event-specific quantitative real-time PCR method of MON87751 has good specificity,high sensitivity and good reproducibility,and is suitable for the identification of soybean MON87751.
Key words Quantitative real-time PCR;Genetically modified soybean MON87751;Event-specificity
基金項目 廣東省科技計劃項目(2017B020207008);廣州市科技計劃項目(201704030125);國家重點研發計劃(2018YFF0215605);南京海關科技計劃項目(2021KJ18)。
作者簡介 劉二龍(1978—),男,湖南郴州人,高級獸醫師,碩士,從事動植物分子鑒定研究。*通信作者,博士,從事食品安全快速檢測技術研究。
收稿日期 2021-04-06;修回日期 2021-05-24
大豆是一種富含蛋白與脂肪的糧食及油料作物。我國是世界大豆第一消費國和進口國,國產大豆難以滿足國內市場消費需求,故而大豆貿易逆差大,2019年大豆進口量為8 851萬t[1]。
轉基因大豆MON87751由孟山都公司研發,其含有穩定整合的cry1A.105和cry2Ab2表達盒[2],主要產生Cry1A.105和Cry2Ab2兩種針對鱗翅目害蟲的殺蟲蛋白。MON87751于2014年在美國上市,目前在歐盟、澳大利亞、新西蘭、加拿大、日本、韓國、中國臺灣和美國等國家或地區獲得批準允許用作食品、飼料或種植。為完善我國轉基因產品檢測技術體系,為轉基因產品的監管提供強有力的技術支持,筆者采用實時熒光PCR技術平臺,根據MON87751 3′端鄰接區序列設計引物、探針,建立了MON87751品系特異性檢測方法,以期為實現高通量的檢測提供科學依據。
1 材料與方法
1.1 材料和試劑
轉基因油菜MON88302、轉基因棉花MON88913、轉基因油菜DP-073496-4、轉基因大豆A2704-12、轉基因大豆GTS 40-30-2、轉基因甜菜H7-1、轉基因玉米MON810、轉基因玉米NK603、轉基因玉米BT11、轉基因玉米MIR162、非轉基因大豆為黃埔海關技術中心購置及保存;大豆內源基因植物凝集素基因(Lectin基因)和MON87751品系特異性外源基因雙基因陽性質粒為黃埔海關技術中心構建。
主要試劑:Primex Ex Taq(2×) for qPCR(TAKARA);引物和探針工作液的終濃度為10 μmol/L(上海閃晶生物);DNA提取試劑盒DP-305(北京天根)。
主要設備:實時熒光PCR儀ABI7500fast、ABI7500(美國應用生物系統公司);研磨機Tube Mill 100 control(德國IKA);微量分光光度計 nanodrop2000c(美國Thermo公司)。
1.2 方法
1.2.1 DNA的提取。稱取100 mg研磨成粉末狀的樣品提取樣品中的基因組DNA,測定DNA濃度并于4℃保存備用。
1.2.2 引物組和探針設計。根據轉基因大豆MON87751品系3′端鄰接區序列(品系特異性片段),應用Primer Primer 5.0 軟件設計引物和探針。選用內源基因Lectin用于樣本核酸提取質量監測及定量分析。
1.2.3 實時熒光PCR反應體系退火溫度及引物探針配比的優化。采用TAKARA RR390酶系對不同體積的引物探針進行優化(25 μL體系)。A組:Premix Ex TaqTM 12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol/L MON87751-F和MON87751-R各0.5 μL,10 μmol/L探針MON87751-P 1.0 μL,模板2.0 μL和ddH2O 8.3 μL。 B組:Premix Ex TaqTM 12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol/L MON87751-F和MON87751-R各0.4 μL,10 μmol/L探針MON87751-P 0.8 μL,模板2.0 μL和ddH2O 8.7 μL。C組:Premix Ex TaqTM 12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol/L MON87751-F和MON87751-R各0.2 μL,10 μmol/L探針MON87751-P 0.4 μL,模板2.0 μL和ddH2O 9.5 μL。
退火延伸溫度分別設置為60和58 ℃,反應程序為95 ℃ 30 s;95 ℃ 5 s、60 ℃(58 ℃) 34 s,40個循環,于60 ℃(58 ℃)收集熒光信號。
1.2.4 特異性測試。用“1.2.1”的方法提取“1.1”中樣品DNA為模板,陽性對照為Lectin-MON87751質粒,陰性對照為非轉基因大米DNA,進行特異性測試。
1.2.5 靈敏度測試。
將提取的Lectin-MON87751DNATE緩沖液稀釋至4 000000、400000、40000、4000、400、40和20拷貝/μL進行轉基因大豆MON87751實時熒光PCR檢測,進行靈敏度測試。
1.2.6 可重復性測試及建立標準曲線。
將提取的Lectin-MON87751質粒DNA溶液加入TE緩沖液稀釋至4 000 000、400 000、40 000、4 000、400、40和20拷貝/μL,每個樣品進行3次重復試驗,進行實時熒光PCR檢測線性范圍測試及可重復性測試。
2 結果與分析
2.1 方法的建立及優化
2.1.1 實時熒光PCR引物和探針設計。
通過分析轉基因大豆MON87751 3′端鄰接區序列設計的多組引物和探針,分析引物與探針的反應效率、擴增效果,最終選擇表1中的引物和探針建立MON87751品系特異性檢測方法。
2.1.2 PCR反應體系優化。
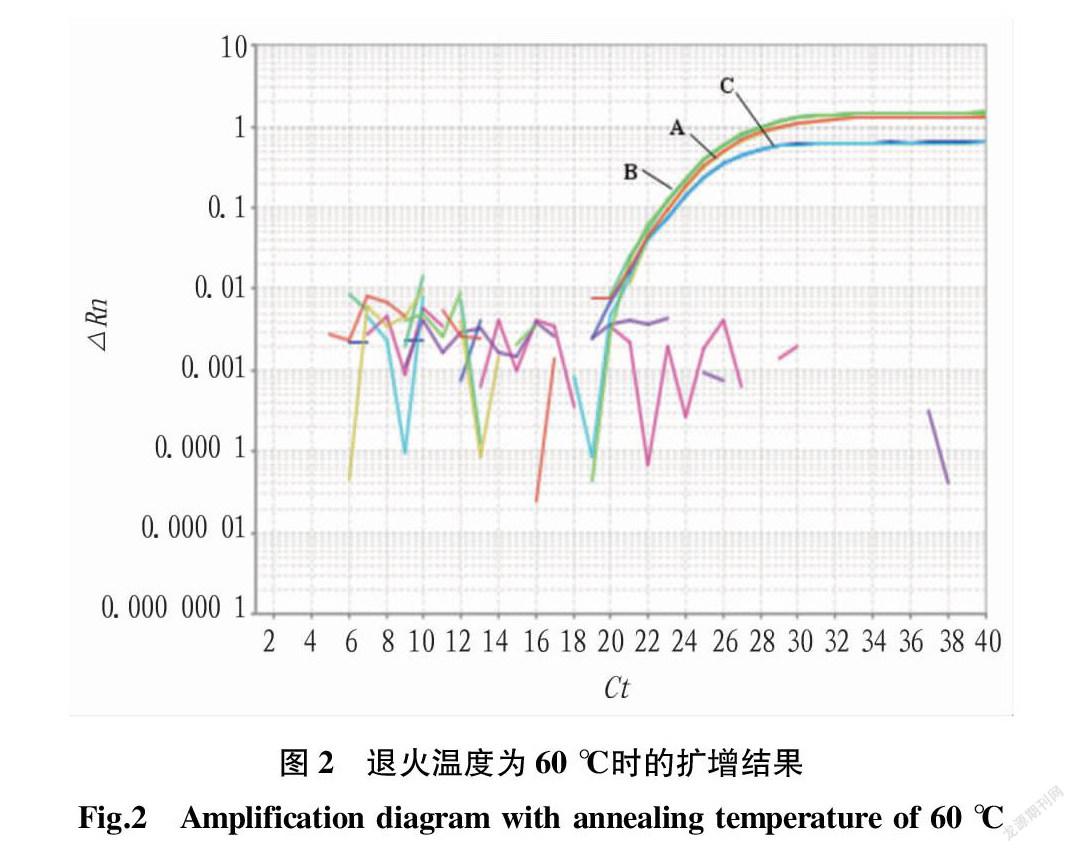
在擴增體系的退火溫度為58 ℃時,3組引物探針組B、A和C的擴增曲線均擴增良好,其中Ct值最小為B組(圖1);溫度為60 ℃時,B、A和C 3組均擴增良好,A和B組Ct值接近,C組Ct稍高,但3組引物探針Ct值較退火溫度為58 ℃時Ct值高(圖2)。因此,基于擴增效率和經濟性,考慮選擇B組體積配比、58 ℃作為退火溫度引物探針配比。
2.2 特異性測試 由圖3可知,采用MON87751品系特異性MON87751-F/R/P引物和探針進行實時熒光PCR時,其他農作物材料DNA為模板的反應均無典型熒光擴增曲線,只有陽性樣品MON87751的DNA模板有典型熒光擴增曲線,表明該研究的檢測方法特異性良好。
2.3 靈敏度測試、可重復性測試及標準曲線建立
按“1.2.5”進行7個濃度梯度擴增,其最低檢測濃度為20拷貝/μL。擴增曲線見圖4。
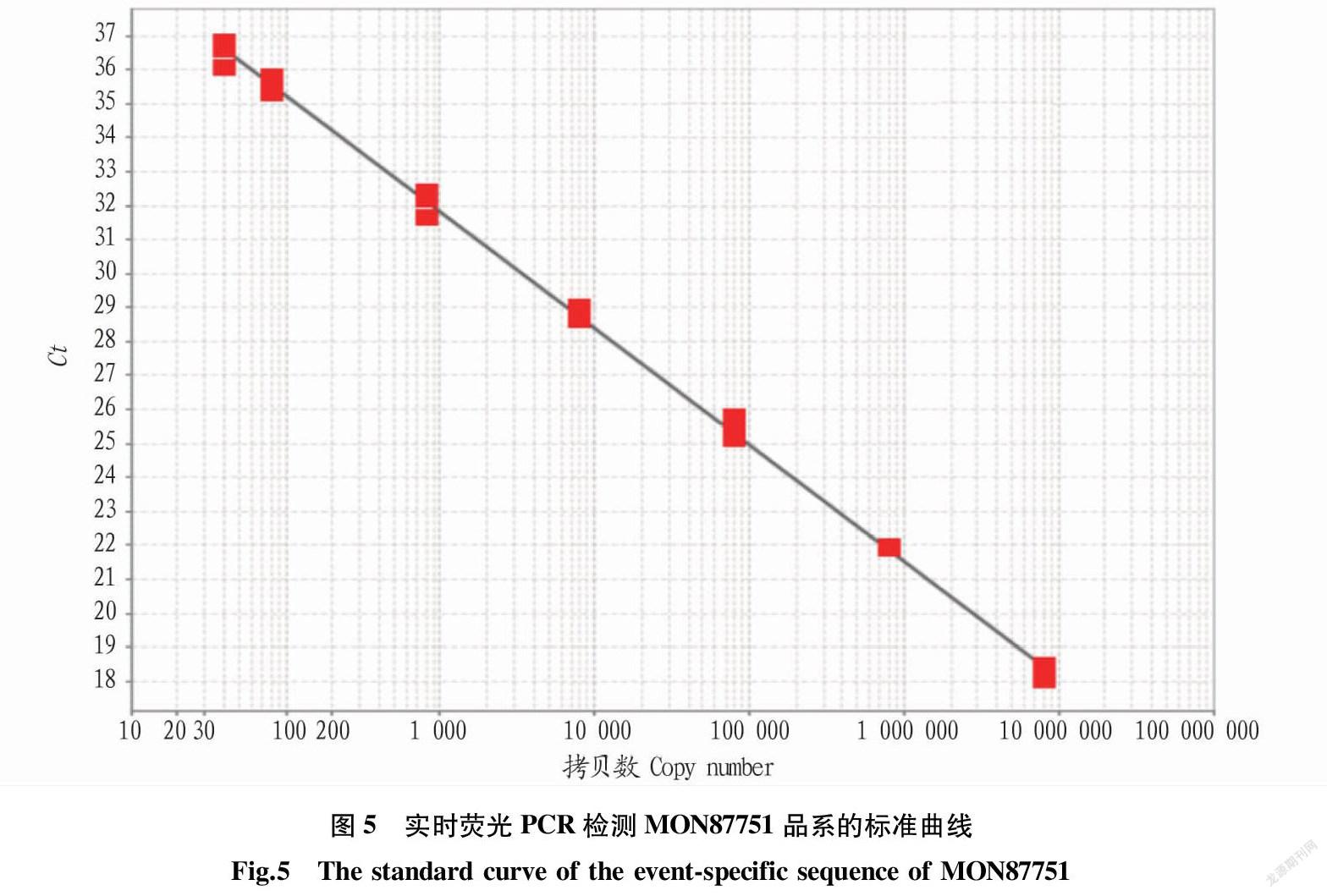
2.4 標準曲線制備 按“1.2.6”進行轉基因大豆MON87751品系實時熒光PCR檢測,測試結果的Ct值見表2。根據表2中Ct值數據與拷貝數對數值建立線性回歸方程為y=-3.43x+42.12,擴增效率95.55%(90%~110%),R2為0.99,表明該方法的線性相關性良好,擴增效率滿足定量檢測標準的要求(圖5),且在線性范圍內,Ct值的SD為0.04~0.39,RSD為0.20%~1.27%(表2)。最低模板量40拷貝時,其RSD遠小于25%,設定該方法的定量限為40拷貝。
3 討論
目前對轉基因產品多數國家均采用相應的標識管理制度,轉基因產品標識需要檢測方法的支撐。歐盟轉基因食品和飼料基準實驗室有建立MON87751 5′邊界序列的PCR檢測方法[4],但國內尚缺乏該檢測方法及相關標準。實時熒光定量PCR技術在轉基因檢測中應用廣泛,被譽為“金標準”,其可監測PCR進程中探針發光基團的信號,從而實現定性或定量分析[5-7] 。
品系特異性PCR(Event-specific PCR)檢測方法檢測的目標序列是外源基因與植物基因組間邊界序列,甚至可以區分相同質粒轉化的轉基因品系[8],品系特異性檢測方法報道較早見于Bt11品系檢測方法的建立[9],目前在轉基因品系鑒定中應用廣泛[10-15]。
該研究針對轉基因大豆MON87751 3′端邊界特異性序列,基于實時熒光PCR平臺,設計引物和探針建立MON87751品系特異性檢測方法,定量下限為40拷貝,擴增效率為95.55%,重復性測試顯示,各平行間樣品所得Ct的RSD均遠小于25%,表明該方法特異性良好,靈敏度較高,具有良好的穩定性,可為相關部門鑒定檢測轉基因大豆MON87751提供方便快捷的方法。
參考文獻
[1]
王紅蕾.淺談中國2020年度大豆行業市場狀況與區域競爭格局[J].山西農經,2021(4):104-105.
[2]ISAAA GM Approval DatabaseGM Crop Events ListMON87751 [EB/OL].(2013-01-12) [2020-03-31].https://www.isaaa.org/ gmapprovaldatabase/event/default.asp?EventID=370.
[3] SAVINI C,MARETTI M,MAZZARA M,et al.Event-specific method for the quantification of soybean MON 87705 using real-time PCR validation report[R].2012.
[4] European Union Reference Laboratory for GM Food and Feed(EURL GMFF),Joint Research Centre(JRC),European Commission.Event-specific Method for the Quantification of Soybean MON 87751 Using Real-time PCR-Validation Report and Validated Method[R].2016.
[5]MARMIROLI N,MAESTRI E,GULL M,et al.Methods for detection of GMOs in food and feed[J].Anal Bioanal Chem,2008,392(3):369-384.
[6]COTTENET G,BLANCPAIN C,SONNARD V,et al.Development and validation of a multiplex real-time PCR method to simultaneously detect 47 targets for the identification of genetically modified organisms[J].Anal Bioanal Chem,2013,405(21):6831-6844.
[7]ANKLAM E,GADANI F,HEINZE P,et al.Analytical methods for detection and determination of genetically modified organisms in agricultural crops and plant-derived food products[J].Eur Food Res Technol,2002,214(1):3-26.
[8] WU G,WU Y H,XIAO L,et al.Event-specific qualitative and quantitative PCR detection of genetically modified rapeseed Topas 19/2[J].Food Chem,2009,112(1):232-238.
[9]ZIMMERMANN A,LTHY J,PAULI U.Event specific transgene detection in Bt11 corn by quantitative PCR at the integration site[J].LWT Food Sci Technol,2000,33(3):210-216.
[10] 雷水娟,劉二龍,盧麗,等.轉基因棉花MON88701品系特異性實時熒光PCR檢測方法的建立[J].生物安全學報,2019,28(3):225-229.
[11] 袁俊杰,魏霜,龍陽,等.轉基因大豆MON87701和MON87708雙重實時熒光PCR檢測技術的建立與應用[J].農業生物技術學報,2020,28(2):342-348.
[12] 魯軍,李剛,趙建寧,等.5種轉基因油菜轉化體特異性多重PCR檢測方法[J].生物安全學報,2017,26(3):244-250.
[13] 劉二龍,盧麗,呂英姿,等.轉基因苜蓿草J163品系特異性實時熒光PCR檢測方法的建立[J].食品安全質量檢測學報,2015,6(1):272-278.
[14] 劉二龍,盧麗,呂英姿,等.轉基因甜菜GTSB77品系特異性實時熒光聚合酶鏈式反應檢測方法建立[J].中國食品衛生雜志,2020,32(1):49-52.
[15] 汪秀秀,楊捷琳,宋青,等.轉基因棉花GHB119品系特異性定量PCR檢測方法的建立[J].農業生物技術學報,2014,22(3):380-388.
3523500338244

