連作煙田健株與感染根腐病煙株根際土壤細菌群落多樣性研究
敖金成 李永梅 李博
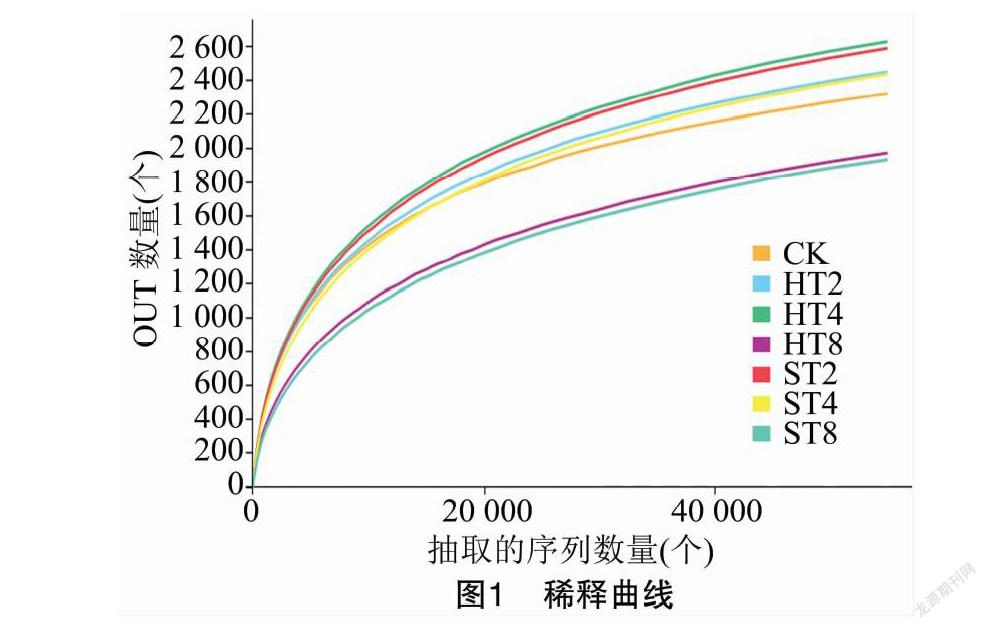
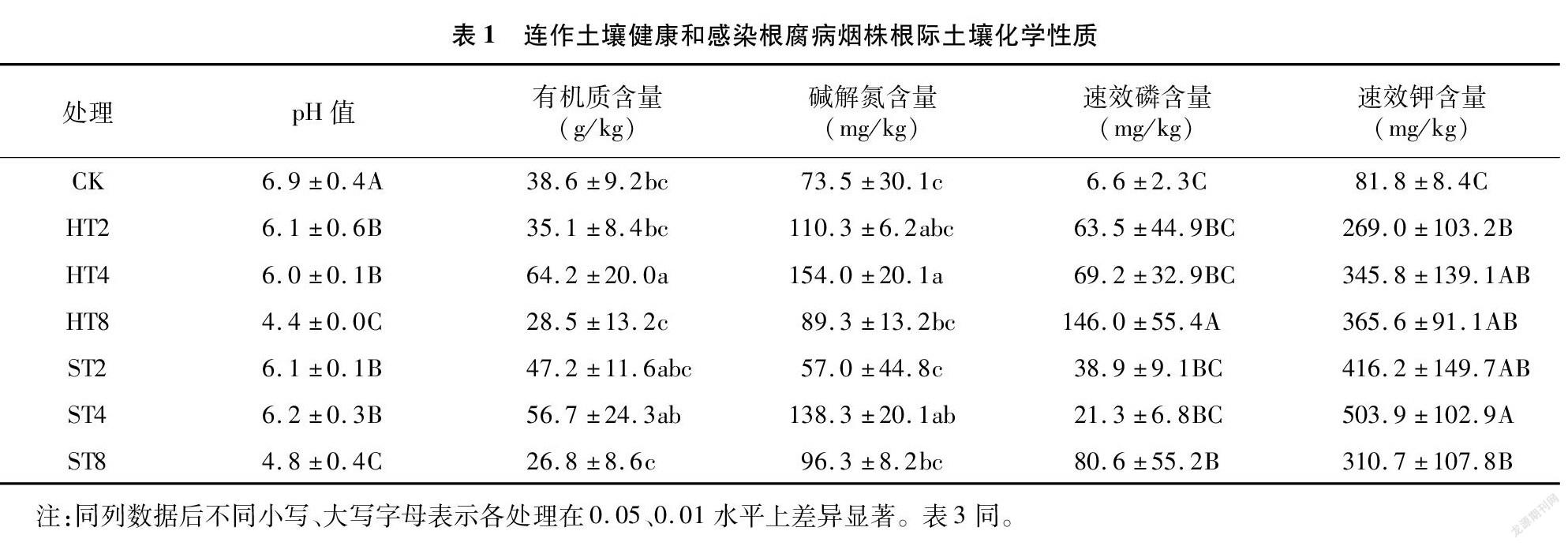
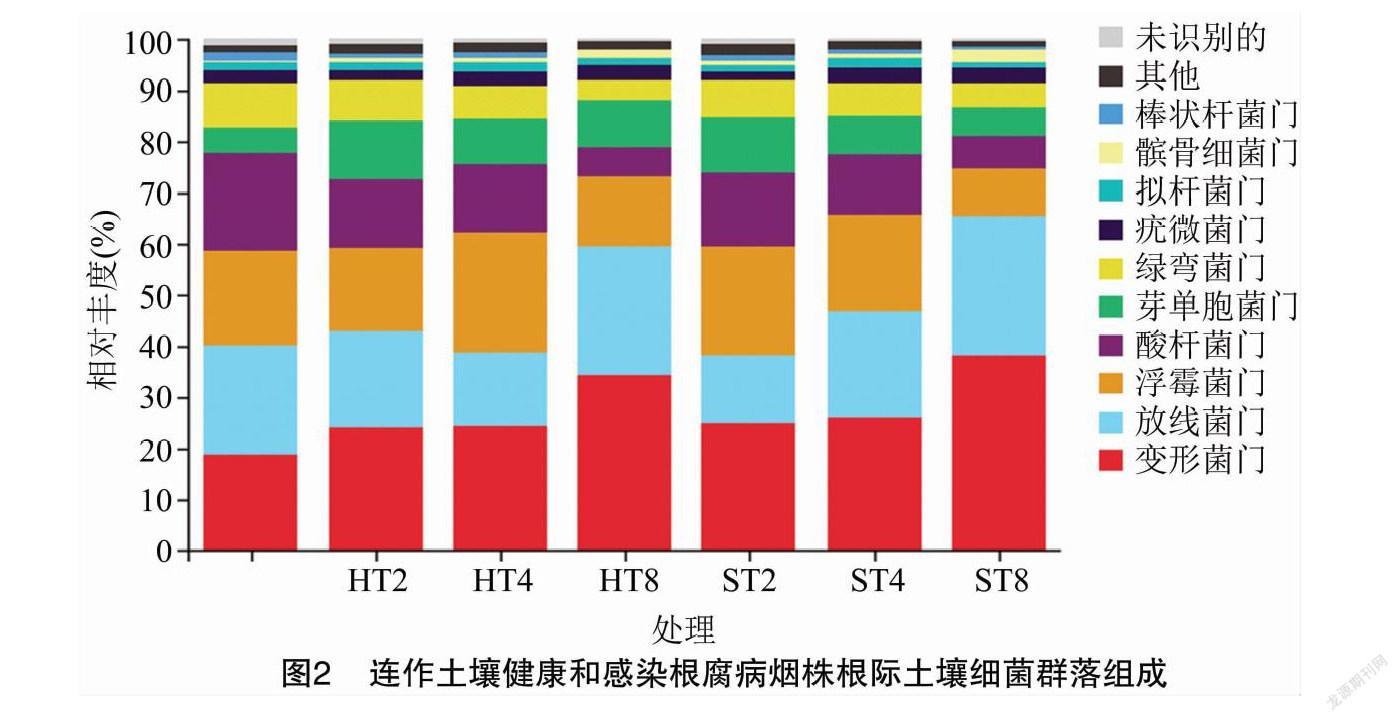
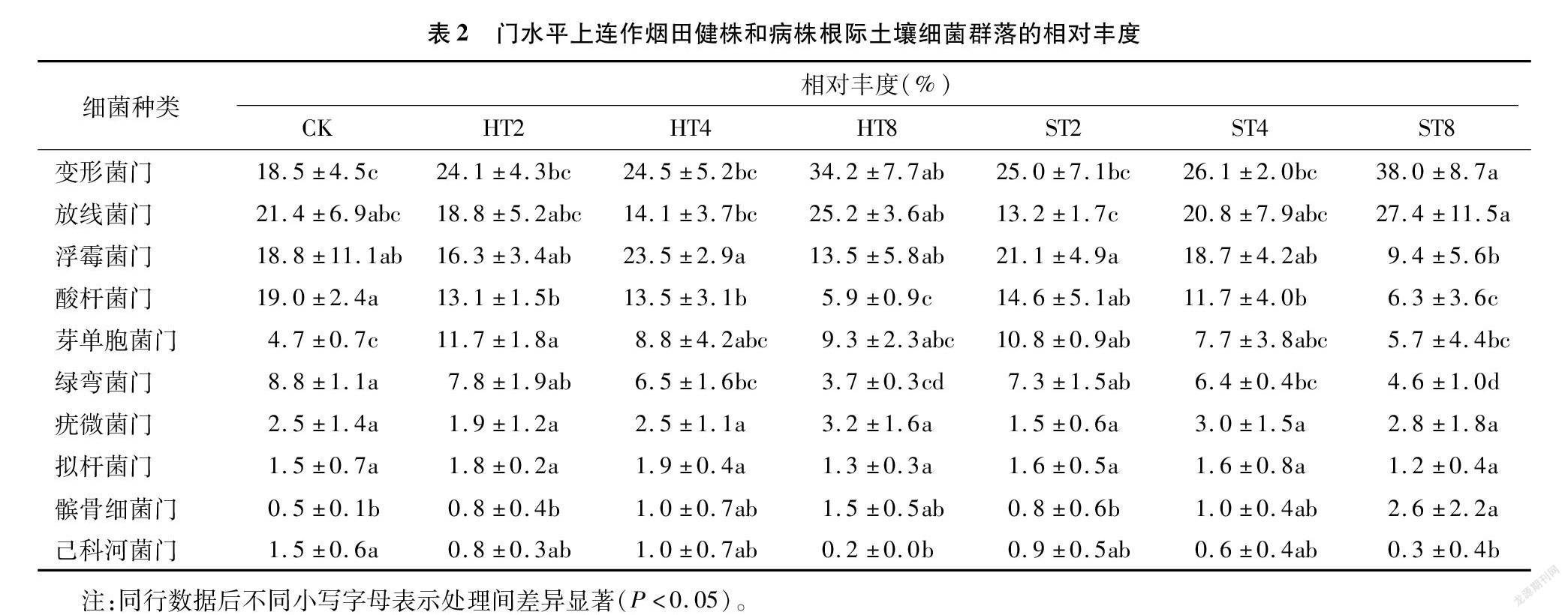
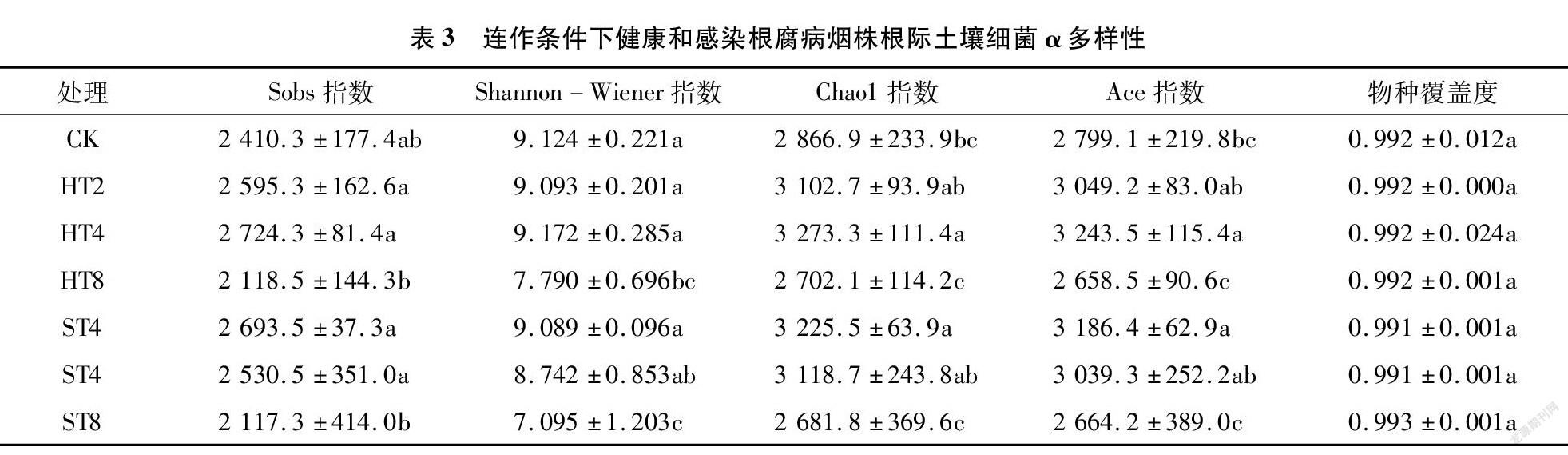
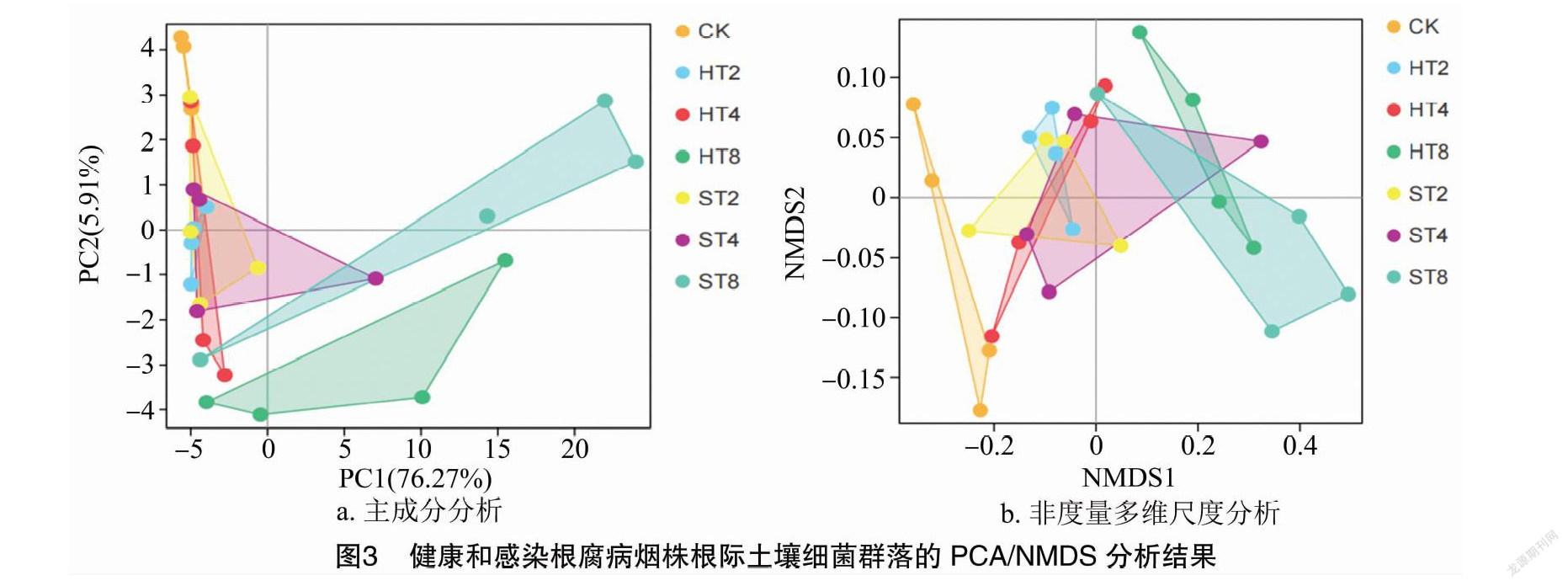

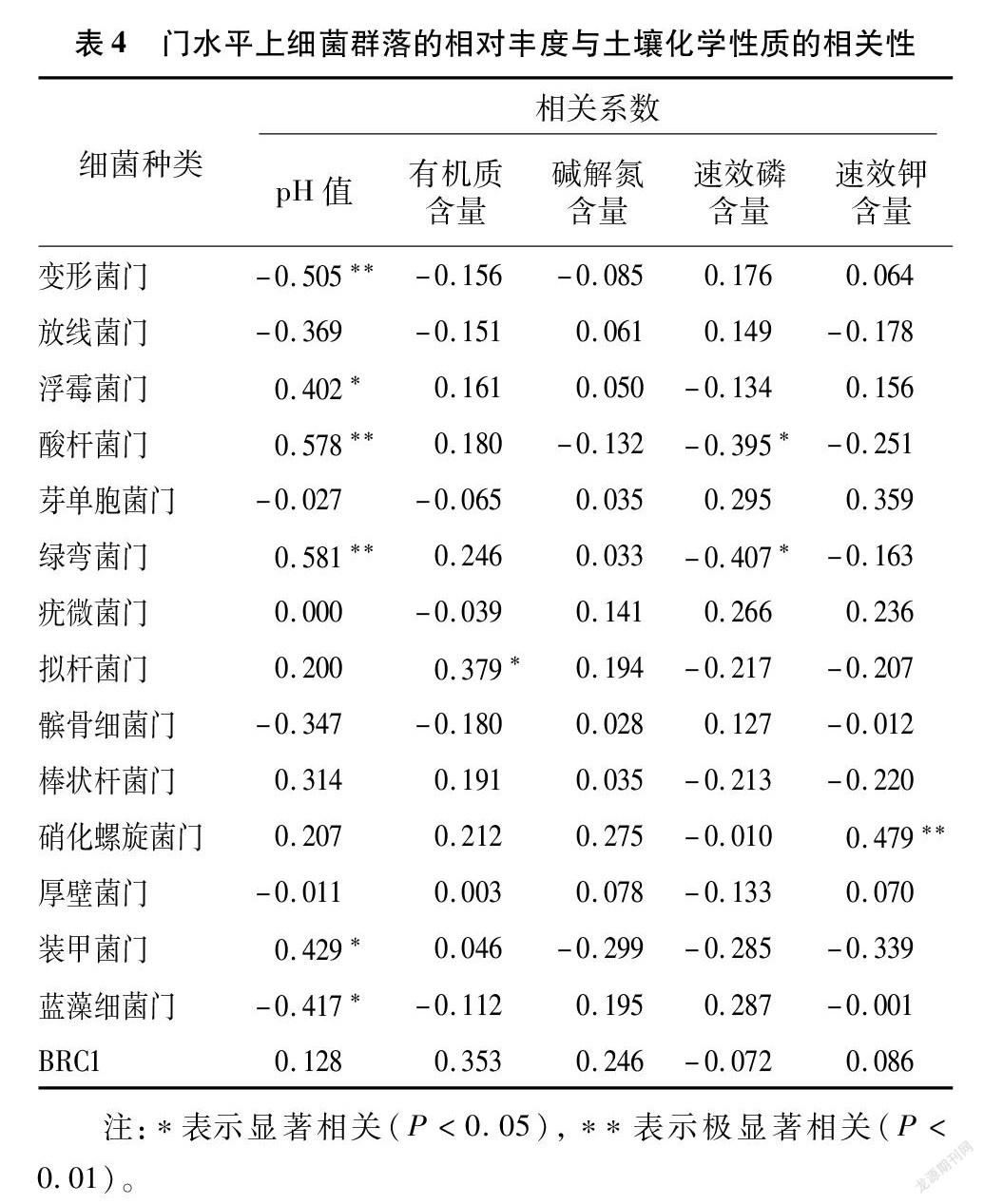
摘要:為探明連作與感染根腐病煙株根際土壤細菌群落結構變化,采用Illumina高通量技術對細菌16S rDNA的V3-V4區域進行測序,對比研究連作煙田健株與感染根腐病煙株根際土壤細菌群落結構。結果表明,變形菌門、放線菌門、浮霉菌門、酸桿菌門、芽單胞菌門、綠彎菌門是連作煙田健株和病株根際土壤主要的細菌優勢種群,相對豐度累計總和為89.1%~93.9%,隨連作年限的延長各優勢種群發生趨向性變化;隨連作年限的延長,健株根際土壤細菌群落豐富度和多樣性呈先增后降趨勢,病株根際土壤細菌群落豐富度和多樣性呈降低趨勢,短期連作(2~4 年)煙田健株和病株根際土壤細菌群落組成較為相似,與連作8年和撂荒2年以上(CK)土壤樣本的細菌群落組成差異較大;冗余分析結果表明,土壤化學因子與細菌群落分布關聯緊密,其中pH值是影響土壤細菌群落分布的核心因子,其貢獻度為15.77%。綜上,連作和染病降低了土壤細菌群落豐富度和多樣性,優勢菌群趨向性演化,有益菌群相對豐度降低。在生產實踐中,提高煙田土壤pH值,降低連作年限并及時清除煙株病殘體有利于維持土壤微生態環境的穩定性。
關鍵詞:高通量測序;連作煙田;細菌群落;冗余分析;根際土壤;多樣性分析
中圖分類號: S154.36;S154.37文獻標志碼: A
文章編號:1002-1302(2022)04-0198-07
收稿日期:2021-05-26
基金項目:國家自然科學基金(編號:32060445、41807524);云南省自然科學基金(編號:202001AU070114);廣西中煙工業有限責任公司科技項目(編號:GXZYCX2019b004)。
作者簡介:敖金成(1984—),男,云南曲靖人,博士研究生,高級工程師,主要從事植物營養與病害控制技術研究。……

