桑黃擴大培養活性成分變化規律*
劉 進,許 謙**,賈世杰,李秉恩,丁紅振,孫宜秀,張慧敏,張 鑫,王瑩菲
(1.菏澤學院農業與生物工程學院,山東菏澤,274015;2.青島大學生命科學學院,山東青島,266071)
桑黃菌(Phellinus igniarius) 自古以來就被用作藥用真菌[1]。桑黃菌在生長初期表現為茶色,隨后顏色漸漸變深;在生長中期逐漸變成馬蹄形,往木質發展,越來越堅硬;到了生長末期,桑黃菌表面的皮質硬殼就會從自身脫落,顏色與菌體本身的色彩相同,堅硬,木質,上端逐漸變尖[2]。桑黃的應用歷史十分悠久,“桑黃”一詞最早出現在隋唐時期甄權的《藥性論》中[3],藥理作用最初記載在秦漢時期的《神農本草經》中,從古至今被廣泛記錄,具有止血、排毒、活血的功效[4],現代經過大量科研工作者的努力,研究出桑黃有抗氧化、免疫調節、抗炎、抗腫瘤等生物醫學方面的作用[5-8]。桑黃的活性成分有很多,其中最主要的活性成分是多糖、黃酮和三萜類物質。多糖具有抗腫瘤、抗氧化等功效;黃酮具有降血脂血糖、抗衰老等功效;三萜具有抗菌、抗腫瘤等功效[2]。
桑黃在我國集中分布在黑龍江東部、西北地區陜西與甘肅交界的“子午嶺”自然保護區、東北的長白山林區等地,國外主要分布在日本、韓國、朝鮮、俄羅斯等地[9]。桑黃的野生資源十分匱乏,產量有限,不足以滿足龐大的市場需求,其最有效的解決方法是進行人工栽培和菌絲體發酵。但桑黃人工栽培的難度較大[10-11],且價格昂貴。然而菌絲體液體發酵技術卻具有技術要求低、周期短、污染少等優點[12],采用液體發酵技術培養桑黃具有較好的應用前景。目前桑黃相關研究大多集中在培養以及其活性物質的提取和作用功效方面,對桑黃擴大培養過程中活性成分變化規律的研究較少,因此通過對桑黃擴大培養過程中活性成分變化規律進行研究,希望對桑黃的擴大培養以及活性成分的規模化生產提供幫助。
1 材料與方法
1.1 材料
1.1.1 供試菌株
試驗的供試菌株為桑黃菌種SH-001,由菏澤學院E208實驗室提供。
1.1.2 試驗試劑
主要試劑的信息見表1。

表1 主要試劑Tab.1 The main reagents
多糖的測定[12-13]:葡萄糖,蒽酮-硫酸試劑(200 mg蒽酮迅速溶于100 mL 98%濃硫酸中,當天使用)。
黃酮的測定[14]:95%乙醇,98%蘆丁,無水AlCl3。
三萜的測定[15-16]:齊墩果酸對照品,香草醛溶液(在10 mL冰醋酸中加入0.5 g香草醛使其溶解,當天使用),乙酸乙酯,高氯酸。
其余試劑為瓊脂粉、玉米粉、KH2PO4、MgSO4、馬鈴薯提取液、豆面。
1.1.3 試驗儀器
XY-YT液體菌種培養器,濟南蕈源農業機械有限公司;UV-6100可見光分光光度計,上海元析儀器有限公司;MLS-3780高壓蒸汽滅菌鍋,三洋電機株式會社;ZQZY-C8震蕩培養箱,上海知楚儀器有限公司;HR/T20M臺式高速冷凍離心機,湖南赫西儀器裝備有限公司;GL224I-1SCN電子天平,賽多利斯科學儀器(北京) 有限公司;YJVS-2雙人垂直超凈工作臺,無錫一凈凈化設備有限公司;BCD-268STCV冰箱,青島海爾股份有限公司;HH-W-420數顯恒溫水箱,金壇市江南儀器廠;電熱鼓風干燥箱,上海博訊醫療生物儀器有限公司;MJ-250-1霉菌培養箱,上海一恒科學儀器有限公司。
1.2 試驗方法
1.2.1 桑黃菌種活化
1)PDA培養基的制備[17]:馬鈴薯去皮切塊,稱取200 g,煮沸30 min,8層紗布過濾取濾液,加入20 g瓊脂,攪拌至完全溶解,加入20 g葡萄糖混勻,溫水定容至1 000 mL,pH自然,趁熱分裝至錐形瓶,121℃滅菌30 min,倒平板。
2)菌種活化:把桑黃菌種轉接至PDA培養基上,28℃培養,每2天觀察記錄其生長形態。
1.2.2 液體培養
1) 液體培養基
液體培養基配方:玉米粉20 g·L-1、豆面10 g·L-1、KH2PO42.5 g·L-1、MgSO41 g·L-1,pH 自然。
液體培養基配制方法:玉米粉和豆面加適量蒸餾水煮沸30 min,加入KH2PO4和MgSO4,溶解后定容,pH自然。
2) 錐形瓶培養
處理1:250 mL錐形瓶中倒入150 mL液體培養基,8層紗布2層報紙封口,共25瓶,121℃滅菌30 min,冷卻備用。從活化桑黃菌種的固體培養基上,用打孔器取直徑1 cm圓形菌塊接種到液體培養基,每瓶接種2個菌塊,28℃、180 r·min-1搖床培養。
處理2:500 mL錐形瓶倒入300 mL液體培養基,8層紗布2層報紙封口,共45瓶,121℃滅菌30 min,冷卻備用。從活化桑黃菌種的固體培養基上,用打孔器取直徑1 cm圓形菌塊接種到液體培養基,每瓶接種4個菌塊,28℃、180 r·min-1搖床培養。
2個處理均每3天取樣觀察,測定并記錄其3種活性物質的含量。
3) 發酵罐培養
發酵罐液體培養基:玉米粉20 g·L-1、豆面10 g·L-1,pH自然,接種量10%。
60 L發酵罐加35.8 L液體培養基,閉罐118℃高溫滅菌1 h后冷卻水循環冷卻,取500 mL錐形瓶培養14 d的桑黃菌絲體14瓶,在無菌操作下倒入發酵罐中,溫度設定為23℃,罐內氣壓為0.03 MPa~0.05 MPa,培養7 d,觀察記錄。
1.2.3 分離菌絲體
培養桑黃菌絲體的250 mL和500 mL錐形瓶各取3瓶,發酵罐取菌絲體時要嚴格按照操作規范進行無菌操作。各取20 mL培養液通過8層紗布過濾得到菌絲體和發酵液。發酵液放冰箱冷藏,用作胞外活性物質的測量,菌絲體用蒸餾水清洗3次,在60℃干燥箱中干燥至恒重,備用。
1.2.4 多糖含量測定
葡萄糖標準曲線繪制[13]:根據參考文獻[13]的方法測定葡萄糖標準液,繪制標準曲線。
胞外多糖測定:取5 mL菌液10 000 r·min-1離心10 min,取1 mL上清液,加入3倍95%乙醇,振蕩,4℃過夜,3 500 r·min-1離心15 min,收集沉淀,得到桑黃粗多糖。取桑黃粗多糖溶于10 mL熱水,稀釋10倍,取0.5 mL于試管中,加入蒽酮-硫酸試劑2 mL,立即搖勻,100℃水浴中顯色10 min,取出,冰浴至室溫,于波長620 nm處測定其吸光度值。
胞內多糖測定:取0.2 g桑黃干粉加水,料液比為 1 ∶45,100℃浸提 3.5 h,3 500 r·min-1離心 10 min,取上清液,加3倍95%乙醇,后續步驟與胞外多糖的測定方法相同。
1.2.5 黃酮含量測定
標準曲線的繪制、胞外和胞內黃酮含量的測量均按照參考文獻[15]進行操作。
1.2.6 三萜含量測定
齊墩果酸標準曲線的繪制、胞內三萜含量的測量均按照參考文獻[16]進行操作。
胞外三萜的測定:取1 mL桑黃培養液過濾液,加入95%乙醇3 mL,靜置24 h,去沉淀,取上清液1 mL,100℃蒸餾去除乙醇,加入0.4 mL香草醛,1.6 mL高氯酸,70℃水浴15 min,加入4 mL乙酸乙酯搖勻,靜置15 min,于波長551 nm處測定吸光度值。
2 結果與分析
2.1 桑黃菌絲體液體發酵
2.1.1 固體培養基菌種活化
PDA固體培養基上桑黃菌種活化過程中的菌絲體形態變化見圖1。

圖1 固體培養基上桑黃形態的變化Fig.1 Morphological changes of Phellinus igniarius on solid medium
在PDA固體培養基上桑黃菌種活化過程的生長情況詳見表2。

表2 桑黃菌種活化過程生長情況記錄Tab.2 Growth record of Phellinus igniarius during activation
2.1.2 錐形瓶液體培養
在300 mL液體培養基(處理2) 中桑黃的生長形態變化見圖2。

圖2 錐形瓶液體培養基中桑黃形態的變化Fig.2 Morphological changes of Phellinus igniarius in liquid medium of conical flask
桑黃在錐形瓶液體培養過程中,取20 mL培養液測定菌絲干重,其測定結果及生長情況記錄詳見表3。
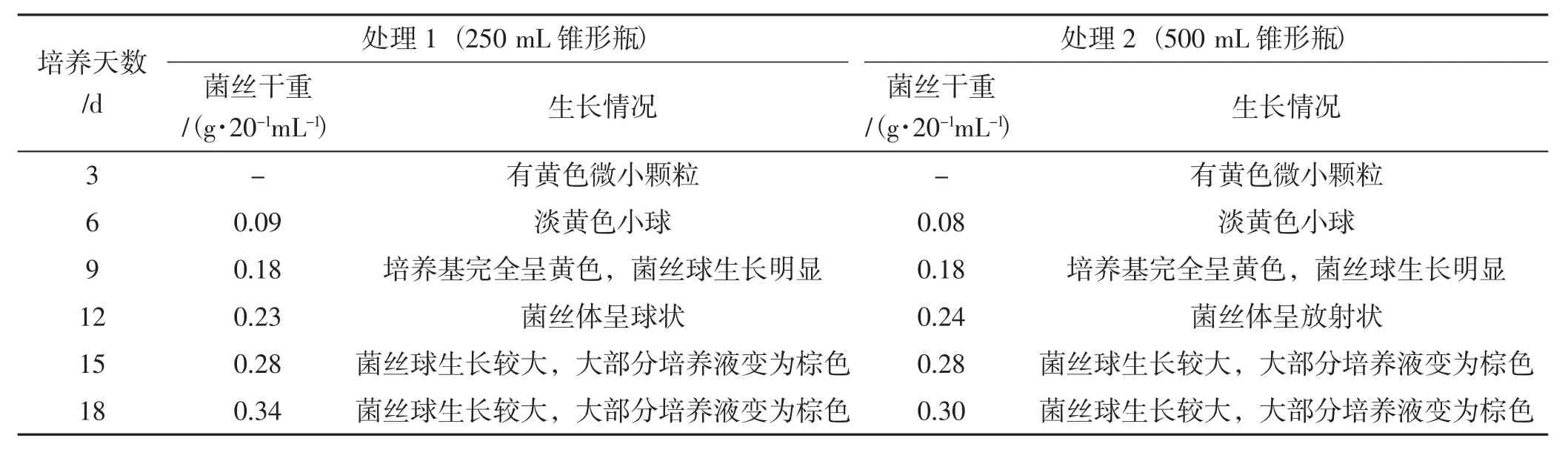
表3 桑黃菌種錐形瓶液體培養過程生長情況記錄Tab.3 Growth record of Phellinus igniarius strain in liquid medium of conical flask
由表3可知,處理1與處理2培養的桑黃菌絲體干重基本相同,第6天~第9天菌絲體干重翻倍增加,之后穩步增加。但2個處理中菌絲體生長情況稍有不同,第12天時處理1的桑黃菌絲體呈球狀,處理2的桑黃菌絲體呈放射狀。
2.1.3 發酵罐液體培養
發酵罐液體培養桑黃的形態變化詳見圖3。

圖3 發酵罐液體培養基中桑黃形態的變化Fig.3 Morphological changes of Phellinus igniarius in liquid medium of fermenter
發酵罐液體培養桑黃過程中取20 mL培養液測定菌絲干重,其測定結果及生長情況記錄詳見表4。

表4 桑黃菌種發酵罐液體培養過程生長情況記錄表Tab.4 Growth record of Phellinus igniarius in liquid medium of fermenter
由表4可知,60 L發酵罐培養的桑黃菌絲體干重在第4天達到最大,第6天不變,第7天時減少0.01 g。證明在60 L發酵罐培養時,菌絲體最好的收獲時間為4 d~6 d。
2.2 桑黃液體培養過程中的活性成分
2.2.1 標準曲線
1)多糖測定的標準曲線
在波長620 nm處測定葡萄糖標準液的吸光度值并繪制標準曲線,見圖4。

圖4 葡萄糖標準曲線Fig.4 Standard curve of glucose
如圖4所示,葡萄糖標準曲線的線性回歸方程為:

該回歸方程的相關系數R2為0.999 8。
2)黃酮測定的標準曲線
通過AlCl3比色法在波長410 nm處測蘆丁標準液吸光度值并繪制標準曲線,見圖5。

圖5 蘆丁標準曲線Fig.5 Standard curve of rutin
如圖5所示,蘆丁標準曲線的線性回歸方程為:

該回歸方程的相關系數R2為0.999 8。
3)三萜測定的標準曲線
在波長551 nm處測定齊墩果酸標準液的吸光度值并繪制標準曲線,見圖6。

圖6 齊墩果酸標準曲線Fig.6 Standard curve of oleanolic acid
如圖6所示,齊墩果酸標準曲線的線性回歸方程為:
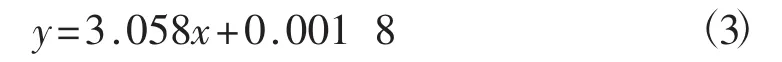
該回歸方程的相關系數R2為0.999 7。
2.2.2 桑黃活性成分變化趨勢
1) 多糖變化趨勢
錐形瓶液體培養桑黃的胞外多糖含量變化趨勢見圖7。

圖7 錐形瓶培養桑黃菌絲體的胞外多糖Fig.7 The extracellular polysaccharide from mycelium of Phellinus igniarius in conical flask
由圖7可知,錐形瓶培養的桑黃菌絲體胞外多糖含量的變化趨勢總體下降,2個培養規格均在第6天時菌絲體胞外多糖的含量最高,在第12天后快速降低。
錐形瓶液體培養桑黃的胞內多糖含量變化趨勢見圖8。

圖8 錐形瓶培養桑黃菌絲體的胞內多糖Fig.8 The Intracellular polysaccharide from mycelium of Phellinus igniarius in conical flask
由圖8可知,胞內多糖含量變化呈波浪形。處理1的桑黃菌絲體胞內多糖在第9天時含量最高,處理2的桑黃菌絲體胞內多糖在第6天含量最高,處理1比處理2的胞內多糖含量峰值延遲3 d出現。二者相比,處理2的培養條件更利于胞內多糖迅速產生。
發酵罐液體培養桑黃菌絲體的胞外多糖含量變化趨勢見圖9。

圖9 發酵罐培養桑黃菌絲體的胞外多糖Fig.9 The extracellular polysaccharide from mycelium of Phellinus igniarius in fermenter
由圖9可知,發酵罐培養的桑黃菌絲體胞外多糖含量先減少后增加,在第7天時最高。
發酵罐液體培養桑黃菌絲體的胞外多糖含量變化趨勢見圖10。

圖10 發酵罐培養桑黃菌絲體的胞內多糖Fig.10 The Intracellular polysaccharide from mycelium of Phellinus igniarius in fermenter
由圖10可知,發酵罐培養的桑黃菌絲體胞內多糖波動變化,含量先增加后減少再增加,在第7天達到峰值。
2) 黃酮變化趨勢
錐形瓶液體培養桑黃菌絲體的胞外黃酮含量變化趨勢見圖11。

圖11 錐形瓶培養桑黃菌絲體的胞外黃酮Fig.11 The extracellular flavonoids from mycelium of Phellinus igniarius in conical flask
由圖11可知,相同培養時間下,處理1培養的桑黃菌絲體胞外黃酮含量均高于處理2,且都呈先高后低的趨勢。處理1胞外黃酮含量在第12天時最高,處理2第9天含量最高,處理1峰值出現時間比處理2延遲3 d。
錐形瓶液體培養桑黃菌絲體的胞內黃酮含量變化趨勢見圖12。

圖12 錐形瓶培養桑黃菌絲體的胞內黃酮Fig.12 The Intracellular flavonoids from mycelium of Phellinus igniarius in conical flask
由圖12可知,除第9天以外,其他相同的培養時間下,處理1培養的桑黃菌絲體胞內黃酮含量都高于處理2,且都呈先高后低的趨勢,并均于第12天達到峰值。
發酵罐液體培養桑黃菌絲體的胞外黃酮含量變化趨勢見圖13。

圖13 發酵罐培養桑黃菌絲體的胞外黃酮Fig.13 The extracellular flavonoids from mycelium of Phellinus igniarius in fermenter
由圖13可知,60 L發酵罐培養的桑黃菌絲體胞外黃酮含量先增加后減少再增加,第7天胞外黃酮的含量最高。
發酵罐液體培養桑黃菌絲體的胞內黃酮含量變化趨勢見圖14。

圖14 發酵罐培養桑黃菌絲體的胞內黃酮Fig.14 The Intracellular flavonoids from mycelium of Phellinus igniarius in fermenter
由圖14可知,60 L發酵罐培養的桑黃菌絲體胞內黃酮的含量先增加后降低,第6天胞內黃酮含量最高。
3) 三萜變化趨勢
錐形瓶液體培養桑黃菌絲體的胞外三萜含量變化趨勢見圖15。
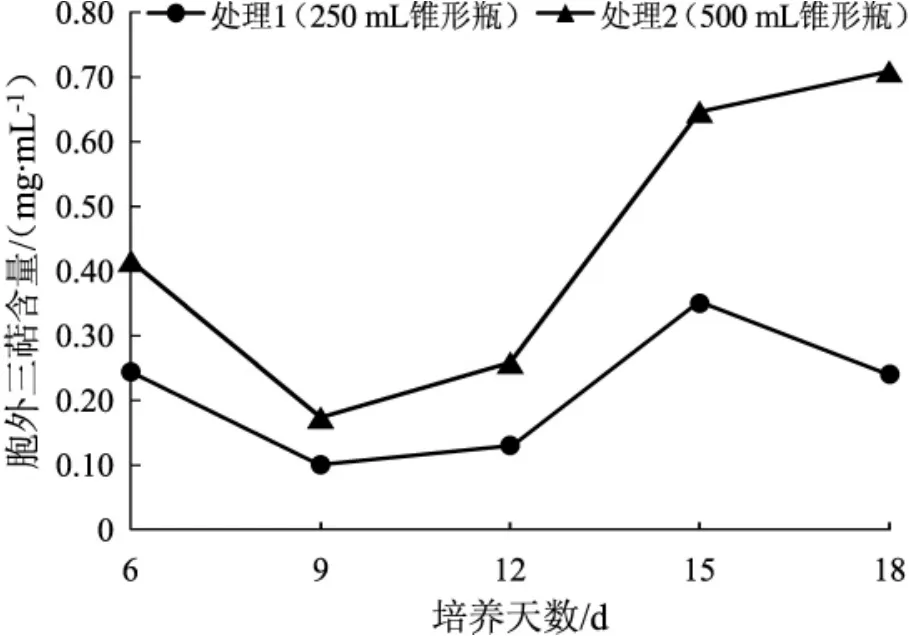
圖15 錐形瓶培養桑黃菌絲體的胞外三萜Fig.15 The extracellular triterpenes from mycelium of Phellinus igniarius in conical flask
由圖15可知,相同的培養時間下,處理2的桑黃菌絲體胞外三萜含量均大于處理1。處理1中胞外三萜含量先減少后增加又減少,第15天含量最高;處理2中胞外三萜含量先減少后增加,第18天含量最高。
錐形瓶液體培養桑黃菌絲體的胞內三萜含量變化趨勢見圖16。

圖16 錐形瓶培養桑黃菌絲體的胞內三萜Fig.16 The Intracellular triterpenes from mycelium of Phellinus igniarius in conical flask
由圖16可知,相同的培養時間下,處理2的桑黃菌絲體胞內三萜含量基本大于處理1。處理1中胞內三萜的含量先增加后減少再增加又減少,第15天含量最高;處理2中胞內三萜含量先增加后減少再增加,第9天含量最高。
發酵罐液體培養桑黃菌絲體的胞外三萜含量變化趨勢見圖17。

圖17 發酵罐培養桑黃菌絲體的胞外三萜Fig.17 The extracellular triterpenes from mycelium of Phellinus igniarius in fermenter
由圖17可知,60 L發酵罐培養的桑黃菌絲體胞外三萜含量先減少后增加,在第7天含量最高。
發酵罐液體培養桑黃菌絲體的胞內三萜含量變化趨勢見圖18。

圖18 發酵罐培養桑黃菌絲體的胞內三萜Fig.18 The intracellular triterpenes from mycelium of Phellinus igniarius in fermenter
由圖18可知,60 L發酵罐培養的桑黃菌絲體胞內三萜含量持續減少,在第2天含量最高。
3 討論與結論
桑黃菌絲體在2種規格錐形瓶液體培養基和發酵罐的擴大培養過程中,3種活性物質的含量分別表現出不同的變化趨勢。
在150 mL和300 mL液體培養基中胞外多糖都呈下降趨勢;150 mL液體培養基培養的桑黃菌絲體胞內多糖峰值出現時間比300 mL液體培養基培養的延遲3 d,說明300 mL液體培養基培養條件下更利于胞內多糖的迅速產生。60 L發酵罐培養的桑黃胞外多糖呈上升趨勢,而單位胞外胞內多糖的峰值產量低于錐形瓶培養胞內胞外多糖的峰值產量。
在150 mL和300 mL液體培養基中桑黃菌絲體胞外、胞內黃酮都呈先高后低的趨勢。150 mL液體培養基中單位黃酮產量高于300 mL液體培養基中單位黃酮產量,二者相比,150 mL液體培養基的培養條件更利于胞外、胞內黃酮的高產。60 L發酵罐培養的桑黃菌絲體胞外、胞內黃酮都呈現先增長態勢,胞外黃酮第7天達到峰值,胞內黃酮第6天達到峰值。發酵罐培養中單位胞外、胞內黃酮的峰值產量均低于錐形瓶培養中的峰值產量。
在150 mL和300 mL液體培養基中桑黃菌絲體胞外、胞內三萜都有相似的變化規律。其中,150 mL液體培養基中胞內、胞外三萜含量都在第15天達到峰值。300 mL液體培養基中單位三萜產量高于150 mL液體培養基,二者相比,300 mL液體培養基的培養條件更利于胞外、胞內三萜的生產。60 L發酵罐中單位胞外三萜的峰值產量高于錐形瓶胞外三萜的峰值產量,單位胞內三萜的峰值產量接近錐形瓶胞內三萜的峰值產量,說明胞外三萜更適合在大容量培養條件下獲得。
通過比較2種規格錐形瓶桑黃菌絲體生長的情況,可以捕捉桑黃在擴大培養過程中菌絲球的變化特征及活性物質的變化規律,為規模化工業生產提供參考依據。同時,試驗結果說明,如果進行桑黃菌絲體多糖及黃酮的規模化生產,培養條件還需要進一步優化。如果進行桑黃三萜的規模化培養,目前培養條件基本能夠達到量化生產需求。這為確定桑黃規模化培養條件、適時收獲桑黃菌絲體及其多糖、黃酮、三萜等活性物質具有重要的指導意義。

