煙草鳶尾絲囊霉菌的生物學(xué)特性及分子檢測(cè)
李小杰,劉劍君,白靜科,劉 暢,陳玉國(guó),苗 圃,邱 睿,陸施羽,李淑君*
煙草鳶尾絲囊霉菌的生物學(xué)特性及分子檢測(cè)
李小杰1,劉劍君2,白靜科1,劉 暢1,陳玉國(guó)1,苗 圃3,邱 睿1,陸施羽1,李淑君1*
(1.河南省農(nóng)業(yè)科學(xué)院煙草研究所,煙草行業(yè)黃淮煙區(qū)煙草病蟲(chóng)害綠色防控重點(diǎn)實(shí)驗(yàn)室,河南 許昌 461000;2.中國(guó)煙草總公司河南省公司,鄭州 450046;3.河南省煙草公司洛陽(yáng)市公司,河南 洛陽(yáng) 471000)
針對(duì)近年來(lái)河南省許昌、洛陽(yáng)、三門峽等部分煙區(qū)煙草漂浮苗鳶尾絲囊霉根腐病發(fā)生較重的問(wèn)題,采用菌絲生長(zhǎng)速率法初步分析了病原菌的生物學(xué)特性,并根據(jù)NCBI數(shù)據(jù)庫(kù)中鳶尾絲囊霉菌代表菌株CBS 524.87的5個(gè)編碼基因CDS序列,設(shè)計(jì)篩選鳶尾絲囊霉菌的特異性擴(kuò)增引物并應(yīng)用。生物學(xué)特性分析結(jié)果表明,在PDA培養(yǎng)基上,鳶尾絲囊霉菌菌絲生長(zhǎng)的適宜溫度為25~35 ℃,致死溫度為50 ℃,處理10 min;生長(zhǎng)適宜pH為4.0~8.0,最適pH為6.0;連續(xù)光照條件有利于菌絲生長(zhǎng)。篩選獲得了特異性擴(kuò)增鳶尾絲囊霉菌的引物對(duì)7個(gè),對(duì)于基因組DNA擴(kuò)增的靈敏度約為0.182 ng/μL;利用特異引物AiT3分別對(duì)接種育苗基質(zhì)和煙苗進(jìn)行分子檢測(cè),可特異性的檢測(cè)出鳶尾絲囊霉菌,檢測(cè)的靈敏度分別為每克基質(zhì)含菌量為2.5×10-2g病原菌菌絲和0.5 ng/μL煙苗根系基因組DNA。本研究為鳶尾絲囊霉菌的快速分子檢測(cè)提供了技術(shù)支撐,對(duì)苗期鳶尾絲囊霉根腐病病原的準(zhǔn)確識(shí)別和預(yù)測(cè)預(yù)報(bào)提供了依據(jù)。
煙草;鳶尾絲囊霉;生物學(xué)特性;特異引物;分子檢測(cè)
絲囊霉()屬鞭毛菌亞門真菌,是卵菌綱、水霉目、水霉科中的一屬,由絲囊霉屬真菌引起的植物病害在國(guó)內(nèi)外均有報(bào)道[1-8]。由鳶尾絲囊霉()引起的煙草漂浮苗根腐病是煙草上的一種新病害[9],近年來(lái)在河南省許昌、洛陽(yáng)、三門峽等煙區(qū)苗床發(fā)生較重。目前對(duì)該病害及其病原菌的認(rèn)識(shí)水平有限,還不能準(zhǔn)確識(shí)別并進(jìn)行及早診斷,導(dǎo)致防治效果不佳,嚴(yán)重影響煙苗質(zhì)量,給煙草生產(chǎn)帶來(lái)較大威脅。目前對(duì)該病害的檢測(cè)還停留在傳統(tǒng)的病害診斷方法,還未見(jiàn)有關(guān)鳶尾絲囊霉分子檢測(cè)的研究報(bào)道。利用PCR及其相關(guān)聯(lián)的RT-qPCR、LNA-qPCR、巢氏PCR等分子技術(shù)對(duì)植物病害病原菌進(jìn)行檢測(cè)的研究報(bào)道目前已較多[10-12],其中設(shè)計(jì)特異性引物是分子檢測(cè)的關(guān)鍵,肖艷松等[13]以煙草靶斑病菌rDNA-ITS序列為靶標(biāo),設(shè)計(jì)特異性引物Rs-1,建立了靶斑病菌的特異性PCR檢測(cè)體系;封松利等[14]根據(jù)煙草黑脛病菌rDNA-ITS序列,篩選出兩對(duì)檢測(cè)引物YYI-F/R和YYH-F/R,能特異性擴(kuò)增標(biāo)靶病原菌;李小杰等[15]采用RAPD方法篩選獲得了6對(duì)可用于煙草青枯病菌PCR檢測(cè)的特異性引物。
本研究擬對(duì)煙草漂浮苗根腐病病原菌鳶尾絲囊霉進(jìn)行生物學(xué)特性分析,篩選特異性擴(kuò)增引物并對(duì)其進(jìn)行分子檢測(cè),以期為病害的早期快速診斷及預(yù)測(cè)預(yù)報(bào)提供理論依據(jù)。
1 材料與方法
1.1 供試菌株
病原菌鳶尾絲囊霉菌()YW-1由河南省農(nóng)業(yè)科學(xué)院煙草研究所植物保護(hù)研究室提供并保存。
1.2 鳶尾絲囊霉菌YW-1的生物學(xué)特性測(cè)定
1.2.1 溫度對(duì)菌絲生長(zhǎng)的影響 參照文獻(xiàn)[16]方法,將鳶尾絲囊霉菌餅分別置于25、35、40、45、50 ℃的水浴中加熱10 min,接種至PDA平板中央,置于25 ℃光照培養(yǎng)箱中培養(yǎng),同時(shí)以25 ℃恒溫培養(yǎng)的鳶尾絲囊霉菌為對(duì)照處理,3 d后利用十字交叉法測(cè)量各處理的菌落直徑。每個(gè)處理設(shè)置3個(gè)重復(fù),每個(gè)重復(fù)接種3皿。
1.2.2 pH對(duì)菌絲生長(zhǎng)的影響 參照文獻(xiàn)[16]方法,調(diào)節(jié)PDA培養(yǎng)基pH至4、5、6、7、8、9、10、11、12,將直徑為5 mm的鳶尾絲囊霉菌餅接種至不同pH的平板中央,置于25 ℃光照培養(yǎng)箱中培養(yǎng),3 d后利用十字交叉法測(cè)量各處理的菌落直徑。每個(gè)處理設(shè)置3個(gè)重復(fù),每個(gè)重復(fù)接種3皿。
1.2.3 光照時(shí)間對(duì)菌絲生長(zhǎng)的影響 參照文獻(xiàn)[16]方法,將直徑為5 mm的鳶尾絲囊霉菌餅接至PDA平板中央,將平板置于人工氣候培養(yǎng)箱中,25 ℃條件下分別進(jìn)行連續(xù)光照、12 h光照/12 h黑暗、連續(xù)黑暗的培養(yǎng),3 d后利用十字交叉法測(cè)量各處理的菌落直徑。每個(gè)處理設(shè)置3個(gè)重復(fù),每個(gè)重復(fù)接種3皿。
1.3 鳶尾絲囊霉菌特異引物設(shè)計(jì)、篩選與擴(kuò)增
按照真菌基因組DNA提取試劑盒(Order NO. B518259)說(shuō)明書方法操作,提取鳶尾絲囊霉菌基因組DNA。從NCBI數(shù)據(jù)庫(kù)中下載鳶尾絲囊霉菌代表菌株CBS 524.87的5個(gè)編碼基因CDS序列(表1),通過(guò)Primer-Blast設(shè)計(jì)鳶尾絲囊霉菌特異引物,引物合成由生工生物(上海)完成。分別以鳶尾絲囊霉菌()、煙草疫霉菌()、煙草交鏈孢菌()、煙草立枯絲核菌()、煙草膠孢炭疽菌()、煙草擬莖點(diǎn)霉菌(sp.)和煙草尖孢鐮刀菌()等7種供試煙草病原菌以及貝萊斯芽孢桿菌Ba-0321的基因組DNA為模板,利用PCR技術(shù)篩選出能夠特異性擴(kuò)增鳶尾絲囊霉菌的引物。PCR反應(yīng)體系:2×Taq PCR Mix 12.5 μL,10 μmol/L正、反向引物各1 μL,基因組DNA 1 μL為模板,超純水補(bǔ)足至25 μL。PCR擴(kuò)增條件為:95 ℃預(yù)變性5 min;94 ℃變性45 s,59 ℃退火30 s,72 ℃延伸45 s,30個(gè)循環(huán);72 ℃延伸8 min;4 ℃保存。PCR反應(yīng)結(jié)束后,取5 μL擴(kuò)增產(chǎn)物于1.5%的瓊脂糖凝膠中電泳,在BIO-RAD凝膠成像系統(tǒng)上觀察、拍照。回收PCR擴(kuò)增條帶,送至生工生物進(jìn)行測(cè)序。
1.4 特異引物檢測(cè)的靈敏度測(cè)定
以鳶尾絲囊霉菌基因組DNA為模板(模板濃度為18.2 ng/μL),并將模板進(jìn)行101、102、103、104、105、106、107倍稀釋。分別吸取1 μL DNA為模板,利用特異引物進(jìn)行PCR擴(kuò)增,并進(jìn)行電泳檢測(cè)。PCR反應(yīng)體系和程序同1.3。

表1 鳶尾絲囊霉菌編碼基因名稱及大小
1.5 接種基質(zhì)中鳶尾絲囊霉菌的分子檢測(cè)
將鳶尾絲囊霉置于PDA培養(yǎng)基上,于25 ℃培養(yǎng)箱中培養(yǎng)3 d,將10 g菌絲刮至40 mL無(wú)菌水中進(jìn)行勻漿,以該勻漿液為原液,依次進(jìn)行10倍梯度稀釋,分別得到10-1、10-2、10-3、10-4、10-5、10-6、10-7稀釋液。分別吸取10 mL梯度稀釋液加入10 g過(guò)篩的滅菌基質(zhì)中,以加無(wú)菌水的基質(zhì)作為空白對(duì)照。稱取400 mg基質(zhì)樣品,加入等量石英砂,放入自動(dòng)研磨儀(BIO-DL Easy Extct P型)進(jìn)行樣品的預(yù)處理,參照FastDNA? Spin Kit for Soil說(shuō)明書提取樣品總DNA作為模板,利用篩選出的特異引物進(jìn)行PCR擴(kuò)增。
1.6 接種煙苗中鳶尾絲囊霉菌的分子檢測(cè)
采用水培接種法,將生長(zhǎng)至4~5片葉的煙苗置于盛有無(wú)菌水的50 mL滅菌離心管中,每管放置1株煙苗,以浸沒(méi)整個(gè)根系。緩苗1 d后,每株煙苗根系部位接種一塊直徑為5 mm的鳶尾絲囊霉菌菌餅,以空白PDA瓊脂塊為對(duì)照處理,每個(gè)處理設(shè)置3個(gè)重復(fù),每個(gè)重復(fù)接種5株煙苗。分別于接種后1、2、3 d取樣檢測(cè),具體方法為:將煙苗取出,無(wú)菌水沖洗干凈后用滅菌濾紙吸干水分,各截取煙苗接種部位的根系0.1 g,利用植物基因組DNA提取試劑盒(CW0531M,康為世紀(jì))提取各處理樣品基因組DNA,利用鳶尾絲囊霉菌特異引物進(jìn)行PCR擴(kuò)增及靈敏度測(cè)定。
1.7 數(shù)據(jù)分析
利用Excel軟件對(duì)數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析,利用DPS 7.05軟件進(jìn)行差異顯著性檢驗(yàn),采用Duncan新復(fù)極差法進(jìn)行多重比較。
2 結(jié) 果
2.1 鳶尾絲囊霉菌YW-1的生物學(xué)特性
試驗(yàn)結(jié)果表明(圖1),隨著溫度的升高,鳶尾絲囊霉菌的生長(zhǎng)受到不同程度的抑制。在25~35 ℃之間,鳶尾絲囊霉菌良好生長(zhǎng),處理間無(wú)顯著差異;超過(guò)40 ℃時(shí),菌株生長(zhǎng)開(kāi)始受到抑制,超過(guò)50 ℃時(shí),菌株菌絲生長(zhǎng)受到完全抑制,菌落直徑幾乎為0,說(shuō)明鳶尾絲囊霉菌的致死溫度為50 ℃。pH 4.0~8.0范圍內(nèi),菌株菌絲生長(zhǎng)較快,其中pH 6.0時(shí)生長(zhǎng)最快,pH 9.0~13.0時(shí),菌絲生長(zhǎng)逐漸變慢,說(shuō)明鳶尾絲囊霉菌適宜在偏酸和中性環(huán)境中生長(zhǎng)(圖2)。菌株菌絲生長(zhǎng)受光照時(shí)間的影響較大,在連續(xù)光照條件下生長(zhǎng)最快,菌絲直徑達(dá)7.48 cm,顯著高于連續(xù)黑暗、12 h光照/12 h黑暗交替處理,說(shuō)明光照時(shí)間越長(zhǎng)越有利于該菌株的生長(zhǎng)(圖3)。
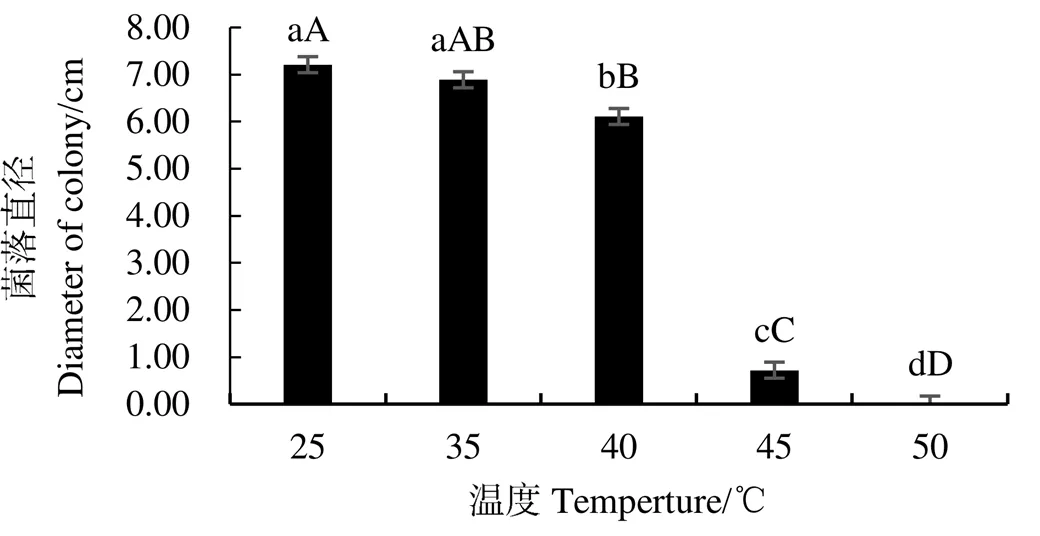
注:圖中不同小寫字母表示p<0.05水平差異顯著;不同大寫字母表示p<0.01水平差異顯著。下同。
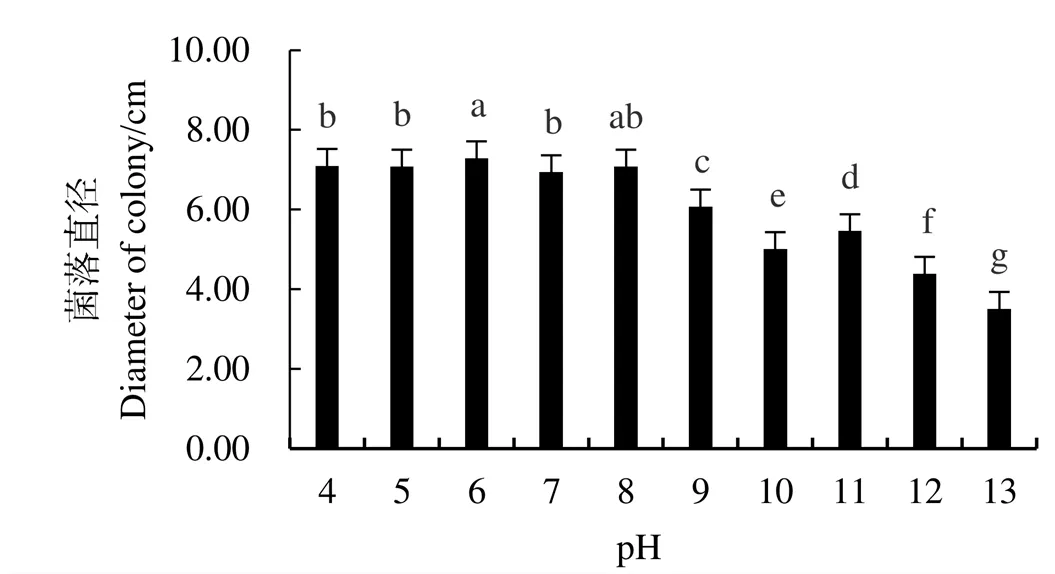
圖2 不同pH條件下鳶尾絲囊霉菌絲的生長(zhǎng)測(cè)定
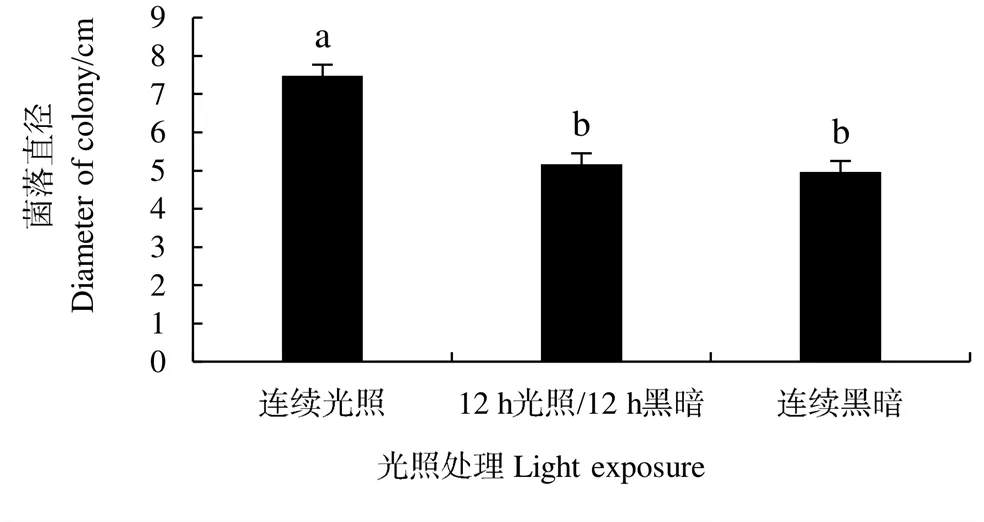
圖3 不同光照條件下鳶尾絲囊霉菌絲的生長(zhǎng)測(cè)定
2.2 鳶尾絲囊霉菌的特異引物篩選及靈敏度分析
根據(jù)鳶尾絲囊霉菌代表菌株strain CBS 524.87的5個(gè)編碼基因CDS序列,通過(guò)NCBI數(shù)據(jù)庫(kù)中的Primer-Blast設(shè)計(jì)出鳶尾絲囊霉菌特異引物7對(duì)(表2)。特異性檢測(cè)結(jié)果表明,設(shè)計(jì)出的7對(duì)特異引物均能特異性擴(kuò)增出鳶尾絲囊霉菌,且條帶明亮單一,無(wú)雜帶(圖4)。序列分析結(jié)果表明,這7個(gè)特異引物對(duì)擴(kuò)增出的DNA片段序列只與NCBI數(shù)據(jù)庫(kù)中CBS 524.87的5個(gè)編碼基因的序列相似性在97%以上,由此表明,所篩選出的7對(duì)引物均可用于特異性檢測(cè)鳶尾絲囊霉菌。
利用篩選出的7個(gè)特異引物對(duì),分別以梯度稀釋的鳶尾絲囊霉菌基因組DNA為模板進(jìn)行PCR擴(kuò)增。結(jié)果表明,特異引物AiT1~AiT7檢測(cè)的靈敏度均可達(dá)到10-2的稀釋度,即約0.182 ng/μL,其中特異引物AiT3擴(kuò)增的條帶更亮更單一(圖5),因此以下試驗(yàn)均選用該引物進(jìn)行鳶尾絲囊霉的PCR擴(kuò)增。
2.3 接種基質(zhì)中鳶尾絲囊霉菌的分子檢測(cè)
分別從每克基質(zhì)含菌量為0.25、0.25×10-1、0.25×10-2、0.25×10-3、0.25×10-4、0.25×10-5、0.25×10-6、0.25×10-7g菌絲的基質(zhì)中提取總DNA,并取1 μL DNA為模板進(jìn)行特異引物的PCR擴(kuò)增,結(jié)果表明,利用特異引物AiT3可對(duì)基質(zhì)中鳶尾絲囊霉菌進(jìn)行分子檢測(cè),且檢測(cè)的靈敏度約為每克基質(zhì)含菌量2.5×10-2g菌絲(圖6)。

表2 鳶尾絲囊霉菌的特異引物序列
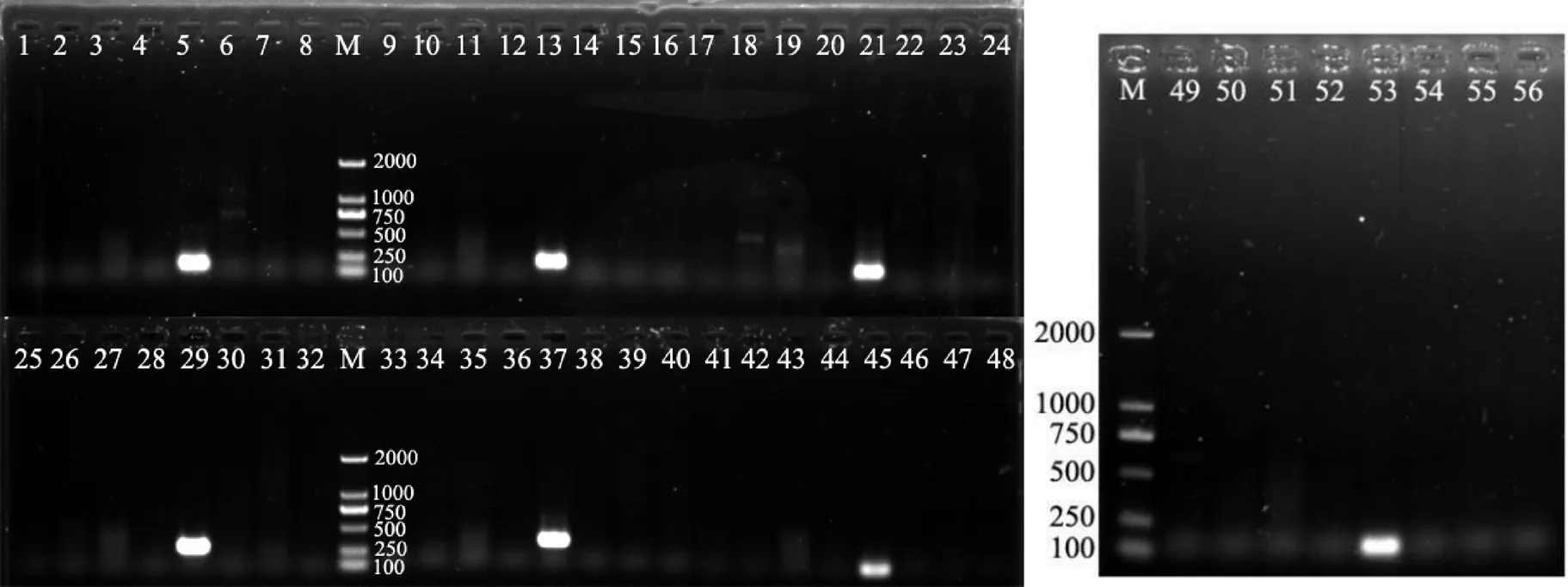
注:M,DL2000 DNA Marker;編號(hào)1~8、9~16、17~24、25~32、33~40、41~48、49~56分別為特異引物AiT1、AiT2、AiT3、AiT4、AiT5、AiT6、AiT7的PCR擴(kuò)增,模板分別為煙草交鏈孢菌、煙草尖孢鐮刀菌、煙草立枯絲核菌、煙草疫霉菌、鳶尾絲囊霉菌、煙草膠孢炭疽菌、煙草擬莖點(diǎn)霉菌、貝萊斯芽孢桿菌Ba-0321基因組DNA。
2.4 接種煙苗中鳶尾絲囊霉菌的分子檢測(cè)
接種鳶尾絲囊霉菌YW-1后1 d,煙苗未表現(xiàn)出發(fā)病癥狀。接種后2 d,煙苗根系出現(xiàn)輕微變褐,但葉片健康且未萎蔫。接種后3 d,煙苗根系嚴(yán)重變褐且出現(xiàn)腐爛現(xiàn)象,葉片變黃萎蔫(圖7a、b)。利用特異引物AiT3進(jìn)行PCR擴(kuò)增,結(jié)果表明,接種后1 d在接種煙苗根系和空白對(duì)照中均未檢測(cè)出鳶尾絲囊霉菌,接種2 d后,在接種煙苗根系中均能夠檢測(cè)出鳶尾絲囊霉菌,而對(duì)照中均未檢測(cè)出該病原菌(圖7c)。分別以梯度稀釋的煙苗根系基因組DNA為模板進(jìn)行PCR擴(kuò)增,結(jié)果表明,特異引物AiT3檢測(cè)的靈敏度可達(dá)到10-2的稀釋度,即約0.5 ng/μL(圖7d)。以上結(jié)果說(shuō)明,篩選出的特異引物AiT3可用于煙苗組織中鳶尾絲囊霉菌的快速檢測(cè)。
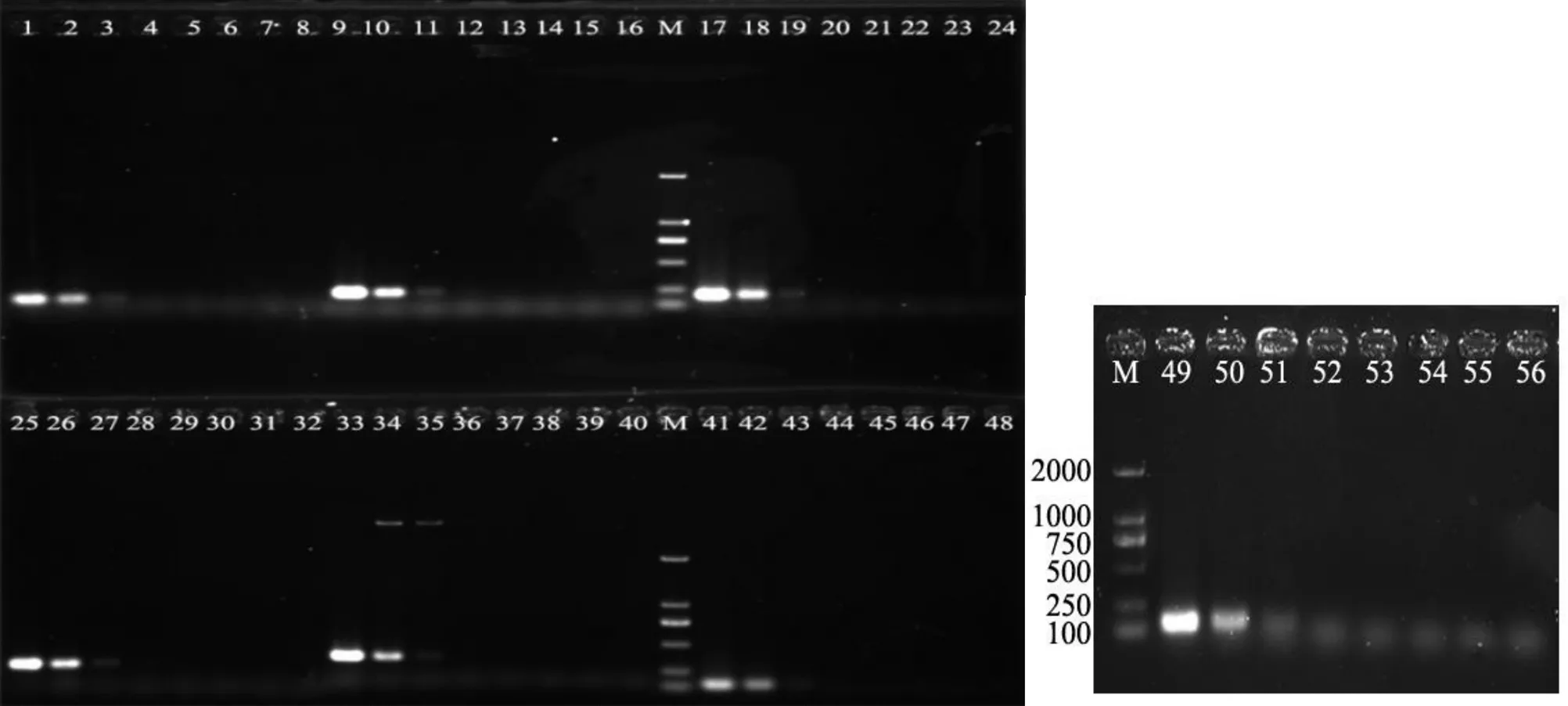
注:M,DL2000 DNA Marker;編號(hào)1~8、9~16、17~24、25~32、33~40、41~48、49~56分別為特異引物AiT1、AiT2、AiT3、AiT4、AiT5、AiT6、AiT7的PCR擴(kuò)增,模板分別為鳶尾絲囊霉菌基因組DNA的10、10-1、10-2、10-3、10-4、10-5、10-6、10-7稀釋液。
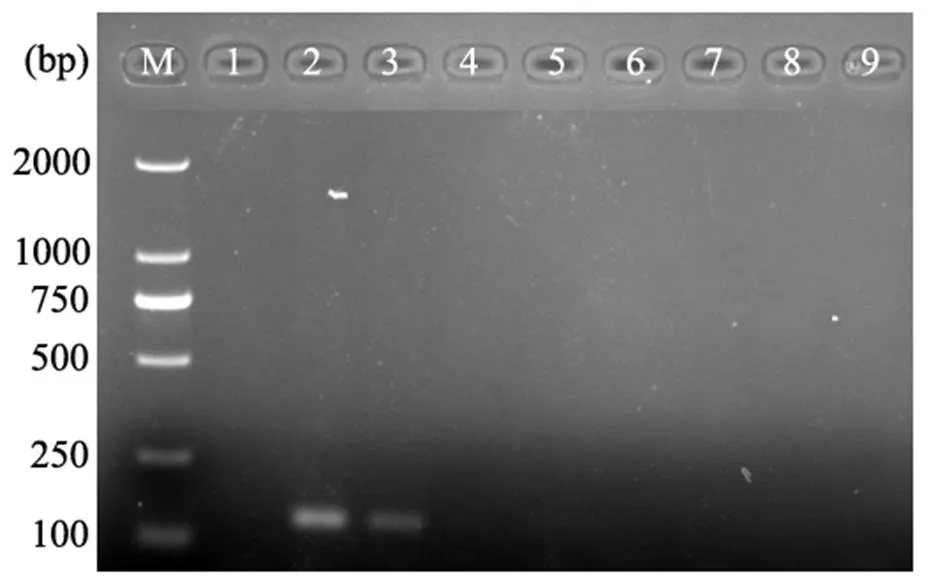
注:M,DL2000 DNA Marker;編號(hào)1~9分別為空白對(duì)照、每克基質(zhì)含菌量為0.25、0.25×10-1、0.25×10-2、0.25×10-3、0.25×10-4、0.25×10-5、0.25×10-6、0.25×10-7 g菌絲的基質(zhì)總DNA。
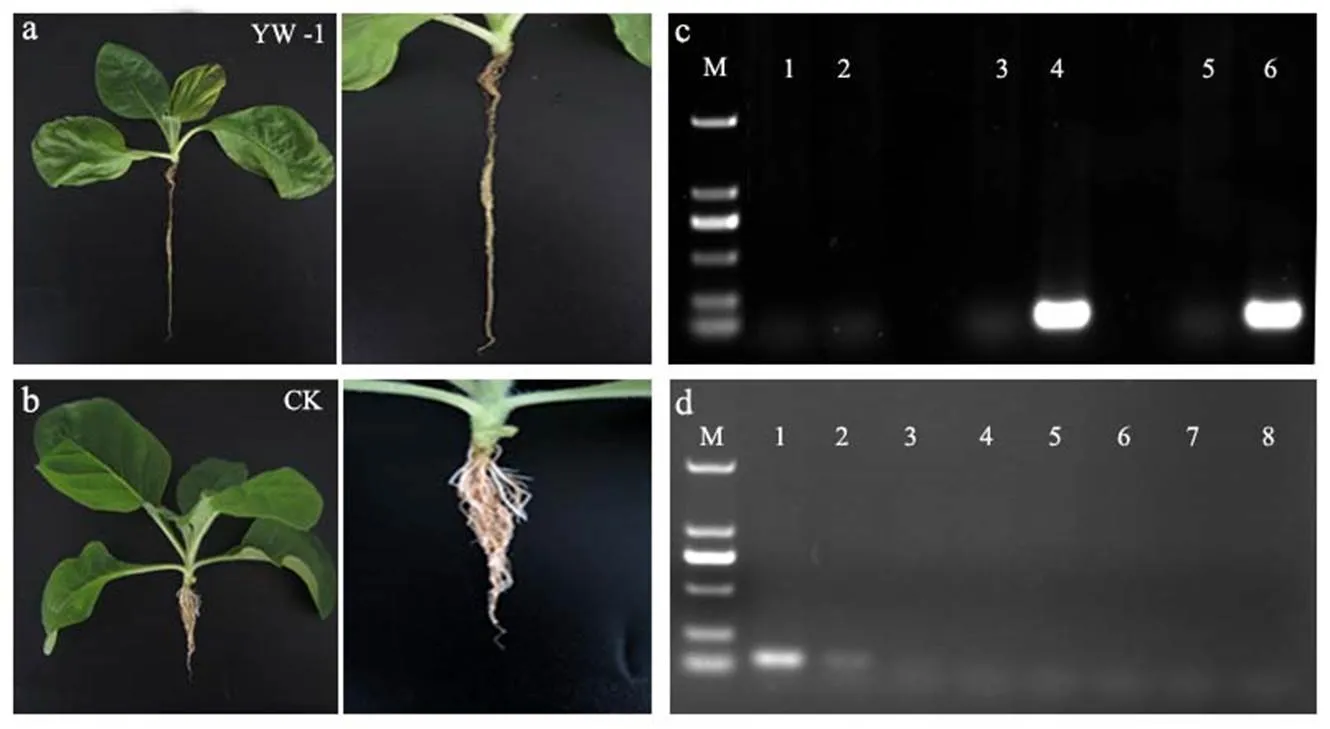
注:a,接種鳶尾絲囊霉菌后3 d煙苗及根系發(fā)病情況;b,空白對(duì)照;c,泳道1、3、5為空白對(duì)照,2、4、6分別為接種后1、2、3 d;d,泳道1~8分別為煙苗根系基因組模板DNA的10、10-1、10-2、10-3、10-4、10-5、10-6、10-7稀釋液;M為DL2000 DNA Marker。
3 討 論
目前國(guó)內(nèi)外關(guān)于植物病原絲囊霉菌生物學(xué)特性的研究報(bào)道較少,李敏權(quán)等[8]研究表明甜菜黑腐絲囊霉()在PDA培養(yǎng)基上的最適生長(zhǎng)溫度為25~27 ℃,33 ℃為其致死溫度,最適pH為5.0~9.9;唐德志等[17]報(bào)道了豌豆絲囊根腐霉()菌絲在CMA培養(yǎng)基上的生長(zhǎng)適溫為28~32 ℃,40 ℃不能生長(zhǎng);有研究發(fā)現(xiàn),鳶尾絲囊霉()卵孢子在玉米粉湯(CMD)或福氏定殖液(FDL)培養(yǎng)基上的最適萌發(fā)溫度為25 ℃,最適pH為6.4,但未報(bào)道其致死溫度[18]。本研究表明引起煙草漂浮苗根腐病的鳶尾絲囊霉菌在PDA培養(yǎng)基上的適宜生長(zhǎng)溫度為25~35 ℃,致死溫度為50 ℃,高于已報(bào)道的其他絲囊霉屬真菌的致死溫度,這可能與菌種或使用的培養(yǎng)基不同有關(guān)。鳶尾絲囊霉菌生長(zhǎng)適宜的pH在4.0~8.0之間,表明該菌比較適宜在偏酸和中性環(huán)境中生長(zhǎng),與前人研究基本一致[8,18]。
本研究首次利用生物信息學(xué)和分子生物學(xué)方法設(shè)計(jì)并篩選出能夠特異性擴(kuò)增鳶尾絲囊霉菌的引物對(duì)7個(gè),靈敏度可達(dá)0.182 ng/μL鳶尾絲囊霉菌基因組DNA。篩選出的特異引物可用于育苗基質(zhì)和煙草組織中鳶尾絲囊霉菌的快速分子檢測(cè),檢測(cè)的靈敏度分別為每克基質(zhì)含菌量為2.5×10-2g病原菌菌絲和0.5 ng/μL煙苗根系基因組DNA,該研究結(jié)果為煙草鳶尾絲囊霉的快速分子檢測(cè)提供了基礎(chǔ)和技術(shù)支撐,彌補(bǔ)了絲囊霉分子檢測(cè)的空白。有研究表明,影響PCR檢測(cè)靈敏度的因素有靶序列的拷貝數(shù)、模板的純度、PCR反應(yīng)體系等[19],在模板量相同的情況下,高拷貝片段相對(duì)于單拷貝更易擴(kuò)增出來(lái),且模板的純度越高、質(zhì)量越好,擴(kuò)增的靈敏度也就越高。因此,下一步將對(duì)PCR擴(kuò)增模板、反應(yīng)體系等條件進(jìn)行優(yōu)化,以提高對(duì)鳶尾絲囊霉分子檢測(cè)的靈敏度。同時(shí)研究定量PCR技術(shù)在該病害分子檢測(cè)中的應(yīng)用,從而實(shí)現(xiàn)對(duì)該病害發(fā)生與流行的準(zhǔn)確預(yù)測(cè)預(yù)報(bào)。
4 結(jié) 論
本研究針對(duì)近年來(lái)河南省許昌、洛陽(yáng)、三門峽等煙區(qū)煙草漂浮苗鳶尾絲囊霉根腐病發(fā)生較重的問(wèn)題,明確了病原鳶尾絲囊霉菌的最適生長(zhǎng)溫度為25~35 ℃,致死溫度為50 ℃,最適pH為6.0。設(shè)計(jì)并篩選出特異性擴(kuò)增鳶尾絲囊霉菌的引物對(duì)7個(gè),建立了鳶尾絲囊霉菌的分子檢測(cè)技術(shù),靈敏度可達(dá)0.182 ng/μL病原菌基因組DNA,實(shí)現(xiàn)了對(duì)育苗基質(zhì)和煙苗中鳶尾絲囊霉的快速檢測(cè),為煙草苗期鳶尾絲囊霉根腐病病原的準(zhǔn)確識(shí)別和預(yù)測(cè)預(yù)報(bào)提供了重要依據(jù)。
[1] WEIMER J L. Root rot of austrian winter peas and vetches[J]. Phytopathology, 1940, 30(8): 708-711.
[2] ICHITANI T, KODAMA T, HORIMOTO K, et al.sp. nov. causing Aphanomyces basal rot of Dutch iris in Japan[J]. Annals of the Phytopathological Society of Japan, 1986, 52(4): 590-598.
[3] JONES F R, DRECHSLER C. Root rot of peas in the United States caused by(N. sp.)[J]. Journal of Agricultural Research, 1925, 30: 293-325.
[4] WICKER E, MOUSSART A, DUPARQUE M, et al. Further contributions to the development of a differential set of pea cultivars () to investigate the virulence of isolates of[J]. European Journal of Plant Pathology, 2003, 109(1): 47–60.
[5] 陳慶河,翁啟勇,何玉仙,等. 福建省豌豆根腐病病原及致病性研究[J]. 福建農(nóng)業(yè)學(xué)報(bào),2004,19(1):28-31.
CHEN Q H, WENG Q Y, HE Y X, et al. Pathogeny and pathogenicity of root disease of peas in Fujian province[J]. Fujian Journal of Agricultural Sciences, 2004, 19(1): 28-31.
[6] 刁治民. 青海豌豆根腐病病原菌種類及致病性的研究[J]. 微生物學(xué)雜志,1996(1):31-34.
DIAO Z M. Study on the pathogen and pathogenicity of root disease of peas in Qinghai[J]. Journal of Microbiology, 1996(1): 31-34.
[7] 唐德志,何蘇琴,李玉奇,等. 甘肅豌豆根病的病原菌種類及致病力研究[J]. 西北農(nóng)業(yè)學(xué)報(bào),1993,2(2):37-39.
TANG D Z, HE S Q, LI Y Q, et al. Study on the pathogen and pathogenicity of root disease of peas in Gansu[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 1993, 2(2): 37-39.
[8] 李敏權(quán),林淑潔,徐秉良,等. 影響甜菜黑腐絲囊霉的幾種生態(tài)學(xué)和生物學(xué)因子[J]. 應(yīng)用與環(huán)境生物學(xué)報(bào),2003,9(2):183-185.
LI M Q, LIN S J, XU B L, et al. Ecological and biological factors affecting[J]. Journal of applied and Environmental Biology, 2003, 9(2): 183-185.
[9] 李小杰,李淑君,李成軍,等. 鳶尾絲囊霉()引起的煙草漂浮苗根腐病的初步報(bào)道[J]. 中國(guó)煙草學(xué)報(bào),2018,24(2):125-128.
LI X J, LI S J, LI C J, et al. Preliminary report on tobacco seedling root rot induced byin floating bed[J]. Acta Tabacaria Sinica, 2018, 24(2): 125-128.
[10] 莫瑾,王哲,周慧平,等. 利用多重PCR技術(shù)快速檢測(cè)4種水稻病原細(xì)菌[J]. 植物保護(hù),2021,47(3):160-164.
MO J, WANG Z, ZHOU H P, et al. A multiplex PCR rmethod for rapid detection of four rice pathogenic bacteria[J]. Plant Protection, 2021, 47(3): 160-164.
[11] 程承,李石力,劉穎,等. 試驗(yàn)土壤中煙草青枯病菌的RT-qPCR檢測(cè)分析[J]. 煙草科技,2017,50(1):12-16.
CHENG C, LI S L, LIU Y, et al. RT-qPCR detection and quantitative analysis ofin soil[J]. Tobacco Science & Technology, 2017, 50(1): 12-16.
[12] 陳杰,朱天輝. 核桃枝枯病小新殼梭孢巢式PCR檢測(cè)方法的建立[J]. 植物保護(hù),2018,44(3):124-129,162.
CHEN J, ZHU T H. Establishment of nested PCR method for detecting the branch dieback of walnut caused by[J]. Plant Protection, 2018, 44(3): 124-129,162.
[13] 肖艷松,鐘權(quán),吳文信,等. 湖南煙草靶斑病的病原鑒定及分子檢測(cè)[J]. 湖南農(nóng)業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版),2020,46(6):711-715.
XIAO Y S, ZHONG Q, WU W X, et al. Pathogen identification and molecular detection of tobacco target spot in Hunan Province[J]. Journal of Hunan Agricultural University (Natural Sciences), 2020, 46(6): 711-715.
[14] 封松利. 河南省煙草黑脛病菌和根黑腐病菌群體遺傳多樣性分析及分子檢測(cè)體系的建立[D]. 鄭州:河南農(nóng)業(yè)大學(xué),2014..
FENG S L. Population genetic diversity and molecular detection ofandin Henan Province[D]. Zhengzhou: Henan Agricultural University, 2014.
[15] 李小杰,劉暢,李成軍,等. 基于RAPD分子標(biāo)記的煙草青枯病菌特異引物篩選及效果評(píng)價(jià)[J]. 中國(guó)煙草學(xué)報(bào),2021,27(2):72-78.
LI X J, LIU C, LI C J, et al. Screening and evaluation of specific primers forbased on RAPD technology[J]. Acta Tabacaria Sinica, 2021, 27(2): 72-78.
[16] 張琳,彭琳,邵郅偉,等. 南瓜炭疽病菌生物學(xué)特性及藥劑防治[J]. 植物保護(hù),2021,47(4):59-65.
ZHANG L, PENG L, SHAO Z W, et al. Biological characteristics and indoor fungicide screening ofcausing pumpkin anthracnose[J]. Plant Protection, 2021, 47(4): 59-65.
[17] 唐德志,何蘇琴,李玉奇,等. 甘肅豌豆絲囊根腐病及其病原鑒定[J]. 植物保護(hù),1991(4):4-5.
TANG D Z, HE S Q, LI Y Q, et al. Pathogen identification of root rot on pea in Gansu Province[J]. Plant Protection, 1991(4): 4-5.
[18] ICHITANI T, HIGASHIKAWA T. Germination ofoospores on the basal medium for selective isolation with addition of bactericides and fungicides[J]. Proceedings of the Kansai Plant Protection Society, 1986(28): 19-24.
[19] 王曉杰,康振生,黃麗麗. PCR技術(shù)在植物病害檢測(cè)中的應(yīng)用[J]. 云南農(nóng)業(yè)大學(xué)學(xué)報(bào),2005(2):179-182.
WANG X J, KANG Z S, HUANG L L. Application of PCR technology on the detection of plant disease[J]. Journal of Yunnan Agricultural University, 2005(2): 179-182.
Biological Characteristics and Molecular Detection ofHarmful to Tobacco Seedlings
LI Xiaojie1, LIU Jianjun2, BAI Jingke1, LIU Chang1, CHEN Yuguo1, MIAO Pu3, QIU Rui1, LU Shiyu1, LI Shujun1*
(1. Tobacco Research Institute of Henan Academy of Agricultural Sciences, Key Laboratory for Green Preservation & Control of Tobacco Diseases and Pests in Huanghuai Growing Area, Xuchang, Henan 461000, China; 2. Henan Provincial Tobacco Company, Zhengzhou 450046, China; 3. Luoyang Branch of Henan Provincial Tobacco Company, Luoyang, Henan 471000, China)
In view of the serious occurrence of root rot caused byin tobacco seedling bed of Henan Province in recent years, this study was carried out to clarify the biological characteristics of the pathogen and fro rapid detection at early stages. The biological characteristics of the pathogen were studied with the mycelial growth rate method, and specific amplification primers forwere designed and screened for application based on the CDS sequences of five coding genes of the representative strain CBS 524.87 in NCBI database. The results showed that the suitable temperature for mycelium growth ofwas 25-35 ℃on PDA plates, and the lethal temperature was 50 ℃ for 10 min. The suitable pH forgrowth was 4.0-8.0 and the optimum pH was 6.0. Continuous light was beneficial to mycelium growth for. Seven pairs of primers were designed and screened for the specific amplification of, and the sensitivity to genomic DNA amplification was about 0.182 ng/μL.could be specifically detected by the specific primer pair AiT3 for molecular detection of inoculated seedling substrate and tobacco seedlings respectively, with the detection sensitivity being 2.5×10-2g hyphae of per gram of substrate and 0.5 ng/μL tobacco seedling root genomic DNA. The results of this study provide technical support for the rapid molecular detection of, and provide an important basis for the accurate identification and prediction of root rot caused byat seedling stages.
tobacco;; biological characteristics; specific primers; molecular detection
10.13496/j.issn.1007-5119.2022.06.008
S435.72
A
1007-5119(2022)06-0053-07
河南省農(nóng)業(yè)科學(xué)院科技創(chuàng)新團(tuán)隊(duì)專項(xiàng)項(xiàng)目(2022TD26);河南省煙草公司科技項(xiàng)目(2022410000240018)
李小杰(1983-),女,博士,助理研究員,主要研究方向?yàn)闊煵莶±韺W(xué)。E-mail:lixiaojie000631@sina.com
,E-mail:13603749396@126.com
2022-03-31
2022-08-19

