微生物鐵蛋白的研究進展
高啟禹 徐光翠 崔彩霞 張文博
(1. 河南新鄉醫學院生命科學技術學院 河南省遺傳性疾病與分子靶向藥物重點實驗室培育基地,新鄉 453003;2. 蘭州大學生命科學學院,蘭州 730000;3. 河南新鄉醫學院公共衛生學院,新鄉 453003)
重金屬離子(如鐵、鈷、鎳、鋅、銅、鉬和鎢)作為金屬酶的組成部分在酶的功能體現中發揮著至關重要的作用。除了這些金屬酶,一些細菌還可以合成金屬結合蛋白,其中鐵結合蛋白,即鐵蛋白(ferritin)在鐵的貯藏中意義重大,是一切生物體內最主要的鐵儲存蛋白,控制著游離鐵在細胞中的儲存[1-2]。
鐵蛋白作為一個古老而龐大的蛋白家族,普遍存在于植物、動物及微生物體內,具有鐵離子代謝、抗氧化脅迫及消除其他過量金屬離子毒害作用的功能。1937年,最早由Laufberge[3]從馬的脾臟中純化分離獲得,研究證實其具有耐酸堿(pH 2.0-12.0)和耐高溫(70-75℃)的特性[4]。典型的微生物鐵蛋白分子(FTN)是由24個亞基組成,外徑約為12 nm,高度對稱且中空(8 nm)的球形結構,基于四氧化三鐵的鐵核位于亞基衣殼中心,由數千個氫氧化鐵分子和數百個磷酸鹽分子以非均勻的結構形式組成,分子質量為450 kD。此外,還發現了包含細菌鐵蛋白(bacterioferritin,BFR)、鐵蛋白Encapsulins及DNA結合鐵蛋白(DNA protection during starvation,Dps)等3種不同類型的鐵蛋白分子結構,而且各種鐵蛋白之間存在著大小差異[5]。比較動植物及微生物鐵蛋白的亞基的組成發現,微生物鐵蛋白和植物鐵蛋白具有相同的亞基結構,但哺乳動物的鐵蛋白有所不同,其結構中存在有重鏈H-型亞基和輕鏈L-型亞基,兩者在不同的組織器官中以不同的比例組裝成完整的鐵蛋白。
鐵蛋白Dps是在古生菌和細菌中發現的一類最小的DNA結合鐵蛋白,具有正常氧化及存儲鐵離子的功能,還能夠非特異性與DNA結合。通過將鐵螯合在其核心的形式,為DNA提供物理保護和免受自由基介導的損害[6-7]。Encapsulins是迄今為止在細菌中發現的最大的一種鐵蛋白,Encapsulins的亞基不含鐵氧化酶中心,它能借助裝載鐵蛋白對鐵離子進行氧化及存儲,同時其內部往往還含有額外的鐵蛋白樣蛋白[8-9]。從原子水平上Encapsulins被細分為黏球菌鐵蛋白、熱袍菌納米鐵蛋白及類病毒嗜熱火球菌鐵蛋白。
這些鐵蛋白要形成氧化鐵顆粒需要一系列步驟,通常包括鐵的補充、轉運、氧化、成核和儲存,并由氧化鐵酶中心介導[10]。同時,在細胞內,鐵蛋白與轉鐵蛋白(transferrin,Tf)、轉鐵蛋白受體(transferrin receptor,TfR)和二價金屬轉運蛋白等通過協同作用,維持著機體細胞的鐵離子平衡[11]。
1 細菌鐵蛋白的結構特點
由于在菌體內存在著Fenton反應所需要的Fe2+、過氧化氫及各種有機物,在不加約束的情況下,Fenton反應會產生大量的羥基自由基,而游離的自由基能夠降解細胞內的脂、核酸和其他生物大分子,對細胞具有極強的氧化損傷作用[12]。因此,細胞為了保護自身免受Fenton反應的負作用影響,在涉及鐵的氧化和礦化的反應過程中,將Fenton反應從細胞溶膠中分離并固定在蛋白質籠內發生。因此,所有鐵蛋白的結構都具有相似性,這種籠狀結構限定了發生這類化學反應的空間構造。
其次,形成致密的礦物鐵心的能力是所有鐵蛋白的典型特征,鐵核中的鐵應受到保護,在溶液中保持并具有生物可利用性,這種結構也決定了鐵蛋白的主要功能。其中鐵蛋白的亞鐵氧化中心可以將Fe2+氧化為Fe3+,這種三價鐵核被儲藏在鐵蛋白衣殼內,1分子的鐵蛋白最多可儲存4 500個Fe3+,而由12個亞基組成的Dps能在腔中容納500個Fe3+[13]。當胞體內Fe2+的濃度不能滿足正常需求時,Fe3+被還原劑還原為Fe2+并釋放,以維持細胞的正常生長代謝,因此鐵蛋白不僅具有消除因Fe2+產生的自由基的氧化損傷,而且調控著胞體內鐵代謝的平衡。同時,研究證實細菌鐵蛋白的結構和序列存在著高度保守的特性[14]。
典型的細菌鐵蛋白FTN型與人類FTH結構類似,鐵的催化氧化中心位于鐵蛋白的4-螺旋束內,形成的空腔結構保證了鐵原子的進入[15]。在24個亞單位組成的殼結構上,沿著三重對稱軸有8個親水孔,沿著四重對稱軸上有6個疏水和不滲透孔。這些通道負責鐵蛋白與外部環境中物質的交換,是各種離子和分子進出鐵蛋白的必經通道。其中沿著三重對稱軸形成的8個親水孔是鐵進入的主要通道,也控制著各種還原劑和螯合劑的進入[16]。鐵蛋白亞基從N端起有A、B、C和D四個α-螺旋,在C端末端有一個E螺旋與螺旋束呈60度夾角構成鐵蛋白亞基,AB、DE和BC鏈接處均有非螺旋區域(圖 1)[17]。
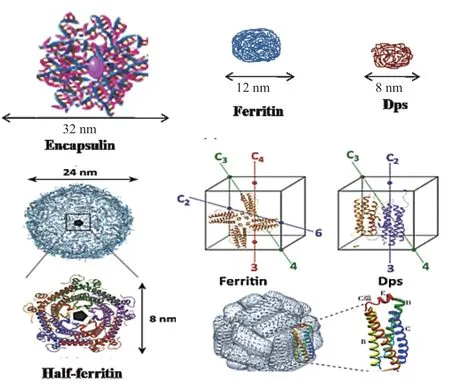
圖1 鐵蛋白及鐵儲存的立體結構Fig.1 Ferritin and iron storage cellular compartments[17]
同時,Stillman等[18]研究發現,原核生物鐵蛋白的亞鐵氧化中心有A、B和C三個鐵離子位點。GIu17、GIu50和His53構成了保守位點A,GIu94、GIu130形成B位點,其中A、B兩個結合位點具有高度保守性。C位點由GIu49、GIu126、GIu129和GIu130四個殘基組成,位于鐵蛋白衣殼的內壁上,可通過殘基GIu130的羧酸酯鍵與B連接(圖2)。
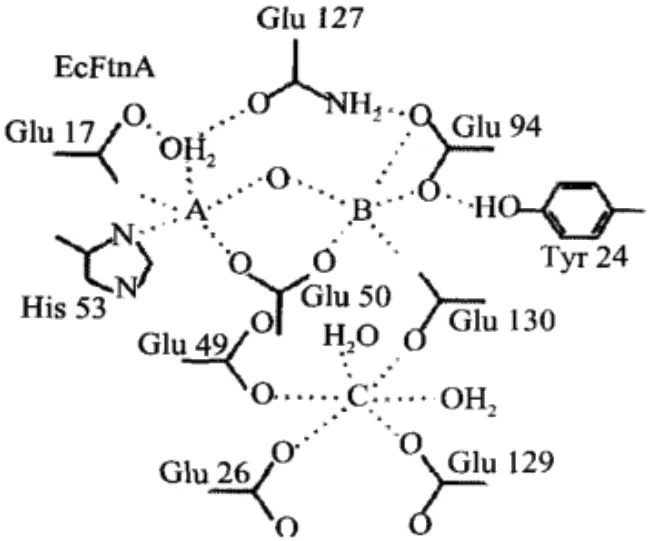
圖2 細菌鐵蛋白的Fe2+氧化位點結構示意圖Fig.2 Structural diagram of Fe2+ oxidation site of bacterial ferritin[18]
BFR的鐵氧化物中心結構不同于FTN的鐵氧化物中心結構,它更為對稱和穩定,通過氧化Fe2+并將生成的Fe3+轉移到中心空腔,近似于門栓的作用。此外,它在亞單位二聚體和鄰近亞單位的界面上還有一個額外的孔,叫做B通道,鐵可以借助B通道進入。
Dps的結構中保守功能是氧化酶和結合鐵,由12個具有相同鐵蛋白折疊的亞單位組成,外徑約為9 nm,鐵氧化物酶中心位于兩個鐵位點上的配體與兩個二聚體之間的界面處,這與在FTN中觀察到的情況相似[13]。
2 鐵氧化酶中心的作用機制
鐵在細胞內氮的固定、電子和氧的運輸及脫氧核糖核苷酸的合成等生物化學反應中發揮著重要的功能。因此鐵氧化酶活性中心的作用主要是快速吸收、氧化及存儲游離的鐵離子,維持鐵在胞體內的平衡,同時鐵氧粒子的形成使細胞能夠精確控制鐵離子的儲存和動員[19]。其次在細胞內的鐵在轉錄水平和翻譯水平上調節鐵蛋白的合成。
鐵氧化酶活性中心的作用機制起始于1943年Granick等[20]對哺乳動物鐵蛋白的研究。目前對于其工作機制的研究主要有兩種模式,模式一中鐵氧化酶中心作為反應基質,兩個Fe2+結合到鐵氧化酶中心作用位點,當它們被氧分子氧化后,Fe(Ⅲ)-O(H)- Fe(Ⅲ)作為整體同時離開中心位點,并為其余游離 Fe2+的氧化做準備。模式二中,當兩個Fe2+被氧分子氧化后,Fe(Ⅲ)-O(H)- Fe(Ⅲ)依舊停留在鐵氧化酶中心的反應位點,作為一個修復組分催化下一個反應的發生[5],如圖3所示。
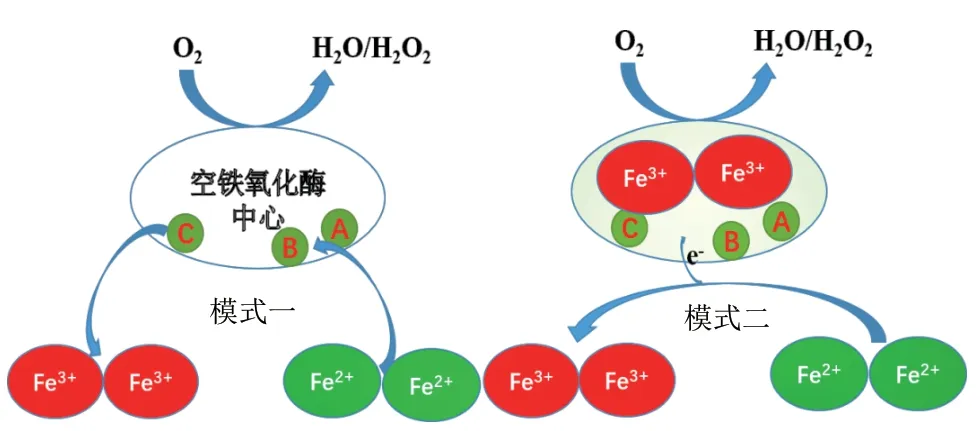
圖3 鐵氧化酶活性中心的作用機制Fig.3 Mechanism of ferroxidase center[5]
但Honarmand等[21]在嗜熱火球菌中發現了另一種有別于以上兩種工作機制的新模式,即當兩個Fe2+在鐵氧化酶中心被氧化后,Fe(Ⅲ)-O(H)-Fe(Ⅲ)會一直穩定地存在于鐵氧化酶中心,在氧分子的參與下,新的Fe2+與Fe3+之間形成 Fe(Ⅲ)-O(H)-Fe(Ⅱ),Fe(Ⅲ)-O(H)-Fe(Ⅱ)能夠驅動Fe3+的移位,使Fe3+被連續轉入到鐵蛋白核心,并且這種模式下的鐵蛋白還具有氧化其他金屬離子的能力。本課題組對分離于酸性礦山廢水中的一株嗜酸嗜鐵氧化亞鐵硫桿菌BY3的抗砷特性分析中發現,Fe2+被氧化為Fe3+的過程中,能夠將As3+氧化為As5+,而且其氧化能力與Fe2+的濃度呈正相關[22]。同時課題組圍繞Fe2+的代謝途徑,借助UniProt 對蛋白質序列分析及注釋的全面性,以uniprot-taxonomy 920.fasta為背景庫,對ferritin、iron oxidase、ferredoxinlike protein、ferredoxin、ferrochelatase、iron-sulfur cluster carrier protein、iron ABC transporter permease等目標蛋白導入Skyline后經理論酶切并優化酶切條件,篩選出特異肽段并進行了質譜DDA及PRM分析,從而為進一步揭示Fe2+的氧化過程在嗜酸嗜鐵菌的生長生存中的作用提供了重要的理論參考。
同時,借助定點突變技術詳細研究了鐵氧化酶活性中心中A、B、C在細菌鐵蛋白中的作用[23]。研究證實A、B和C位點的氨基酸替換會導致嗜熱火球菌鐵蛋白(PfFtn)和大腸桿菌鐵蛋白(EcFtnA)的Fe2+氧化速率降低,同時在細菌鐵蛋白的晶體結構中發現,A、B位點始終被金屬離子完全占據,而C位點在不同細菌中具有不同的空間構象。在已經獲得的脫硫弧菌(Desulfovibrio desulfuricans)、大腸桿菌(Escherichia coli)、棕色固氮菌(Azotobacter vinelandii)和銅綠假單胞菌(Pseudomonas aeruginosa)的晶體結構中,對其鐵氧化酶中心進行分析結構時發現,C位點會出現Fe2+占據或空位現象,表明C位點可能作為一個短暫的鐵結合位點存在。因此在鐵氧化酶活性中心中,A、B位點是Fe2+快速氧化的必要因素,而C位點并非Fe2+快速氧化的必要條件,一定程度上調控著Fe2+/ Fe3+被轉移到鐵蛋白內或從鐵蛋白中移出[24]。
3 鐵的調控與釋放機制
雖然人們對傳統鐵蛋白中的鐵吸收和氧化有比較清楚的了解,但對鐵調控機制的研究仍存在爭議,Fe3+如何從鐵氧化酶中被移除還尚不清楚。有研究認為鐵蛋白調控鐵的主要途徑與蛋白質的水解降解有關,包括鐵蛋白分子進入溶酶體,然后在水解酶的作用下氫氧化鐵核心暴露并溶解[25-26]。La 等[27]借助鐵蛋白的放射性鐵標記及誘導表達發現,鐵蛋白中鐵的調控不是通過對細胞內還原劑或螯合劑的細胞濃度進行調節,而是依靠鐵蛋白和二價金屬離子轉運體(divalent metal transporter 1,DMT1)協同運動到溶酶體。在溶酶體中,鐵蛋白自身降解及暴露鐵氫化物晶體并在溶酶體中溶解,還原的鐵被運輸回胞漿后通過細胞中的DMT1釋放或再次儲存在鐵蛋白中。
在缺鐵的條件下,鐵蛋白在真核細胞中循環的半衰期約為19-24 h,但在富含鐵的環境中循環的半衰期要長得多,這表明細胞中鐵的調控極其嚴格,但仍然不清楚鐵蛋白的蛋白水解是否是鐵從蛋白中釋放的唯一機制,以及是否存在其他輔助的鐵調控機制,使細胞能夠及時獲得鐵。但目前公認的鐵蛋白中鐵釋放通道位于鐵蛋白三重軸通道的C-D螺旋鉸鏈區,而該區域又是鐵的入口(圖4)。雖然三重軸通道的孔徑大約只有4?,但在結構上具有一定的空間柔性,這種柔性特點能夠使一些稍大于孔徑的物質進入鐵蛋白腔內[28-29]。
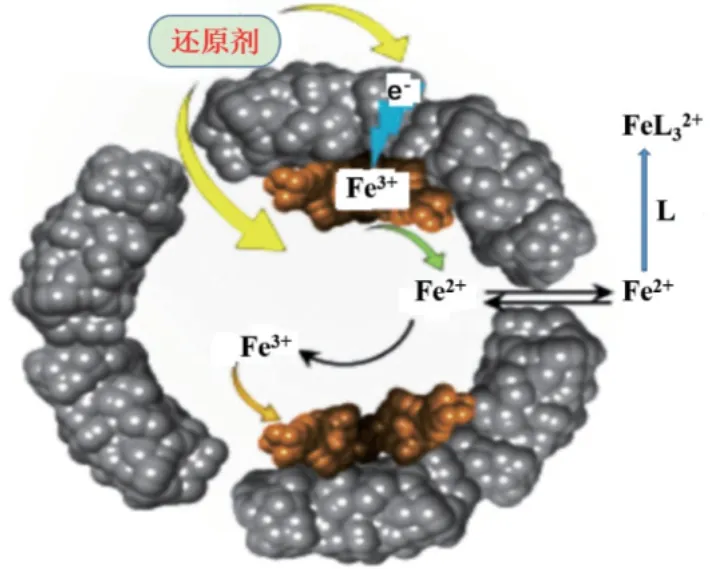
圖4 鐵蛋白中鐵的氧化還原機制Fig.4 Redox mechanism of iron in ferritin[28]
研究表明,細菌也可以通過鐵輸出系統來控制細胞內的鐵穩態。Sankari等[30]發現在根瘤菌(Bardyrhizobium japonicum)中有一種膜蛋白MbfA,在高鐵條件下被表達,發揮著將金屬從細胞質中導出的功能。MbfA含有一個N端鐵蛋白樣結構域,能夠參與鐵的結合和輸出。同時在枯草芽孢桿菌(Bacillus subtilis)中發現了一種鐵轉運蛋白PfeT,它的失活抑制了菌體在高鐵環境下的生長。在鼠傷寒沙門氏菌(Salmonella typhimurium)中也有鐵輸出蛋白的報道,稱為檸檬酸亞鐵外排轉運蛋白(MdtD),在大腸桿菌(E. coli)中胎球蛋白A(FetA)和胎球蛋白B(FetB)的過度表達降低了細胞內鐵的水平,增強了對氧化損傷的抵抗力[31]。
4 鐵的儲存
鐵蛋白將大量的Fe2+氧化并儲存在其內部的現象被稱為鐵的生物礦化(mineralization),這種生物礦化機理導致了Fe2+在鐵蛋白中的氧化沉淀,但鐵的氧化沉淀在細胞內的具體反應途徑尚不清楚,主要包括生物礦化途徑(公式1、2)和去毒反應途徑(公式3),各反應途徑的選擇主要與細胞內Fe2+的濃度有關,在Fe2+高濃度的條件下,鐵的氧化沉淀可能主要以生物礦化途徑為主,但去毒反應途徑也同時存在[32-34]。
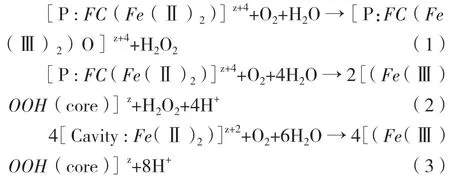
在細菌鐵蛋白的研究中證實細菌至少可以表達3種鐵蛋白。其中Dps更依賴于以H2O2作為氧化劑。但FTN和BFR在不同生物體內的作用似乎不同,如研究證實FTN是大腸桿菌最主要的鐵儲存鐵蛋白,而在沙門氏菌中最主要的鐵儲存鐵蛋白為BFR[35]。其次銅綠假單胞菌的BFR需要與鄰近基因Bfd編碼的鐵氧還蛋白的共同作用才能完成鐵在體外的快速還原與釋放[36]。
Andrews認為[37],當鐵進入細胞后,不會被細胞全部快速利用,部分鐵被儲存在鐵蛋白和鐵樣蛋白中。這部分鐵不參與正常的細胞代謝進程,以一種備用鐵庫的形式存在,當細胞可利用的外源鐵不足時進行鐵的補充,同時備用鐵庫儲存鐵的模式也對細胞具有重要的保護,降低了細胞由于鐵過量引起的氧化損傷。譚瀟等[38]利用基因工程技術克隆了鮑曼不動桿菌鐵蛋白(abferritin)基因,證實基因的表達產物能夠增強大腸桿菌抵抗氧化應激的能力。
但對于鐵在胞體內的存儲研究中,McHugh等[39]認為包被蛋白可能是原核生物中最大的鐵儲存細胞器,其直徑為24-32 nm,能夠積累多達30 000個鐵原子。這種包被蛋白已從嗜熱火球菌(Pyrococcus furiosus)和黃色黏液球菌(Myxococcus xanthus)中分離和結晶。這類蛋白結構與病毒形狀類似,包被物本身沒有鐵氧化酶活性,但可以由包被在空腔中的特殊運送蛋白EncFTN提供。EncFTN中有一個由4螺旋束組成的鐵蛋白樣折疊,各亞基組裝成一個盤狀結構,該結構中包含有5個鐵氧化酶活性位點,各位點與衣殼結構上的鐵蛋白孔并列,以產生一種能夠在空腔內吸引、氧化和礦化鐵的復合物。目前已在包被蛋白中觀察到多達14個鐵核,它們一起積累的鐵是典型鐵蛋白分子的10倍。同時包被蛋白還攜帶有其他與鐵無關的反應酶[40]。通過對包被蛋白的基因組分析發現,其基因組包含有FTN樣和Dps樣基因,但在包囊內發現含有可見的鐵沉淀物,因此包被蛋白與EncFTN在鐵穩態下的作用機理仍待進一步研究。
5 鐵蛋白的分子改造
鐵蛋白獨特的八面體空間結構已成為研究蛋白質結構及自組裝的重要模型,可以通過對鐵蛋白的各種氨基酸突變和改造來分析亞基各個區域或不同氨基酸殘基對鐵蛋白功能及自組裝的影響[41-43]。張瑜等[44]在大腸桿菌鐵蛋白亞基的N端增加了6個組氨酸殘基后,突變蛋白的二級結構并未發生明顯改變,但在結構上卻不能形成24聚體的殼狀結構,在溶液中也只能以二聚體的形式存在,其熱力學穩定性有一定的下降。因此他們認為,N端的延長可能導致鐵蛋白單體構型發生了改變,使殼狀結構的組裝無法正常進行。
其次鐵蛋白的外表面可用于連接具有特殊功能的配體,內表面可作為納米反應器用于納米復合材料的合成,亞基之間的接觸面則可用于指導鐵蛋白的解聚與重組、合成不同亞基比例的鐵蛋白及打破鐵蛋白的對稱性結構[45]。
同時,當鐵蛋白中各位點或位點鄰近氨基酸發生突變時,都會對蛋白原來的作用屬性產生很大影響。Liu等[46]采用易錯PCR的方法構建了大腸桿菌的FTN突變體庫,并將其導入已敲除鐵蛋白的野生菌株中發現,野生型細胞對外加磁場吸附活性有了明顯提高,而突變位點位于蛋白亞基的B-型通道內。進一步研究表明在B位點附近發生的突變使通道入口的極性氨基酸數量減少,提高了鐵離子的進入能力。
6 鐵蛋白的應用
6.1 籠狀結構是重要的納米材料載體
各種功能單元的微型化及其在納米技術中的應用是一個重要且被日益關注的研究領域,它結合了物理、化學、生物學和醫學等多種學科。實現這一應用目標的一種策略是使用籠狀結構(cage structure protein,CSP)配合物生產單分散納米顆粒(nanoparticles,NPs),其大小約為5-100 nm,通常形成一種類似于含鐵硫簇的鐵硫樣蛋白[47]。目前其應用主要涉及臨床微量血清鐵蛋白檢查、生物體的鐵營養補充及生物納米材料研發等方面[48]。
CSP制備鐵硫樣蛋白主要有兩個優點:一方面CSP生成的NPs的大小和形狀是明確的,具有窄的尺寸分布;另一方面CSP的外表面可以使用配體(如蛋白質、肽和藥物分子),增強了它們在生物納米技術和生物醫學應用中的潛力,能夠靶向載藥于腫瘤處進行成像和治療。其次在電子設備應用中,Dps因其固有的潛力而易于在表面組裝成2D晶體[49-50]。
6.2 復合體組裝的優良工具
FTN具有依賴于溶液酸堿度及鹽濃度的自組裝特性。研究發現當FTN處于pH<2或溶液NaCl濃度大于100 mmol/L的環境條件下時,鐵蛋白的籠狀結構被解離成單體,但在調節pH>7或將NaCl濃度降低后,解離的單體又自組裝形成球狀結構,可以在蛋白籠內產生不同大小的納米顆粒(圖5)。因此借助鐵蛋白的自組裝特性,可進行藥物或其他物質的目的性裝載,具有重要的應用價值[51]。Mazzucchelli等[52]利用鐵蛋白在低pH值下分解和在高pH值重新組裝的特性,成功制備了奧拉帕尼納米顆粒,經體外實驗驗證,奧拉帕尼納米藥物對癌細胞的生長有顯著的抑制效果,能使癌細胞存活率下降至60%。但研究也發現鐵蛋白在80℃、6 mol/L尿素或鹽酸胍或1%(W/V)十二烷基硫酸鈉下穩定[53]。
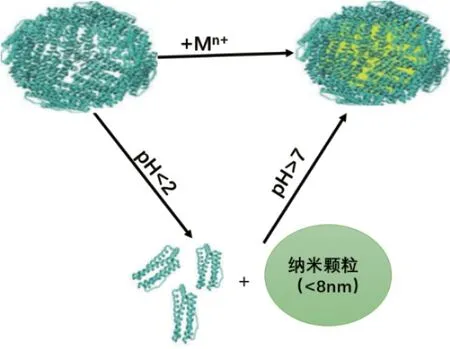
圖5 鐵蛋白內腔中納米粒子的合成Fig.5 Synthesis of nanoparticles inside the ferritin inner cavity[51]
同時根據鐵蛋白的自組裝特點,結合基因工程技術,已構建了具有不同功能的雜合鐵蛋白以及不同鐵蛋白間的結構轉化。Williams 等[54]發現鐵蛋白氨基酸序列中的細微取代會導致蛋白質之間的轉化,當12亞基的Dps的第47位苯丙氨酸突變為谷氨酸后,12亞基蛋白變為鐵蛋白樣24亞基聚合體。結果證明了相關蛋白亞家族之間會發生突變切換的新假說。
7 總結與展望
鐵蛋白作為生物體重要的鐵儲存與調控蛋白,在維持細胞鐵代謝平衡及保護細胞正常生理功能的體現中發揮著重要作用,同時FTN作為細胞天然形成的磁性納米顆粒,將在核磁成像及鐵蛋白分子改造中發揮其獨特優勢[55],因此了解鐵蛋白中鐵的調控與釋放、鐵的儲存機制,將進一步揭示鐵元素在生物體中的生理及生化功能。而圍繞鐵蛋白的籠狀結構構建納米載體,是未來納米藥物材料的研究方向之一,其獨特的籠狀結構是未來研究蛋白質結構及自組裝的重要工具。同時借助鐵蛋白的分子結構,采用生物修飾和化學修飾技術進行多種分子骨架的設計,能夠實現高精度的靶向操作和多功能化的開發與應用。
迄今為止,科學家獲得的微生物鐵蛋白晶體極其有限,圍繞蛋白晶體的制備與結構的分析,將有助于進一步探索結構與性質之間的關系,也為微生物鐵蛋白功能的挖掘創造條件。與此同時,融合現代分子生物學及生物信息學技術,采用多數據源分析微生物鐵蛋白與其他蛋白之間的相互作用,能夠更加深入地揭示在多途徑的代謝過程中鐵蛋白的代謝機制,從而為相關應用奠定基礎。

