核不均一核糖核蛋白AB的兩個剪切體在胰腺腫瘤中的表達差異分析
孫銘悅 雷珂 任琳琳 王佳 鞏芮寧 田字彬
1青島大學附屬醫院消化內科,青島 266042;2青島大學附屬醫院腫瘤免疫及細胞治療中心,青島 266042
【提要】 采用RT-PCR法檢測RNA結合蛋白核不均一核糖核蛋白(HNRNP)AB的兩個剪接體HNRNPAB1和HNRNPAB2在15株惡性腫瘤細胞系、1株正常胰腺導管上皮細胞系、4株胰腺癌細胞系及17例胰腺腫瘤組織中的表達。結果顯示胰腺癌細胞系以HNRNPAB2表達為主,而肝癌、結腸癌、胃癌、宮頸癌、視網膜惡性腫瘤、乳腺癌細胞系等腫瘤細胞系以HNRNPAB1表達為主。正常胰腺導管上皮細胞的HNRNPAB1與HNRNPAB2表達量顯著低于胰腺癌細胞系。HNRNPAB1與HNRNPAB2的表達量比值與胰腺癌惡性程度呈正相關。
剪接是將內含子從前體mRNA中移除,外顯子連接形成成熟mRNA的過程。可變剪切(alternative splicing,AS)又稱選擇性剪切,在前體mRNA到成熟RNA的過程中,不同的剪切方式使得同一個基因可以產生多個不同的成熟mRNA,最終產生不同的蛋白質。近年來研究[1-2]發現,AS事件在肺癌、膀胱癌和乳腺癌等癌癥中廣泛存在,且在急性髓系白血病、慢性淋巴細胞白血病和黑色素瘤中高度復發。剪接因子通常以濃度依賴的方式引起選擇性剪接的變化,并通過影響多種細胞過程的全基因組剪接改變促進致癌轉化。
核不均一核糖核蛋白(heterogeneous nuclear ribonucleo-protein, HNRNPs)是一個龐大的、結構多樣的RNA結合蛋白家族,在剪接、mRNA運輸和翻譯中具有不同的作用[3]。HNRNPAB作為家族成員之一,位于真核細胞的細胞核中,可協助前體mRNA的可變剪接[4],參與聚腺苷酸化[5]、mRNA穩定性的調控、核-胞質轉運和DNA復制與重組[6],還參與癌癥發生發展,促進腫瘤細胞的形成、侵襲、轉移,影響預后。HNRNPAB剪切體有兩種,兩種剪切體協同作用,才能促進中樞神經系統發育過程中神經細胞的正常遷移[7]。有研究報道[8],AS事件風險值可作為胰腺癌的獨立預后因子。本研究檢測HNRNPAB兩種剪切體在胰腺癌細胞系和腫瘤組織中的表達差異,探討其臨床意義,以期能為胰腺癌的診治提供新的分子標志物和治療靶點。
一、材料與方法
1.胰腺癌組織及細胞株:收集2019年4月至2020年2月間青島大學附屬醫院儲存在-80℃冰箱中的RNAlater(美國Sigma公司)中的17例胰腺腫瘤組織及肝轉移組織,其中良性腫瘤6例,分別為胰腺神經內分泌瘤2例,胰腺實性假乳頭狀瘤2例,微囊性腺瘤1、黏液性囊性腫瘤1例。惡性腫瘤11例,均為胰腺導管腺癌,其中6例無淋巴結及遠處轉移,定義為低度惡性;5例有淋巴結或遠處轉移,定義為高度惡性。記錄患者年齡、性別、腫瘤大小、病理分級、臨床分期、是否淋巴結轉移及遠處轉移等。
共選擇20株細胞系。人正常胰腺導管上皮細胞系HPDE6-C7及胰腺癌細胞系ASPC1、BXPC-3、PANC1、MIA PaCa-2均購自武漢普諾賽生命科技有限公司;肝癌細胞系HccL-M3、HepG2、Hep3β、HuH7、PLC,結腸癌細胞系HT-29、SW480,胃癌細胞系AGS、BCG832,宮頸癌細胞系Hela、Siha、C33A,視網膜母細胞瘤細胞系Y79、OCM-1,乳腺癌細胞系HCC1937均為青島大學附屬醫院醫學研究中心惠贈。所有細胞株均常規復蘇、培養、傳代。
2.RT-PCR擴增HNRNPAB剪切體:采用Trizol(美國Invitrogen公司)分別抽提20株對數生長期細胞及17例胰腺腫瘤組織總RNA,使用Biospec Nano核酸分析儀(Shimadzu Spectrophotometer)檢測樣本RNA純度和濃度。采用PrimeScriptRT reagent Kit gDNA Eraser試劑盒(日本TaKaRa公司)將總RNA逆轉錄為cDNA,按說明書操作。利用NCBI網站設計能同時擴增HNRNPAB剪切體1和2的特異性引物,正向引物序列為5′-GGCTACGGCAACTACTGGAA-3′,反向引物序列為5′-GCATGTGTGCGATCAGTTGG-3′。引物由北京六合華大基因科技有限公司青島分公司合成。應用Phanta Master Mix(南京Vazyme公司)行PCR擴增,反應條件:95℃ 3 min,95℃ 10 s、60℃ 30 s、72℃ 30 s,35個循環。PCR產物用1.2%瓊脂糖凝膠電泳分離,通過ImageJ圖像分析軟件行灰度掃描,以條帶灰度值代表其表達量。每個樣本設3個復孔,取均值。
3.測序:將擴增的PCR產物送北京六合華大基因科技有限公司青島分公司測序,測序結果與原始序列進行對比,確定PCR擴增片段是否為目標剪切體序列。

二、結果
1.HNRNPAB兩種剪切體的測序鑒定:胰腺腫瘤組織及細胞RNA均擴增出2條片段,分子質量分別為352、211 bp,條帶大小與預期產物片段大小相一致。分離、純化凝膠電泳中所見的2條帶的PCR產物,測序結果證實其核苷酸序列與NCBI數據庫中HNRNPAB基因2種剪切體序列信息完全一致。HNRNPAB1的產物為352 bp,HNRNPAB2的產物為211 bp。
2.各細胞系HNRNPAB兩種剪切體的表達:1株人正常胰腺導管上皮細胞系HPDE6-C7、4株胰腺癌細胞系ASPC1、BXPC-3、PANC1、MIA PaCa-2細胞HNRNPAB兩種剪切體表達的灰度值及HNRNPAB1/HNRNPAB2灰度值比(AB1/AB2值)見表1。4株胰腺癌細胞系的HNRNPAB1表達量均顯著低于HNRNPAB2,均以HNRNPAB2表達為主。HNRNPAB1平均灰度值為6286.06,HNRNPAB2為9446.60,平均AB1/AB2值為0.67,均顯著高于HPDE6-C7細胞的1 457±178、2 719±176、0.54,差異有統計學意義(P值均<0.001),提示胰腺癌細胞株HNRNPAB均高表達,且以HNRNPAB2表達為主。
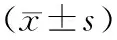
表1 胰腺細胞株HNRNPAB剪切體灰度值
肝癌、腸癌、胃癌、乳腺癌、宮頸癌、視網膜母細胞瘤共15株細胞系HNRNPAB1的表達量均顯著高于HNRNPAB2(表2),均以HNRNPAB1表達為主,HNRNPAB1平均灰度值為10011.00,HNRNPAB2為5839.37,平均AB1/AB2值為1.79。其他惡性腫瘤細胞株的平均AB1/AB2值顯著高于胰腺癌細胞株的平均AB1/AB2值,差異有統計學意義(1.79比0.67,t=6.13,P<0.010)。
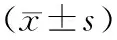
表2 15株其他惡性腫瘤細胞系HNRNPAB剪切體灰度值
3.胰腺腫瘤組織HNRNPAB兩種剪切體的表達:17例胰腺腫瘤組織HNRNPAB1、HNRNPAB2剪切體電泳圖見圖1。6例胰腺良性腫瘤均以HNRNPAB2表達為主,HNRNPAB1平均灰度值為2 981,HNRNPAB2為6 137,平均AB1/AB2值為0.35(表3)。6例為低度惡性胰腺癌中,HNRNPAB2的灰度值均顯著高于HNRNPAB1,以HNRNPAB2表達為主。HNRNPAB1平均灰度值為2 412,HNRNPAB2為5 575,平均AB1/AB2值為0.41(表4)。5例高度惡性胰腺癌組織中,3例HNRNPAB2的灰度值略高于HNRNPAB1,差異無統計學意義,以HNRNPAB2表達為主;1例導管腺癌伴腹腔轉移灶組織及1例神經內分泌癌伴肝轉移組織HNRNPAB2灰度值低于HNRNPAB1(P值分別為0.001、0.432,表4)。HNRNPAB1平均灰度值為9 444,HNRNPAB2為9 535,平均AB1/AB2值為1.10。高度惡性腫瘤的AB1/AB2顯著高于低度惡性腫瘤及良性腫瘤,差異均有統計學意義(t值分別為3.05、2.95,P值分別為0.013、0.016),而低度惡性腫瘤與良性腫瘤的差異無統計學意義。
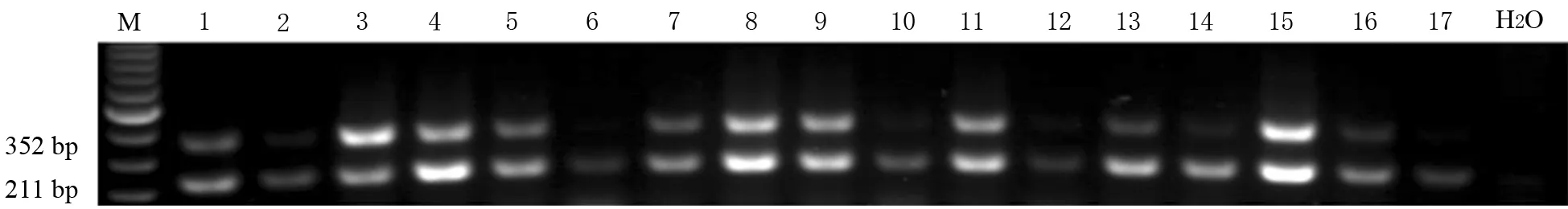
注:1、2、3、5、7、8、9、10、12、13、15為胰腺癌;4、6為胰腺神經內分泌瘤;11為微囊性腺瘤;14、16為胰腺實性假乳頭狀瘤;17為黏液性囊性瘤圖1 17例胰腺腫瘤組織HNRNPAB1、HNRNPAB2剪切體電泳圖
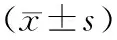
表3 6例胰腺良性腫瘤組織HNRNPAB剪切體灰度值
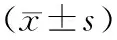
表4 11例胰腺癌組織HNRNPAB剪切體灰度值
4.胰腺癌組織HNRNPAB兩種剪切體表達量比值與腫瘤臨床病理參數的相關性:以11例胰腺癌組織AB1/AB2中位數為界,將其分為AB1/AB2<0.7組和≥0.7組,結果顯示,兩組的差異與臨床分期顯著相關,而與患者年齡、性別、腫瘤病理分級、T分期、淋巴結轉移均無相關性(表5)。
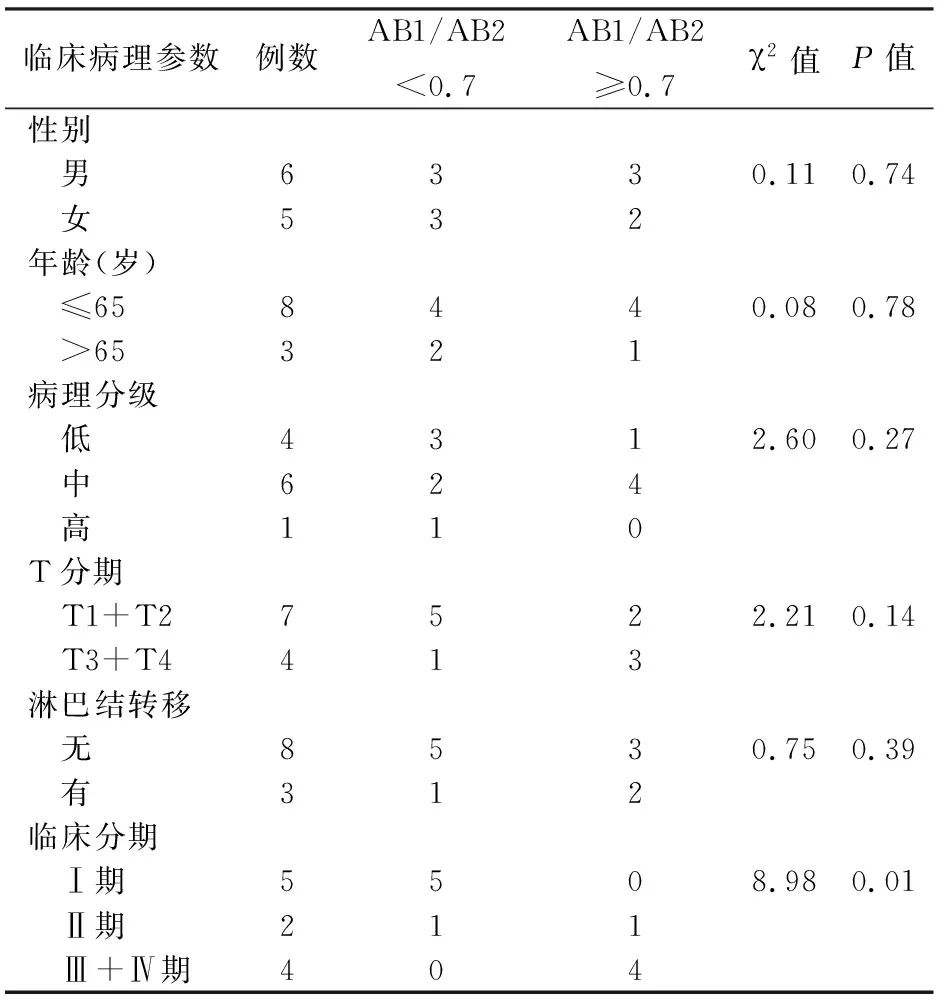
表5 胰腺癌組織HNRNPAB兩種剪切體灰度值比與腫瘤臨床病理參數的相關性
討論HNRNPAB蛋白結構上含有兩個串聯的RNA結合域(RNA Binding Domain,RBD)以及保守的N端和C端的結構域,C末端的結構域富含甘氨酸,一般稱為輔助結構域,負責與其他HNRNPs相互作用[9-10]。RNA結合的特異性主要是由蛋白質的3D結構介導,RBD周圍的結構區域微調RNA與蛋白質的相互作用[11]。HNRNPAB1含有8個外顯子,編碼322個氨基酸的蛋白質,分子量約為36 000;HNRNPAB2的輔助結構域缺少1個約140 bp外顯子,編碼285個氨基酸的蛋白質,分子量約為30 000。輔助結構域的不同,可能影響其功能。
文獻報道,肝癌[12]、前列腺癌[13]、纖維母細胞瘤[14]組織HNRNPAB總量呈高表達。肝癌組織HNRNPAB可通過上皮間充質轉換(epithelial-mesenchymal transition, EMT)促進腫瘤細胞侵襲轉移[12];HNRNPAB可激活與前列腺癌進展相關的細胞周期基因子集,從而促進腫瘤生長和轉移[13];腫瘤纖維母細胞組織HNRNPAB作為一種TGF-β誘導因子可導致腫瘤形成及惡化[14];乳腺癌HNRNPAB表達參與細胞周期調控,特別是G2/M期的轉變影響預后[15]。上述研究表明HNRNPAB在腫瘤的發生中可能是一種促癌因素,但這些研究主要關注的是HNRNPAB的功能,而沒有涉及到HNRNPAB兩個剪切體。
本研究結果顯示,4株胰腺癌細胞株HNRNPAB1及HNRNPAB2表達均顯著高于正常胰腺導管上皮細胞系,且以HNRNPAB2表達為主,提示胰腺惡性細胞株HNRNPAB高表達,尤其是HNRNPAB2表達量更高。但其他組織來源的腫瘤細胞系絕大多數HNRNPAB高表達,以HNRNPAB1表達為主。其原因可能是HNRNPAB兩種剪切體的主要功能域雖然相同,但輔助結構域不同,后者負責與其他HNRNPs進行相互作用[9-10],提示HNRNPAB兩種剪切體可能與不同HNRNPs結合而發揮不同的功能,形成不同的功能模塊及蛋白網絡。因此在胰腺組織中的RNA結合蛋白HNRNPAB,可能以HNRNPAB2剪切體的蛋白作用網絡為主,通過其mRNA選擇性剪切以及蛋白互相作用的功能,在胰腺發育過程中發揮重要作用。
本研究結果還顯示,胰腺癌組織HNRNPAB兩個剪切體表達量升高,絕大多數以HNRNPAB2表達為主。高度惡性腫瘤的AB1/AB2值顯著高于低度惡性腫瘤及良性腫瘤,差異均有統計學意義,而低度惡性腫瘤與良性腫瘤的差異無統計學意義。胰腺癌肝轉移組織及腹腔轉移灶組織主要表達HNRNPAB1,提示隨著胰腺癌惡性程度的增高,HNRNPAB1的表達水平迅速增高,甚至超越HNRNPAB2。有淋巴結轉移或遠處轉移的胰腺癌AB1/AB2≥0.7與腫瘤臨床Ⅲ+Ⅳ分期呈正相關也支持HNRNPAB1高表達促進腫瘤的遷移和侵襲這一結論。
本研究尚存在一些缺陷:其一,缺少對其他腫瘤細胞株相應的正常細胞株的檢測;其二,沒有匹配胰腺癌旁正常胰腺組織檢測;其三,病例數少,故需更多的嚴謹的研究設計和更多的臨床樣本進行驗證。
利益沖突所有作者聲明無利益沖突

