水稻新型育種技術研究現狀與展望
馬小倩, 楊濤, 張全, 張洪亮*
(1.河南科技大學農學院,河南 洛陽 471023;2.中國農業大學農學院,北京 10019)
遺傳、變異和選擇是作物育種的3個核心:遺傳是育種的本質,變異是育種的基礎,而選擇則是育種的關鍵。育種即是通過解析性狀的調控基因,研究基因間的互作關系,并進一步將不同品種中的優良基因進行聚合,從而選育綜合性狀優異的新品種[1]。
遺傳學及生物技術的迅猛發展使作物育種的方法和技術也不斷得到改良和提高,從傳統的雜交育種到誘變育種、分子標記輔助育種以及轉基因育種等[2]。近年來,隨著分子生物學、基因組學以及生物信息學等學科的飛速發展,逐步發展出一些新的育種方法,如基因編輯育種、分子設計育種等[3]。水稻是重要的糧食作物之一,2002年水稻基因組測序初步完成,大量的基因組數據和高密度的分子標記遺傳圖譜為水稻新技術育種奠定了良好的基礎。本文著重總結了幾種新型育種技術在水稻中的應用,并對其發展前景進行了展望,以期為水稻種業發展奠定基礎。
1 分子標記育種
分子標記是指以核苷酸序列變異為基礎的遺傳標記,其能夠直接反映個體基因組DNA的差異。經典的分子標記主要包括RFLP(restriction fragment length polymorphism)、CAPS(cleaved amplified polymorphic sequence)、SSR (simple sequence repeat)、STS (sequence-tagged sites)、RAPD(random amplified polymorphic DNA)、AFLP(amplified fragments length polymorphism)、SNP(single nucleotide polymorphisms)和 InDel(insert and deletion)等[4]。近年來,單倍型也發展成為一種新型的分子標記,單倍型為來自同一基因區段或單個染色體上多個標記的組合或是來自不同染色體上控制同一目標性狀的標記組合[5]。Huang等[6]利用517份水稻品種大約360萬SNPs數據,構建了單倍型圖譜。
利用分子標記育種技術,水稻的產量、品質及生物和非生物脅迫抗性等方面得到了改良。國家雜交水稻工程技術研究中心以馬來西亞普通野生稻為供體親本、以93-11為受體親本進行雜交和回交,通過分子標記輔助選擇技術育成了攜帶野生稻增產QTLyld1.1和yld2.1的新品系R163;然后利用R163與光溫敏不育系Y58S育成優質、高產、廣適雜交稻新組合Y兩優7號[7]。品質方面,周屹峰等[8]以優質保持系宜香1B和協青早B為親本,以特異性分子標記對直鏈淀粉含量進行間接篩選,選育出不育系浙農3A,其稻米品質得到了極大的改良;王巖等[9]基于控制稻米糊化溫度的alk基因和控制香味的fgr基因編碼區,開發InDel標記用于輔助選擇育種,經回交聚合將alk和fgr片段導入明恢63,使稻米的外觀品質和蒸煮食味品質得到了顯著改善;劉巧泉等[10]通過向特青中導入Wx基因,選育出仍保持原有親本主要農藝性狀的3個優質品系,改良品系的直鏈淀粉含量顯著降低,蒸煮食味品質顯著提高。抗病蟲方面,Liu等[11]利用與Pi1連鎖的分子標記對珍汕97B進行稻瘟病抗性改良,共得到17個含有抗性基因Pi1的改良珍汕97B株系;楊子賢等[12]利用分子標記輔助選擇將Xa21基因和Bt基因同時導入93-11,使93-11對白葉枯病和螟蟲的抗性明顯提高;陳學偉等[13]利用分子標記選擇將抗病基因Pi-d(t)1、Pi-b和Pi-ta2聚合到優良保持系材料岡46B中,大大提高了水稻抗病育種的效率;倪大虎等[14]通過分子標記輔助選擇和抗性鑒定,將抗白葉枯病基因Xa21和稻瘟病抗性基因Pi9(t)聚合到同一品系,獲得同時抗稻瘟病和白葉枯病的穩定純合株系;官華忠等[15]通過分子標記輔助選擇將抗稻瘟病基因Pi-9導入金山B-1,選育出5個稻瘟病抗性顯著高于金山B-1的近等基因系;董巍等[16]將稻瘟病抗性基因Pi-1、Pi-2從供體中回交聚合到培矮64S中,改良株系對稻瘟病抗性明顯增強;陳英之等[17]將來源于普通野生稻的5個抗稻飛虱(brown plant-hopper,BPH)基因通過雜交、回交和分子標記輔助選擇導入雜交水稻親本中,其苗期和成株期都表現出對BPH的高抗性。通過分子標記選擇育種,廣東省農業科學院選育出了一批優良的不育系和恢復系品種,如吉豐A、廣泰A、廣恢508、廣恢501等[18]。
分子標記育種對水稻產量、品質和抗性育種具有重要意義,而QTL(quantitive trait locus)的精確定位是分子標記育種的基礎。目前,精細定位并成功用于實際育種中的QTL大部分是主效QTL,許多微效QTL則較少被利用。此外,標記性狀多集中于質量性狀,數量性狀發展相對滯后。大量遺傳信息處于零散狀態以及育種群體較難達到精細定位作圖群體標準等問題制約著分子標記育種的發展。未來,隨著生物技術的不斷進步,分子標記育種與基因編輯和轉基因技術相結合,將更加精準、高效地促進水稻的育種進程。
2 轉基因育種
轉基因育種技術是利用植物基因工程技術將作物高產、優質和抗逆等相關基因導入受體作物中以培育出具有特定優良性狀的新品種。由于優異基因可來源于任意物種,因此,轉基因育種可以打破種間隔離,解決物種間遠緣雜交不親和問題[19]。我國的轉基因育種始于20世紀80年代,“863”計劃項目實施之后,轉基因育種研究發展迅猛。目前,水稻轉基因育種使用的轉基因方法主要包括:農桿菌介導法、基因槍法、PEG介導法、電擊導入法和花粉管通道法,其中農桿菌介導法占主要地位。
目前,水稻應用轉基因育種改良的性狀主要集中于抗蟲、抗病、品質改良等。應用于水稻抗蟲性改良的外源基因主要有蘇云金桿殺蟲結晶蛋白基因(Bt)、昆蟲蛋白酶抑制劑(基因PI)和植物凝集素基因、營養殺蟲蛋白基因、淀粉酶抑制劑基因、昆蟲毒素基因、幾丁質酶基因等[20]。其中,Bt基因是目前應用最為廣泛和成功的抗蟲基因。1995年,華中農業大學開始研發無標記抗蟲轉基因水稻,利用基因槍法將人工合成的Bt殺蟲基因(cry1Ab/cry1Ac)轉入明恢63,培育出抗蟲轉基因水稻華恢1號;繼而以華恢1號為父本、珍汕97A為母本選育出雜交種Bt汕優63,華恢1號和Bt汕優63均表現出較強的抗蟲性。應用于水稻抗病性改良的基因主要包括抗病毒基因、抗真菌病毒基因和抗細菌病毒基因3類。幾丁質酶是目前研究和應用最為廣泛的一種病程相關蛋白,過量表達病程相關蛋白是抗真菌病害常用的策略。馮道榮等[21]將水稻堿性幾丁質酶基因RC24、RCH10和酸性幾丁質酶基因RAC22、β-1轉入秈稻品種七絲軟占,獲得抗稻瘟病和紋枯病的轉基因株系。白葉枯病是影響水稻產量最嚴重的細菌性病害之一,國家水稻數據中心統計,截止到2021年5月已經鑒定了134個抗白葉枯病基因。翟文學等[22]利用農桿菌介導法將Xa21基因轉入5個水稻主栽品種,獲得了具有白葉枯病抗性的水稻株系。
我國轉基因水稻育種雖取得一定進展,但多數仍處于實驗室研究階段,離生產實踐還有很大距離。將轉基因技術應用于作物育種,仍需與常規育種相結合。隨著轉基因技術的發展,多基因聚合是轉基因育種發展的必然趨勢。雖然轉基因育種已經在棉花和大豆等作物上實現商品化,但人們對轉基因作物的安全性依然存在較多顧慮,阻礙了轉基因水稻商品化的發展[23-24]。因此,需要建立科學、合理、公正的安全性評價體系,對轉基因水稻進行正確的安全性評價,消除人們對轉基因作物安全性的憂慮,推動作物轉基因育種的發展。
3 基因編輯育種
基因編輯技術是利用工程核酸酶誘導基因組產生DNA雙鏈斷裂,激活細胞內源修復機制,實現對基因組的精確修飾,如插入、缺失或替換等[25]。基因編輯系統主要有鋅指核酸酶(zinc finger nuclease,ZFN)系統、類轉錄激活因子效應物核酸酶(transcriptional activator-like effector nuclease,TALENs)系統和規律成簇的間隔短回文重復序列(clustered regularly interspaced short palindromic repeats,CRISPR)系統[26],3種編輯系統的比較詳見表1。與前兩種編輯系統相比,CRISPR/Cas9系統具有操作簡單、效率高和成本低等優點[27]。
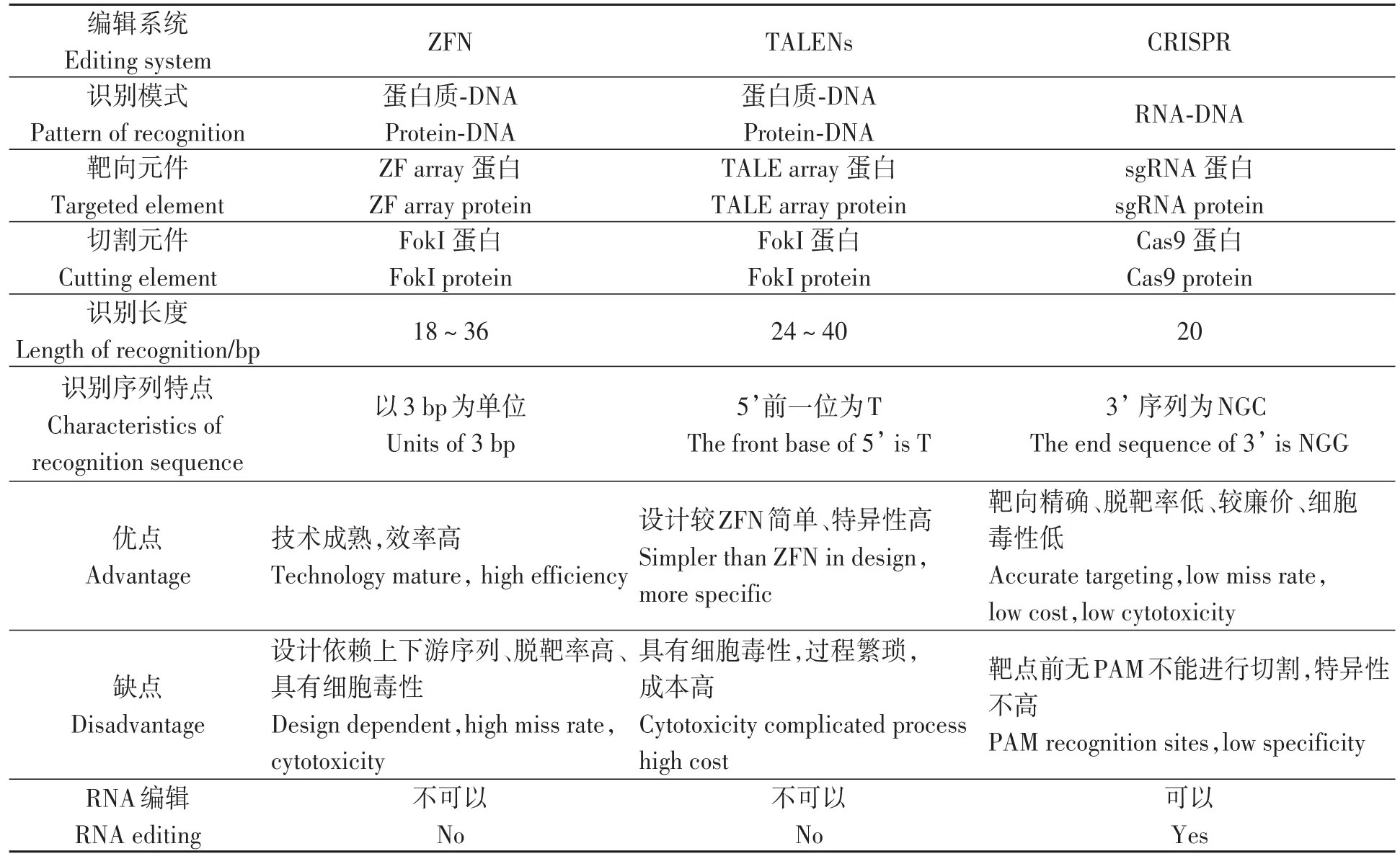
表1 三種基因編輯系統的比較Table 1 Comparison of three gene-editing techniques
目前已有不少關于CRISPR/Cas9系統在水稻育種應用中的研究[28-29]。目前,水稻利用基因編輯育種主要應用于抗逆性、品質、產量以及抽穗期等方面(表2)。抗性方面,徐鵬等[30]利用CRISPR/Cas9系統對Pita、Pi21和ERF922基因同時進行編輯,對獲得的三突變純合株系表型鑒定發現,突變株系較野生型稻瘟病抗性顯著提高;Li等[31]利用CRISPR/Cas9系統對稻瘟病廣譜抗性基因bsr-d1進行編輯以抑制該基因的表達,突變體植株稻瘟病抗性得到顯著提高;Sun等[35]將ALS基因進行基因編輯得到具有除草劑抗性的突變體植株。品質方面,Li等[36]和范美英等[37]利用CRISPR/Cas9 系統對Wx基因進行編輯,突變體籽粒直鏈淀粉含量發生變化,但對產量無顯著影響;邵高能等[38]利用CRISPR/Cas9系統對中花11的香味基因Badh2進行編輯,突變體籽粒中香味物質含量顯著增加,且不影響稻米的蒸煮食味品質;祁永斌等[39]對水稻品種嘉58和秀水134的香味基因Badh2進行編輯,突變體籽粒中2-AP含量極顯著地高于野生型,其香味性狀得到明顯改良。高產方面,Shen等[41]利用CRISPR/Cas9系統對5個粳稻品種的GS3和GN1a基因同時進行編輯,發現5個背景下gs3和gs3gn1a純合突變體的籽粒長度均顯著增加,且gs3gn1a比gs3純合突變體具有更多的穗粒數;Li等[42]對穗粒數基因GN1a、穗型基因DEP1、粒型基因GS3和株型基因IPA1進行編輯,發現T2代gn1a、dep1、gs3突變體分別出現穗粒數增多、直密穗和大粒的表型,在dep1和gs3突變體中還觀察到半矮桿和長芒表型,而ipa1突變體表現出分蘗增多和分蘗減少兩種表型。抽穗期方面,Li等[51]設計雙元載體pYLCRISPR/Cas9Pubi-H,對7個水稻品種中抽穗期調控基因Hd2、Hd4和Hd5進行編輯,發現3個基因同時突變的純合株系抽穗期與野生型相比均有不同程度的提前;進一步研究表明,Hd2、Hd4、Hd5、Dth2和Hd18為主要的開花促進因子[45]。
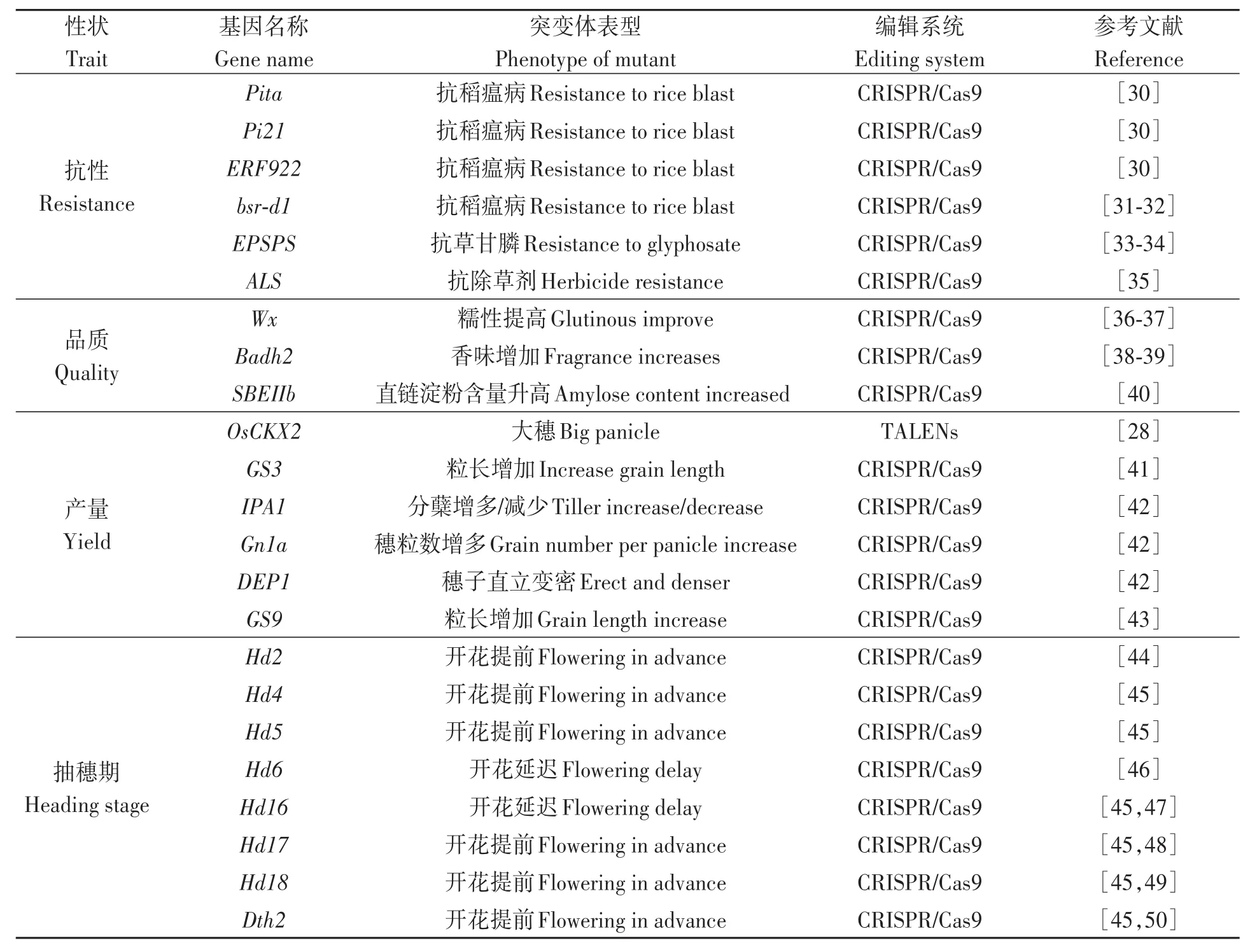
表2 水稻利用基因編輯育種涉及的部分基因Table 2 Related genes in rice breeding using gene editing
目前,CRISPR/Cas9已發展為主流的基因編輯系統。基因編輯是通過定向敲除目標靶基因,造成基因功能缺失從而實現對目標性狀的改良。作物育種過程中,育種家往往通過聚合一些優良基因或者定點替換某些基因使得產量、品質和抗性等得到提高,高效精準的基因編輯系統極大地促進了基因編輯育種在作物改良中的應用,對未來水稻育種具有重要意義[52]。
4 分子設計育種
隨著分子生物學和測序技術的發展,大量目標性狀基因被克隆[53]、基因間互作網絡被解析,使得分子設計育種成為可能。科學家可以在實驗室內提前模擬、篩選和優化品種選育過程,實現從傳統“經驗”育種到設計“精準”育種的轉變,極大地提高育種效率[54]。萬建民[54]和Wang等[55]提出分子設計育種,主要包括以下流程:①明確調控育種目標性狀的基因或QTL;②根據基因的位置、遺傳效應、基因間以及基因與環境間的互作等信息,模擬和預測可能出現的各種基因型組合形成的表現型,從中選擇符合預期表現型的基因型組合;③對選出的目標基因型組合進行育種途徑分析,制定合適的育種方案;④根據育種方案進行實踐育種。綜上所述,分子設計育種是將分子標記育種、轉基因育種和傳統育種相結合的一種新型育種模式[56-58]。Tian等[59]對水稻食味及蒸煮品質相關基因及其調控網絡進行了研究,之后李家洋院士團隊又經過8年努力將控制產量、品質、外觀等多個優異基因聚合,成功培育出比LYP9高產、優質的水稻品種,該品種的成功培育對分子設計育種具有重要的指導意義[60]。
5 展望
近年來,在可利用耕地面積逐年減少和嚴峻的環境條件下,確保不斷增長人口的糧食安全仍將是一個巨大的挑戰。為了迎接這個挑戰,水稻育種需要對大量基因資源進行集中整合,結合作物高通量表型和生物技術方法(如分子標記輔助選擇、基因組選擇和基因編輯)等對水稻生長進行剖析。針對新時期水稻產業發展戰略需求,強化水稻育種的基礎研究,綜合全基因組選擇、基因編輯、誘變育種、雜交育種等育種技術,以基因敲除、單堿基編輯等基因編輯手段,創新和優化水稻基因編輯技術;完善多性狀基因聚合的轉基因技術;通過生物技術、基因組測序技術等,以全基因組選擇為主線,完善水稻分子設計育種技術,推動水稻育種逐漸向高效、精準、定向的方向轉變,加速水稻超級新品種的培育進程。

