重組大腸桿菌全細胞催化合成β-煙酰胺單核苷酸
傅傳杰,全浩龍,楊 敏,黃建忠
(福建師范大學生命科學學院/工業微生物發酵技術國家地方聯合工程研究中心,福建 福州 350108)
煙酰胺單核苷酸(Nicotinamide mononucleotide,NMN)是一種自然存在的生物核苷酸,分子式:C11H15N2O8P,分子量:334.2,分為α和β兩種結構形式。其中β-NMN(NMN)是煙酰胺單核苷酸的活性形式,天然存在于人體及果蔬肉類當中,參與多種生理生化反應[1-4],有助于恢復母豬等畜牧哺乳動物的卵巢活力、改善卵母細胞功能[5-7],在肺炎、潰瘍性結腸炎、調節腸道菌群[8-11]等疾病的治療中作用顯著。我國是畜牧養殖大國,隨著畜牧養殖業集約化程度越來越高,國家對動物疫病防控越來越重視。2020年7月國家頒布的“禁抗令”無疑是對養殖業的一大挑戰,會增加畜禽的發病率以及養殖和醫療成本,預防和治療用藥的需求也日益增多[12],獸藥市場總體呈上升趨勢,預計2022年全球獸藥市場規模將達5 372億元[13]。因此NMN有極大的潛力作為飼料添加劑應用于畜牧養殖產業[14],有助于畜牧產品的食品安全建設。
當前NMN的合成主要分為化學合成法、微生物發酵法以及生物酶法。化學合成法生產過程中使用大量有機溶劑,產物中含有無活性α-NMN,純化難且環境污染嚴重[15-16],因此該方法已逐漸被淘汰。微生物發酵法是在細胞內煙酰胺磷酸核糖轉移酶(Nampt)的作用下,將自身生長積累合成的磷酸核糖焦磷酸(PRPP)與培養基外加的煙酰胺(NAM)催化生成NMN。Huang等[17]通過在大腸桿菌中異源表達弧菌噬菌體KVP40(VpNadV)的煙酰胺磷酸核糖轉移酶(Nampt),以煙酰胺為底物發酵25 h后NMN產量達到16.2 g·L-1,為目前報道的最高產量。發酵法解決了化學合成法中NMN手性問題,但存在發酵液組分復雜,分離純化困難、成本高的問題[18-19]。生物酶法轉化既有效解決化學合成法同分異構體以及存在致癌物殘留風險的缺點,也能解決微生物發酵法周期長、純化難和成本高的問題,但生物酶轉化過程中需要等摩爾比ATP提供磷酸,成本高,且反應過程中有大量副產物ADP/AMP生成,不利于后期純化。因此在多種NRK中篩選表達出一個性能穩定轉化效率高的的酶[20-21],同時降低ATP用量,簡化純化工藝至關重要。為滿足未來NMN在藥物制備中的應用,本試驗通過對4株不同來源的NRK菌株進行篩選,同時在酶轉化系統中引入PPK酶構建ATP循環系統,以期提高底物的轉化效率,降低ATP的用量以及減少副產物的生成,利于降低生產成本和純化難度。
1 材料與方法
1.1 材料和試劑
1.1.1菌株和質粒 本試驗中用到的表達宿主EscherichiacoliBW25113、表達載體pBAD,均保藏于福建師范大學工業微生物教育部工程研究中心。
1.1.2酶和試劑 高保真PCR酶購自南京諾維贊生物科技有限公司;Gibson酶購自NEB(北京)有限公司;瓊脂糖、凝膠DNA回收試劑盒均購自上海捷瑞生物工程有限公司;鏈霉素購自生工生物工程(上海)股份有限公司;酵母提取物和胰蛋白胨,英國Oxoid公司。所有試劑均為分析純。
1.1.3培養基 LB培養基(液體):酵母浸提粉5 g·L-1、蛋白胨10 g·L-1、氯化鈉10 g·L-1,固體培養基另外添加20 g·L-1的瓊脂糖。
ZY培養基(液體):酵母浸提粉5 g·L-1、蛋白胨10 g·L-1、50×M 20 mL·L-1、50×5052 20 mL·L-1、1 moL·L-1硫酸鎂2 mL·L-1、1000×微量元素2 mL·L-1、1000×鏈霉素1 mL·L-1、20%阿拉伯糖10 mL·L-1。50×5052:25%甘油、2.50%葡萄糖。50×M:1.25 moL·L-1磷酸二氫鈉、1.25 moL·L-1磷酸二氫鉀、2.5 moL·L-1氯化銨、0.25 moL·L-1硫酸鈉。1000×微量元素:50 mmol·L-1氯化高鐵、20 mmol·L-1氯化鈣、10 mmol·L-1氯化錳、10 mmol·L-1硫酸鋅、20 mmol·L-1氯化鈷、2 mmol·L-1氯化銅、2 mmol·L-1氯化鎳、2 mmol·L-1鉬酸鈉、2 mmol·L-1硼酸。
1.2 試驗方法
1.2.1重組菌的構建 將NCBI數據庫中篩選出的4個Nrk基因和2個Ppk基因,分別命名為NRK-Kk、NRK-Ec、NRK-Gs、NRK-Hi、PPK-Bb、PPK-Cb,送由生工生物工程(上海)有限公司合成。通過Gibson酶將合成的目的基因與質粒連接構建6個重組質粒,通過CaCl2法轉入表達宿主菌BW25113感受態細胞中,獲得重組大腸桿菌pBAD-NRK-Kk/BW、pBAD-NRK-Ec/BW、pBAD-NRK-Hi/BW、pBAD-NRK-Gs/BW、pBAD-PPK-Bb/BW、pBAD-PPK-Cb/BW(簡稱NRK-Kk/BW、NRK-Ec/BW、NRK-Hi/BW、NRK-Gs/BW、PPK-Bb/BW、PPK-Cb/BW)。將重組菌株于37℃含鏈霉素(50 μg·L-1)抗性的LB培養基中培養1 h,再涂布于含鏈霉素的平板中培養12 h。經菌落PCR鑒定后篩選陽性轉化子轉至含鏈霉素的LB培養基中進行6~8 h的培養,將菌液送往尚亞生物技術有限公司進行測序,驗證重組菌株是否發生移碼突變。
1.2.2重組菌的培養與誘導 將-80℃的重組菌轉接至含鏈霉素的平板劃線活化,挑取單菌落接入含有鏈霉素的10 mL LB液體培養基中,37℃恒溫搖床220 r·min-1過夜培養后按5%接種量接種至100 mL的ZYM自誘導培養基中,在30℃恒溫搖床中220 r·min-1誘導18 h。取出菌液8 000 r·min-1離心10 min,棄上清收取菌體。
1.2.3NRK工程菌篩選 取1.2.2的誘導表達的菌液用Tris-HCl(pH 7.0、50 mmol·L-1)重懸菌體沉淀,冰浴超聲破碎獲得破碎菌液,即為粗酶液,進行SDS-PAGE分析及轉化能力測定。催化反應體系(20 mL)為:50 mmol·L-1NR、50 mmol·L-1ATP、NRK(OD600nm=10);反應條件:37℃、pH 7.0、150 r·min-1恒溫攪拌轉化1 h。樣品沸水浴1 min終止反應后8 000 r·min-1離心2 min取上清,稀釋50倍后檢測。使用HPLC法檢測NMN生成量,采用C18柱(Agilent 5μm,4.6 mm×250 mm),流速為1 mL·min-1,檢測波長370 nm,柱溫35℃。流動相為磷酸氫二鉀和磷酸二氫鉀各10 mmol·L-1。根據在單位時間內,NMN催化生成量進行菌株篩選。
1.2.4NRK工程菌轉化體系優化 在NRK重組菌在pH7.0條件下,對溫度梯度為31、33、35、37、39℃的轉化體系測定轉化率,分析確定工程菌催化反應的最適溫度。在最適溫度條件下,對pH梯度為5.5、6.0、6.5、7.0、7.5的轉化體系測定轉化率,分析確定工程菌催化反應的最適pH,檢測方法及體系同方法1.2.3。
1.2.5PPK工程菌篩選 對PPK工程菌同出發NRK工程菌復配進行篩選,反應體系(20 mL)為:50 mmol·L-1NR、10 mmol·L-1ATP、10 mmol·L-1六偏磷酸鈉、NRK(OD600nm=10)、PPK (OD600nm=10),反應條件:37℃、pH 5.5、150 r·min-1恒溫攪拌轉化1 h。檢測方法同方法1.2.2。
1.2.6雙酶法轉化條件優化 對工程菌復配體系進行析因設計,反應體系(20 mL)如下:50~100 mmol·L-1NR、5~20 mmol·L-1ATP、10 mmol·L-1六偏磷酸鈉、NRK濃度(OD600nm:5~20)、PPK濃度(OD600nm:5~20),反應條件:37℃、pH 5.5、150 r·min-1恒溫攪拌轉化1 h。檢測方法同方法1.2.2。
1.2.7發酵罐培養及全細胞轉化生產NMN 依據優化的結果,按照方法1.2.1構建了1株NRK-Gs & PPK-Cb/BW工程菌,將重組菌按照1.2.3方法活化后轉接至100 mL液體培養基中,培養6~8 h后接種至裝無機鹽培養基的5 L發酵罐中培養,待菌體濃度OD600nm達到40~50時,添加終濃度為2 g·L-1阿拉伯糖,28℃誘導培養10~12 h,發酵液用8 000 r·min-1離心15 min,棄上清,收集菌體,進行全細胞轉化。
2 結果與分析
2.1 NRK工程菌的表達與篩選
由圖1可知,對4種重組菌經SDS-PAGE凝膠分析,NRK-Kk/BW、NRK-Hi/BW和NRK-Gs/BW表達的蛋白量在25~35 kDa,NRK-Ec/BW表達的蛋白量在40~50 kDa,表明4種Nrk基因均在大腸桿菌BW25113中成功表達。對4種NRK工程菌株進行驗證篩選,在50 mmol·L-1NR和50 mmoL·L-1ATP的反應體系中以37℃、pH 7.0、150 r·min-1恒溫攪拌反應1 h,檢測NMN生成量進行比對篩選。由圖2可知,NRK-Gs/BW催化產生的NMN含量及轉化率是4個工程菌株當中最高的,1 h催化生成NMN 28.12 mmol·L-1,轉化率最高達到56.24%,與其他菌株最高相差38%以上。因此初步選擇NRK-Gs/BW作為出發工程菌。
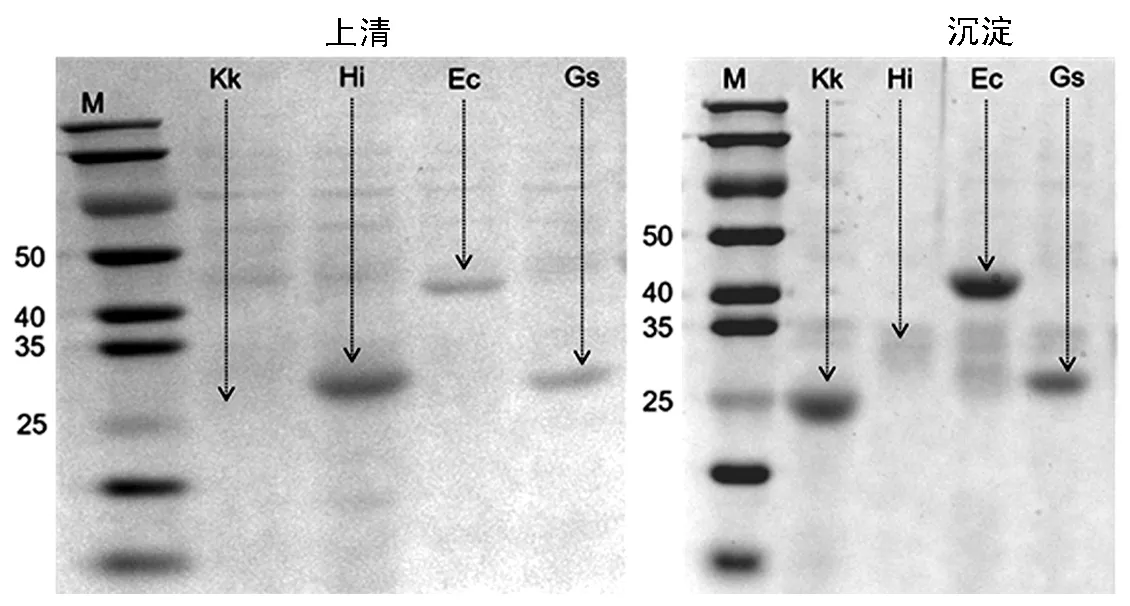
圖1 SDS-PAGE分析重組大腸桿菌NRK的表達Fig.1 NRK expression of the recombinant Escherichia coli by SDS-PAGE analysis
2.2 NRK工程菌株反應條件優化
為提高出發菌株的轉化率,對反應溫度和pH進行了優化。結果(圖3)表明,4種工程菌的最適反應溫度均在35~39℃;NRK-Kk/BW、NRK-Hi/BW、NRK-Ec/BW最適pH為7.0,NRK-Gs/BW最適pH為4.5~5.5,為嗜酸性酶。在NRK-Gs/BW體系中,NR轉化率最高時為86%。

圖2 NRK工程菌轉化能力測定Fig.2 Determination of the transformation ability of NRK engineering bacteria

圖3 溫度及pH對不同NRK催化轉化率的影響Fig.3 Effect of temperature and pH on the catalytic conversion of different NRK
2.3 PPK工程菌株表達與篩選
由圖4可知,對2株重組菌經SDS-PAGE凝膠分析,PPK-Bb/BW和PPK-Cb/BW條帶都在25~35 kDa,與預測值相符合。由圖5可知,NRK-Gs/BW與PPK-Bb/BW(圖5 A1)搭配的催化反應最高轉化率為76.6%,副產物(ADP+AMP)的量為6.6 mmol·L-1,NRK-Gs/BW與PPK-Cb/BW(圖5 B1)搭配時,最高轉化率達到89.8%,副產物的量為5.22 mmol·L-1。因此,PPK-Cb/BW與PPK-Bb/BW相比,轉化率更高且副產物更少,選用PPK-Cb/BW同NRK-Gs/BW進行雙酶催化反應。
2.4 催化體系析因結果分析
利用JMP軟件對4個影響雙酶催化結果的因素進行析因設計,對雙酶催化反應的轉化率等數據進行擬合處理,見圖6。根據JMP結果推斷,反應體系為:50 mmol·L-1NR、10 mmol·L-1ATP、35 mmol·L-1Mg2+、NRK(OD600nm=15)、PPK(OD600nm=15)時轉化率最高。

圖4 SDS-PAGE分析重組大腸桿菌PPK的表達Fig.4 PPK expression of the recombinant Escherichia coli by SDS-PAGE analysis

圖5 PPK工程菌株的篩選Fig.5 Screening of the PPK engineering strain
2.5 雙酶工程菌驗證
由圖7可知,在50 mmol·L-1NR、10 mmol·L-1ATP、35 mmol·L-1Mg2+、NRK-Gs & PPK-Cb/BW(OD600nm=15)反應體系中,pH=5.5,反應溫度為37℃,轉化3 h,NR轉化率最高可達99.96%,NMN產量為49.98 mmol·L-1。同時,反應產物中AMP僅0.42 mmol·L-1,有利于后期NMN產物純化。

圖6 雙酶催化反應體系響應面設計Fig.6 Response surface design of the dual-enzyme catalytic system

圖7 雙酶工程菌優化體系驗證Fig.7 Verification of the optimization system of dual-enzyme engineering bacteria
3 討論與結論
本試驗通過基因工程成功構建重組NRK-Kk/BW、NRK-Ec/BW、NRK-Gs/BW、NRK-Hi/BW 4株菌株,通過條件優化篩選出1株嗜酸性的高效轉化NR生成NMN的菌株NRK-Gs/BW。在體系中引入多聚磷酸激酶重組菌PPK-Cb/BW后,ATP使用量降低為初始的20%。通過軟件對析因設計試驗結果分析得出,雙酶法最優的反應體系為:50 mmol·L-1NR、10 mmol·L-1ATP、35 mmol·L-1Mg2+。最后,構建了雙酶工程菌NRK-Gs&PPK-Cb/BW進行高密度發酵和轉化驗證,結果顯示NR轉化率最高達到99.96%。本試驗構建的雙酶工程菌催化NR合成NMN,和單酶法相比ATP的使用降低80%,相較于現有的雙酶法轉化率最高可達到99.96%,能有效提高底物利用率。同時篩選的NRK和PPK均為嗜酸性酶,能有效地減少NMN的降解以及提高穩定性,有利于后期純化工作。但仍存在一些問題需要解決,如在保證轉化率的同時提高底物濃度和產量,這將有助于NMN工業化生產的放大。

