基于miR-370-3p與JAK2/STAT3通路相關性探討活血榮絡方促缺血性腦卒中后血管新生的機制
龔翠蘭,楊仁義,周德生,凌 佳,傅馨瑩,李俊熙
(1.湖南中醫藥大學,湖南 長沙 410208;2.湖南中醫藥大學附屬常德醫院,湖南 常德 415000;3.湖南中醫藥大學第一附屬醫院,湖南 長沙 410007;4湖南省中藥粉體與創新藥物省部共建國家重點實驗室培育基地,湖南 長沙 410208)
缺血性腦卒中又稱“腦梗死”,是臨床常見腦血管病,占急性腦血管病的70%左右,具有高發病率、高致殘率、高死亡率的特點,給社會帶來了嚴重的經濟負擔[1]。缺血性腦卒中后機體啟動內源性血管新生保護機制,改善缺血區側支循環和腦微循環,增加局部腦缺血區血流灌注,促進機體神經功能恢復。
前期研究提出,“榮氣虛滯”是缺血性腦卒中的關鍵病機,榮氣氣化的“精化氣-氣生變-變成形”過程是缺血性腦卒中后血管新生的中醫理論基礎[2],在活血榮絡法指導下創立活血榮絡方,納入湖南中醫藥大學第一附屬醫院臨床路徑13年,具有滋陰養血、活血通絡的功效,臨床治療缺血性腦卒中陰虛血瘀證頗有療效[3]。同時,實驗研究發現活血榮絡方能增加腦缺血區微血管密度,促進血管新生,改善缺血性腦卒中后神經功能缺損癥狀[4]。因此,為進一步研究活血榮絡方改善腦循環血管新生的作用機制,本研究以miR-370-3p介導JAK2/STAT3通路調控血管新生的機制為切入點,探討活血榮絡方治療缺血性腦卒中的保護作用。
1 材料
1.1 動物10~12周SPF級雄性SD大鼠60只,體質量為(250~280)g,購自湖南斯萊克景達實驗動物有限公司,動物許可證號:SCXK(湘)2019-0004,飼養于湖南中醫藥大學第一附屬醫院實驗動物中心,實驗許可證號:SYXK(湘)2015-0003,自由飲食,溫度(25±2)℃,濕度45%~60%,晝夜均勻交替。適應性喂養7 d后進行實驗,動物實驗經湖南中醫藥大學第一附屬醫院倫理委員會批準(倫理批準號:20201010-8)。
1.2 藥物與試劑
1.2.1藥物 活血榮絡方(湘藥制字20080472):雞血藤30 g、石楠藤30 g、生地黃15 g、黃精15 g、玄參10 g、川芎10 g、乳香10 g、沒藥10 g。各藥混合于置圓底燒瓶中,加10倍量水浸泡12 h后用冷凝回流裝置加熱回流2 h,提取第一次液過濾,殘渣加8倍量水,繼續冷凝回流1 h,提取第二次液過濾,合并兩次過濾液于旋轉蒸發儀上進行濃縮,即得活血榮絡方浸膏,無菌玻璃瓶分裝,4 ℃貯存備用。丁苯酞軟膠囊(中國石藥集團恩必普藥業有限公司,批號:H20050299)。STAT3抑制劑Stattic(美國Selleck公司,批號:S7024)。
1.2.2主要試劑 MACO大鼠栓線(北京西濃,批號2636A4、2638A4)。EDTA(PH8.0)抗原修復液、自發熒光淬滅劑(中國Servicebio,批號分別為:G1206、G1221-2);CD31、vWF熒光一抗(中國Servicebio,批號分別為:GB12063、GB11020);VEGF熒光一抗(武漢三鷹,批號:19003-1-ap);熒光二抗:488山羊抗兔、CY3-山羊抗小鼠、CY3熒光TSA(中國Servicebio,批號分別為GB25303、GB21301、G1223);DAPI(中國Servicebio,批號:G1012)。SDS-PAGE凝膠配置試劑盒(中國康為世紀生物,批號:CW0022S);Immobilon Western HRP底物(美國Millipore,批號:WBKLS0100);JAK2、p-JAK2、STAT3、p-STAT3抗體(英國Abcam,批號分別為ab108596、ab32101、ab68153、ab76315);β-Actin(美國Proteintech,批號:20536-1-AP);Goat Anti-Rabbit IgG H&L(HRP)(英國Abcam,批號:ab150120)。RNA提取試劑盒,RT First Strand cDNA Synthesis Kit,2×SYBR Green qPCR Master Mix (中國Servicebio,批號分別為G3013、G3330、G3322);HyPure TMMolecular Biology Grade Water(美國HyClone,批號SH30538.02)。
1.3 主要儀器石蠟切片機(美國Thermo Scientific);顯微成像系統(中國Motic);Mini-Protean Tetra小型垂直電泳槽、Mini Trans-Blot型轉印槽、PowerPac Basic基礎電泳儀、Gel Doc XR+凝膠成像系統、熒光定量PCR儀(美國Bio-Rad公司);臺式高速冷凍型微量離心機(中國DragonLab);超微量分光光度計(美國Thermo Scientific);多功能酶標儀(美國Perkinelmer);正置熒光顯微鏡(日本尼康)。
2 方法
2.1 大鼠腦缺血/再灌注模型的制備大鼠適應性喂養7 d后,10%水合氯醛(0.35 g·kg-1)腹腔注射麻醉大鼠,麻醉滿意后,參考Longa等[5]報道的大腦中動脈阻塞法(middle cerebral artery occlusion,MCAO),鈍性分離右側頸總動脈(CCA)、頸外動脈(ECA)和頸內動脈(ICA),從距ECA與ICA分叉部約4 mm處斜45°剪口進拴線,插入拴線約18 mm梗阻右側大腦中動脈;梗阻2 h后拔出拴線進行再灌注,以建立局灶性腦缺血/再灌注大鼠(middle cerebral artery occlusion reperfusion,MCAO/R)模型。
2.2 動物分組與給藥將60只SD大鼠隨機分成假手術組10只,造模組分別為模型組、活血榮絡方組、丁苯酞組、Stattic組、活血榮絡方+ Stattic組(聯用組),每組各10只。假手術組分離CCA、ECA、ICA,不插入拴線,余操作與造模組相同,造模組予以MCAO/R法造模。實驗過程中出現死亡、取材時發現蛛網膜下腔出血或腦出血剔除,根據需要予以補充。
手術6 h后對大鼠進行灌胃給藥,藥物劑量及時間參照前期實驗研究及藥物說明書。活血榮絡方組、聯合組予以活血榮絡方藥液(11.7 g·kg-1),丁苯酞組予以丁苯酞混懸液(6 mg·kg-1),假手術組、模型組、Stattic組予以等體積的生理鹽水,每日固定時間點灌胃給藥1次;Stattic組、聯合組予以Stattic工作液(3.75 mg·kg-1),假手術組、模型組、活血榮絡方組、丁苯酞組予以等體積生理鹽水,每日固定時間點灌胃給藥1次,各組大鼠連續給藥7 d后,進行指標檢測。
2.3 神經功能缺損評分評價神經功能缺損程度各組大鼠分別于d 1、3、7按Zea-Longa′s評分法[5]進行神經功能缺損評分,標準如下:0 =無障礙;1=不能完全伸展對側前肢;2=向對側轉圈;3=向對側傾倒,站立不穩;4=無自主活動、意識障礙、不能自發行走。分值越高提示神經功能缺損越嚴重。
2.4 免疫熒光染色觀察腦組織皮質區CD31、vWF、VEGF表達采用免疫熒光染色法檢測腦組織CD31、vWF、VEGF表達,以CD31與vWF雙染陽性細胞計算微血管密度,同時檢測VEGF表達,測定平均熒光強度。石蠟切片脫蠟至水后,置于EDTA抗原修復緩沖液中,放置于微波爐內,中火8 min停火8 min轉中低火7 min,進行抗原修復,自然冷卻后置于PBS中脫色。然后BSA孵育30 min封閉后,將切片與1 ∶200抗CD31、1 ∶200抗vWF和1 ∶3 000抗VEGF在4 ℃孵育過夜。PBS洗滌后,加與一抗相應種屬的二抗,避光室溫孵育50 min,洗滌后加DAPI染液,避光室溫孵育10 min,洗滌后用抗熒光淬滅封片劑封片。熒光顯微鏡觀察并采集圖像,采用ImageJ隨機在鏡下取5個視野,對5個視野中CD31與vWF雙染陽性細胞計數,取5個視野均數,計算微血管密度;同時采用ImageJ測定腦組織中VEGF平均熒光強度。
2.5 Western blot法檢測腦組織JAK2、p-JAK2、STAT3、p-STAT3蛋白的表達采用Western blot法檢測腦組織中JAK2、p-JAK2、STAT3、p-STAT3蛋白的表達。取梗死側腦組織于冰上,加入裂解液(組織裂解液 ∶PMSF=100 ∶1)后,經組織搗碎勻漿機充分研磨提取總蛋白。采用BCA法測定總蛋白濃度。蛋白上樣量為3 g·L-1,10 μL/孔。經SDS-PAGE凝膠電泳,轉膜,JAK2、STAT3用5%脫脂牛奶室溫封閉1.5 h,p-JAK2、p-STAT3用5%BSA封閉1.5 h,一抗JAK2(1 ∶2 000),p-JAK2(1 ∶2 000),STAT3(1 ∶2 000),p-STAT3(1 ∶2 000)4 ℃孵育過夜,洗膜3次,10 min/次,二抗(山羊抗兔,1 ∶10 000)37 ℃恒溫水浴搖床孵育60 min,再次洗膜后顯色成像。使用ImageJ分析圖像灰度值,以目的蛋白與β-actin灰度值的比值表示蛋白相對表達量。
2.6 Real-time PCR法檢測腦組織JAK2、STAT3 mRNA及miR-370-3p的表達采用Real-time PCR(RT-PCR)法檢測各組大鼠腦組織中JAK2、STAT3 mRNA與miR-370-3p的表達。取液氮凍存后的腦組織100 mg,用1 mL的TRIzol Reagent提取腦組織總RNA,使用Nanodrop 2000檢測RNA濃度及純度。采用RT First Strand cDNA Synthesis Kit逆轉錄試劑盒進行逆轉錄,按照試劑盒說明書進行擴增。反應體系為:2×qPCR Mix 7.5 μL,2.5 μmol·L-1基因引物1.5 μL,反轉錄產物2.0 μL,ddH2O 4.0 μL。預變性95 ℃,10 min,循環(40次)95 ℃,15 s→60 ℃,60 s,熔解曲線60 ℃→95 ℃,每15 s升溫0.3 ℃。mRNA以GAPDH為內參;miRNA以U6為內參,相對表達量用2-ΔΔCt對進行分析,引物序列見Tab 1。

Tab 1 PCR primer sequence
2.7 Pearson相關性分析腦組織miR-370-3p與JAK2/STAT3通路的相關性根據模型組、活血榮絡方組、丁苯酞組、Stattic組、聯用組大鼠的miR-370-3p與JAK2、STAT3 mRNA表達值,采用SPSS 23.0軟件進行Pearson相關性分析,并通過R語言繪制miR-370-3p與JAK2、STAT3的相關系數圖。當P<0.05時,則兩變量存在相關性;R>0時為正相關,R<0為負相關;0≤|R|<0.3為低度相關,0.3≤|R|<0.5為中度相關,0.5≤|R|<1為高度相關;|R|越大,相關性越大。
2.8 LncRNA-H19靶向miR-370-3p調節JAK2/STAT3信號通路培養大鼠腦血管平滑肌細胞,對照組正常培養,TNF-α組的細胞用100 μg·L-1TNF-α處理;將si-NC、si-H19、miR-NC、miR-370-3p mimics轉染至TNF-α誘導的大鼠腦血管平滑肌細胞,分別記為TNF-α+si-NC組、TNF-α+si-H19組、TNF-α+miR-NC組、TNF-α+miR-370-3p組;將si-H19和anti-miR-NC、si-H19和miR-370-3p共轉染至TNF-α誘導的大鼠腦血管平滑肌細胞,記為TNF-α+si-H19+anti-miR-NC組、TNF-α+si-H19+anti-miR-370-3p組。RT-qPCR檢測LncRNA-H19和miR-370-3p表達水平;熒光素酶報告實驗檢測LncRNA-H19和miR-370-3p的靶向關系。
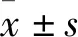
3 結果
3.1 各組大鼠神經功能缺損評分Zea-Longa′s評分越高,神經功能缺損越嚴重,其結果顯示,與假手術組比較,1 d、3 d、7 d神經功能缺損評分模型組明顯升高(P<0.01)。與模型組比較,活血榮絡方組與丁苯酞組1 d評分無明顯變化(P>0.05),3 d評分降低(P<0.05),7 d評分明顯下降(P<0.01);Stattic組1 d、3 d、7 d評分均無明顯變化(P>0.05);聯用組1 d、3 d評分無明顯變化(P>0.05),7 d評分明顯降低(P<0.01)。與活血榮絡方組比較,丁苯酞組1 d、3 d、7 d評分均無明顯變化(P>0.05);Stattic組1 d評分無明顯變化(P>0.05),3 d、7 d評分明顯升高(P<0.01);聯用組1 d、3 d評分均無明顯變化(P>0.05),7 d評分升高(P<0.01);與Stattic組比較,聯用組1 d評分無明顯變化(P>0.05),3 d評分降低(P<0.05),7 d評分明顯降低(P<0.01),見Tab 2。

Tab 2 The neurological deficit score of rats
3.2 各組大鼠腦組織皮質區CD31、vWF及VEGF表達大鼠腦組織免疫熒光結果顯示,以CD31和vWF共表達陽性細胞作為新生血管,計算MVD,結果顯示,與假手術組比較,模型組MVD明顯升高(P<0.01)。與模型組比較,活血榮絡方組、丁苯酞組、聯用組MVD明顯升高(P<0.01),Stattic組降低(P<0.05)。與活血榮絡方組比較,丁苯酞組無明顯變化(P>0.05),Stattic組與聯用組明顯降低(P<0.01)。與Stattic組比較,聯用組明顯升高(P<0.01)。VEGF免疫熒光平均熒光強度結果顯示,與假手術組比較,模型組明顯升高。與模型組比較,活血榮絡方組、丁苯酞組明顯升高(P<0.01),Stattic組明顯降低(P<0.01),聯用組無明顯變化(P>0.05)。與活血榮絡方組比較,丁苯酞組無明顯變化(P>0.05),Stattic組明顯降低(P<0.01),聯用組降低(P<0.05)。與Stattic組比較,聯用組明顯升高(P<0.01)。免疫熒光圖譜見Fig 1、Fig 2,MVD與VEGF平均熒光強度結果見Fig 3。
3.3 各組大鼠腦組織JAK2、p-JAK2、STAT3、p-STAT3蛋白的表達Western blot結果顯示,與假手術組比較,模型組JAK2、p-JAK2、STAT3、p-STAT3明顯升高(P<0.01)。與模型組比較,活血榮絡方組JAK2、p-JAK2、p-STAT3明顯升高(P<0.01),STAT3升高(P<0.05);丁苯酞組JAK2、p-JAK2、STAT3、p-STAT3明顯升高(P<0.01);Stattic組p-JAK2、STAT3、p-STAT3明顯降低(P<0.01),JAK2降低(P<0.05);聯用組JAK2、p-JAK2、p-STAT3無明顯變化(P>0.05),STAT3明顯降低(P<0.01)。與活血榮絡方組比較,丁苯酞組JAK2、p-JAK2、STAT3、p-STAT3無明顯變化(P>0.05);Stattic組與聯用組JAK2、p-JAK2、STAT3、p-STAT3均明顯降低(P<0.01)。與Stattic組比較,聯用組p-JAK2、STAT3、p-STAT3明顯升高(P<0.01),JAK2升高(P<0.05),見Fig 4。

Fig 1 Double immunofluorescence staining of CD31 and vWF in brain tissue of rats in each groupA:Sham operation;B:Model;C:Huoxue rongluo prescription;D:Butylphthalide;E:Stattic;F:Combination

Fig 2 Immunofluorescence staining of VEGF in brain tissue of rats in each groupA:Sham operation;B:Model;C:Huoxue rongluo prescription;D:Butylphthalide;E:Stattic;F:Combination

Fig 3 Mean fluorescence intensity of MVD and VEGF in cerebral cortex of A:Sham operation;B:Model;C:Huoxue rongluo prescription;D:Butylphthalide;E:Stattic;F:Combination.**P<0.01 vs Sham operation;#P<0.05,##P<0.01 vs Model;&&P<0.01 vs Huoxue rongluo prescription;△△P<0.01 vs Stattic
3.4 各組大鼠腦組織JAK2、STAT3 mRNA及miR-370-3p的表達RT-PCR結果顯示,與假手術組比較,模型組JAK2、STAT3 mRNA及miR-370-3p均明顯升高。與模型組比較,活血榮絡方組、丁苯酞組JAK2、STAT3 mRNA均明顯升高(P<0.01),miR-370-3p明顯降低(P<0.01);Stattic組JAK2 mRNA、miR-370-3p無明顯變化(P>0.05),STAT3 mRNA明顯降低(P<0.01);聯用組JAK2 mRNA均明顯升高(P<0.01),STAT3 mRNA與miR-370-3p明顯降低(P<0.01)。與活血榮絡方組比較,Stattic組JAK2、STAT3 mRNA明顯降低(P<0.01),miR-370-3p明顯升高(P<0.01);聯用組JAK2、STAT3 mRNA明顯降低(P<0.01),miR-370-3p無明顯變化(P>0.05)。與Stattic組比較,聯用組JAK2、STAT3 mRNA明顯升高(P<0.01),miR-370-3p明顯降低(P<0.01),見Fig 5。

Fig 4 Relative expression values of JAK2,p-jak2,STAT3 and p-STAT3 proteins in brain tissue of rats in each groupA.Sham operation;B.Model;C.Huoxue rongluo prescription;D.Butylphthalide;E.Stattic;F.Combination.**P<0.01 vs Sham operation;##P<0.01,#P<0.05 vs Model;&P<0.05,&&P<0.01 vs Huoxue rongluo prescription;△△P<0.01,△P<0.05 vs Stattic

Fig 5 Expression of JAK2,STAT3 mRNA and mir-370-3p in brain tissue of rats in each groupA:Sham operation;B:Model;C:Huoxue rongluo prescription;D:Butylphthalide;E:Stattic;F:Combination.**P<0.01 vs Sham operation;##P<0.01 vs Model;&&P<0.01 vs Huoxue rongluo prescription;△△P<0.01 vs Stattic
3.5 大鼠腦組織miR-370-3p與JAK2、STAT3的相關性Pearson相關性分析結果顯示,miR-370-3p與JAK2、STAT3高度負相關,相關系數分別為-0.92、-0.53;JAK2與STAT3高度正相關,相關系數為0.64,見Fig 6。

Fig 6 Correlation coefficient of mir-370-3p with JAK2 and STAT3
3.6 LncRNA-H19和miR-370-3p在TNF-α誘導的大鼠腦血管平滑肌細胞中的表達與對照組比較,LncRNA-H19在TNF-α誘導的大鼠腦血管平滑肌細胞中的表達水平明顯升高,miR-370-3p在TNF-α誘導的大鼠腦血管平滑肌細胞中的表達水平明顯降低(P<0.05),見Tab 3。

Tab 3 TNF-α of lncRNA-h19 and miR-370-3p expression level of brain vascular smooth muscle cells induced by TNF-α
3.7 LncRNA-H19和miR-370-3p的靶向調控關系雙熒光素酶報告實驗結果顯示,TNF-α+miR-370-3p組與TNF-α+miR-NC組比較,WT-H19熒光素酶活性差異具有明顯性(P<0.05),MUT-H19熒光素酶活性差異無明顯性(P>0.05),見Tab 4、Fig 7。

Fig 7 The targeted regulatory relationship between lncRNA-H19 and miR-370-3p

Tab 4 Double luciferase report
4 討論
缺血性腦卒中發生后,機體可啟動內源性血管新生系統,改善腦側支循環,增加腦血流灌注,為局部缺血區供氧及營養物質,以挽救腦組織缺血缺氧狀態,加快神經功能恢復。
STAT/HIF-1α/VEGF通路是缺血性腦卒中后血管新生的關鍵通路,缺血性腦卒中發生后,IL-6、TNF等多種炎癥因子、細胞因子與細胞膜上受體結合后,通過磷酸化的方式激活JAK2/STAT3通路,在細胞核內形成同源或異源STAT3二聚體,易位入核,促進核內HIF-1α轉錄,使得HIF-1α下游VEGF轉錄進一步激活,介導下游PI3K-AKT通路、PLCγ1-PKC通路、MAPK通路[6],促進內皮細胞(ECs)增殖、遷移、分化成管,調控Rho家族蛋白促進血管偽足形成,在多種疾病血管新生中發揮重要作用[7]。miRNA能特異性識別下游目的基因mRNA 3′UTR,抑制下游基因表達,參與調控血管新生的進程[8]。Stattic是非肽類STAT3 SH2結構域抑制劑,能有效抑制STAT3激活和核易位,Xue等[9]研究發現,JAK2/STAT3通路抑制劑Stattic抑制ECs增殖,下調了VEGFA/B、VEGFR2的表達,抑制血管新生。
團隊前期研究發現,“陰虛血瘀—榮氣虛滯”理論立方的活血榮絡方在缺血性腦卒中早期能調控JAK2/STAT3通路,降低IL-1β、TNF-α、MMP-9的表達,減輕腦缺血再灌注后炎癥損傷[10];在缺血性腦卒中后期能促進Caveolin-1蛋白表達,增加梗死區微血管密度,促進腦梗死后血管新生;其有效成分可能通過 STAT3/miRNA 反饋環路激活 STAT/HIF-1/VEGF 信號通路促腦梗死后血管新生[11],為中醫藥治療腦梗死疾病提出了深層次的分子機制及新的方向。前期檢索Targetscan數據庫發現,STAT3的轉錄后翻譯過程受10位上游miRNA的調控,根據預測分數及權重分數可知,排列前三位的是miR-370-3p、miR-290、miR-292-5p(預測分數均達85),因此推測缺血性腦卒中的發生機制可能與miR-370-3p調控JAK2/STAT3通路有關,且活血榮絡方可能參與此機制促進缺血性腦卒中后期血管新生。
CD31與vWF是ECs的特異性標志蛋白,大鼠腦組織免疫熒光染色后CD31、vWF和DAPI分別呈現紅色、綠色和藍色,CD31與vWF共表達的陽性細胞作為新生血管,計算微血管密度,結果顯示活血榮絡方能明顯促進缺血性腦卒中大鼠血管新生及腦組織中VEGF的表達,Stattic能明顯抑制缺血性腦卒中大鼠血管新生及腦組織中VEGF的表達。提示在大鼠缺血性腦卒中后,機體內源性血管新生啟動,活血榮絡方可能有促進作用,而Stattic作為特異性STAT3抑制劑,在一定程度上可能抑制了內源性血管新生的啟動。
LncRNAH19為父系印記基因,位于人類染色體11p15.5的端粒區域附近的H19/IGF2基因簇上,該區域常涉及兒童和成人腫瘤。研究發現,lncRNA H19可作為ceRNA競爭結合DUSP5,并解除DUSP5對其靶基因Erk1/2的抑制,即通過lncRNA H19/DUSP5/Erk1/2調控軸激活自噬過程從而誘導腦IRI[12];miR-370-3p是一個腫瘤相關miRNA,可調控細胞增殖、凋亡及侵襲等生理過程,抑制腦膠質瘤、膀胱癌細胞的侵襲。Cui等[13]研究表明,miR-370-3p參與下丘腦的慢性電針耐受過程,過表達miR-370-3p可降低電針耐受,提示miR-370-3p可能具有神經生理調節能力,可能作為一種靶點干預抑郁癥。另外,經過TargetScan3.1軟件預測miR-370-3p可能與lncRNA H19存在靶向關系,雙熒光素酶報告驗證lncRNA H19是miR-370-3p靶向調控分子。
Western blot、RT-PCR及Pearson相關性分析結果顯示JAK2與STAT3呈高度正相關,二者與miR-370-3p呈高度負相關;活血榮絡方能上調JAK2、STAT3 mRNA表達,也能促進JAK2、p-JAK2、STAT3、p-STAT3蛋白表達;而Stattic能下調STAT3 mRNA表達,且能抑制JAK2、p-JAK2、STAT3、p-STAT3蛋白表達,提示活血榮絡方與丁苯酞能下調miR-370-3p的表達,激活JAK2/STAT3通路;Stattic在不影響miR-370-3p的表達的條件下,可能通過磷酸化途徑抑制JAK2/STAT3通路。Ruan等[14]研究發現,miR-370在MCAO大鼠腦組織中過表達,能靶向抑制SIRT6表達,激活Nrf2/ARE通路,加重神經功能缺損。Zhang等[15]研究發現,激活STAT3能上調VEGF的表達,此過程能被Stattic逆轉,與Carbajo等[16]報道的Stattic阻斷HIF-1α/STAT3通路,抑制VEGF表達,抗血管新生的結果相互佐證。Li等[17]研究發現,丁苯酞能激活JAK2/STAT3通路,減輕海馬神經元細胞凋亡,改善腦缺血損傷。
同時,TNF-α+si-H19組和TNF-α+si-H19+anti-miR-370-3p組p-JAK2、p-STAT3蛋白表達明顯升高。提示活血榮絡方可能下調miR-370-3p的表達及lncRNA H19靶向激活JAK2/STAT3通路,從而促進VEGF表達并刺激血管新生,改善大鼠缺血性腦卒中后神經功能癥狀。
綜上所述,活血榮絡方治療缺血性腦卒中的機制可能與其下調miR-370-3p的表達,激活JAK2/STAT3通路,促進下游VEGF的表達,刺激缺血性腦卒中后血管新生,改善神經功能缺損癥狀有關,為進一步中醫藥防治缺血性腦卒中提供了實驗基礎。

