德國胃癌腹膜轉移腹腔熱灌注化療的實踐和進展
Pompiliu Piso
胃癌在全球惡性腫瘤中發病率居第5 位,死亡率居第4 位,有研究表明轉移或復發型胃癌患者中有46%為腹膜轉移患者,胃癌根治術后復發1/3 的部位在腹腔內[1]。本文系統介紹了德國腹膜癌研究注冊機構所開展的臨床試驗,尤其是在胃癌腹膜轉移癌(gastric cancer peritoneal metastasis,GCPM)治療和預防方面的研究,臨床試驗結果和治療經驗,并與國際研究進行了比較。本文還進一步論述了加壓腹腔氣溶膠化療的初步試驗結果,展望了下一步研究方案。
1 轉移性胃癌
1.1 GCPM 的臨床特征
GCPM 患者預后差,生存期短,即使采用通用治療方法:系統性化療,對于GCPM 的療效仍比較有限。臨床基本公認手術對于轉移性胃癌療效甚微。Thomassen等[2]開展的一項大規模胃癌人群系統性薈萃分析研究,發現GCPM 約占13%,中位生存期僅為4.6 個月。
1.2 手術對轉移性胃癌的治療意義
近年來,德國針對系統性化療在胃癌中的應用研究發展迅速,主要得益于FLOT 系列研究的開展。FLOT方案主要包括奧沙利鉑、氟尿嘧啶、多西他賽的三藥聯合。Ⅱ期試驗FLOT3 研究顯示[3],局部轉移性胃癌患者接受圍手術期FLOT 方案化療(8 個周期)聯合胃癌D2 手術+轉移灶切除術相比于僅行維持性FLOT方案化療(8 個周期),總生存期延長[22.9 個月vs.10.7 個月(HR=0.37,95%CI:0.25~0.55;P<0.001)]。而日本的REGATTA 研究顯示,單純減瘤手術對術后生存期無明顯延長,原因可能由于入組患者沒有接受圍手術期化療,以及手術方式僅限于姑息性切除,包括切除部分胃,但不包括切除轉移灶等部位。因此,在該研究中未能有效呈現出手術的意義。由于FLOT3 研究的非隨機性,FLOT 研究組進行了一項多中心、隨機Ⅲ期試驗FLOT5,旨在研究局部轉移性胃癌患者,維持性化療對比轉化治療聯合手術對生存期和生活質量的影響。研究中轉化治療也包括區域性(腹腔)化療、腹腔熱灌注化療等,該研究仍在招募患者中,研究組希望可以通過手術聯合轉化治療,提高轉移性胃癌患者的生存期[4]。
2 GCPM 的治療策略選擇
2.1 腹腔內化療的選擇
對于GCPM 患者的治療方案,包括手術聯和腹腔熱灌注化療、腹腔內化療等技術。2016年,Boerner 等[5]的回顧性研究表明,腫瘤細胞減滅術(cytoreductive surgery,CRS) 聯合腹腔熱灌注化療(hyperthermic intraperitoneal chemotherapy,HIPEC)可延長GCPM 患者的總生存期,但不能治愈[17.2 個月(95%CI:10.1~24.2)vs.11.0 個月(95% CI:7.4~14.6);P=0.004]。有研究報道腹腔鏡HIPEC 手術治療腹水,胃癌根治性手術后輔助使用HIPEC,以及術后通過腹腔化療泵或引流管進行腹腔內常溫化療等,根據治療的性質及應用時間點又分為系統化療聯合腹腔內常溫化療( systemic and intraperitoneal chemotherapy,SIPC)、術后早期腹腔內常溫化療(early postoperative intraperitoneal chemotherapy,EPIC) 、新輔助系統化療聯合腹腔內常溫化療(neoadjuvant intraperitonealsystemic chemotherapy protocol,NIPS)等。近期德國又出現了新治療模式,特別是對于腹水和腹膜轉移的姑息性治療,即采用加壓腹腔氣溶膠化療(pressurized intraperitoneal aerosol chemotherapy, PIPAC)技術[6](表1)。目前在德國仍有很多有關GCPM 的臨床研究正在進行中。
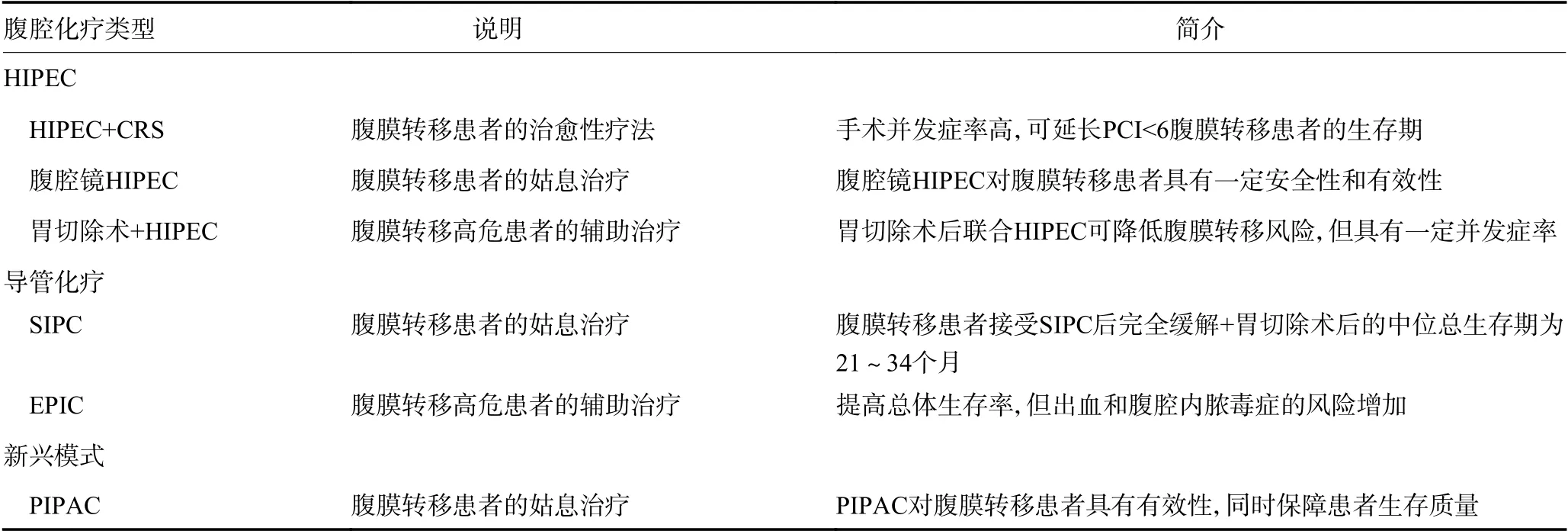
表1 腹腔化療類型及說明
2.2 CRS+HIPEC 治療GCPM 的患者選擇
大部分關于CRS+HIPEC 手術在GCPM 患者中應用的研究多為回顧性隊列研究。多數研究指出CRS+HIPEC 手術僅會給特定條件的GCPM 帶來生存獲益,包括:能夠獲得完全腫瘤細胞減滅程度(completeness of cytoreduction,CC)0~1 分的腹膜轉移患者;腹膜癌指數(PCI)<6;局部區域性腹膜轉移;無小腸浸潤;病理分化良好;同時性腹膜轉移;病理無印戒細胞成分;體力狀況評分ECOG 0 分;對系統性化療具有療效反應[7]。
2.3 CRS+HIPEC 治療GCPM 的安全性
CRS+HIPEC 通常手術范圍廣、創傷大,一項回顧性分析顯示在胃癌患者中該手術的并發癥率為21.4%,死亡率為4.8%[8]。在德國,接受治療CRS+HIPEC 手術患者的比例正在逐年升高。近一年,盡管有新型冠狀病毒肺炎的流行,在德國仍有超過1 000 多例接受CRS+HIPEC 手術的患者。根據德國醫療保險數據,近9年中共有8 463 例接受CRS+HIPEC 手術的腹膜癌患者,GCPM 患者占20%,住院死亡率和并發癥率分別為3.4%、8.8%~19.5%[9]。德國普外科和內臟外科學會(DGAV)腹膜登記研究組的數據分析顯示,在年均100 例以上的手術中心,死亡率(1.51%)顯著低于年均100 例以下的手術中心(3.41%),腸瘺率同樣較低為3.11%[10]。
2.4 CRS+HIPEC 治療GCPM 的有效性
DGAV 腹膜登記研究組中GCPM 的亞組數據顯示,315 例GCPM 患者,中位PCI 為8,71.6%的患者實現CC 0~1,這比例低于結腸癌患者及腹膜假黏液瘤患者,但PCI<6 患者的中位生存期為18 個月,這與Rau 等[11]的研究結果相似,生存期較長。另一項來自法國的前瞻性多中心傾向性匹配評分研究(CYTOCHIP)顯示,PCI<6 的患者中,CRS+HIPEC 手術相比于單純CRS的患者具有更好的生存期,中位生存時間為18.8個月,與上述研究結果一致。研究表明,CRS+HIPEC在沒有增加手術并發癥率及死亡率的前提下,延長了GCPM 患者的生存期,如果在特定的患者群體中可以達到滿意腫瘤細胞減滅程度,CRS+HIPEC 將是非常具有前景的治療技術[12]。
上述研究雖然已取得質量較高的GCPM 臨床研究結果,德國胃癌指南卻并未將CRS 和HIPEC 作為GCPM 的常規治療。指南認為局部腹膜轉移的胃癌患者應在有經驗的中心接受治療,并由多學科診療團隊做出臨床診療決策。
目前德國進行一項前瞻性、多中心、非盲、隨機對照GASTRIPEC 試驗,研究HIPEC 對于GCPM患者的安全性和有效性。研究中患者均接受轉化治療且CC 0~1,化療方案采用歐洲推薦的標準化EOX方案,HIPEC 藥物使用順鉑和絲裂霉素C。截至2018年6月,106 例患者被納入試驗。但后續招募情況不佳,且在治療的前4 個月發生疾病進展的患者比例高達56%,該試驗已提前中止。中期分析顯示48.9%患者的PCI<6,中位總體生存期為13.2 個月。GASTRIPEC 研究探索GCPM 患者CRS+HIPEC 治療的價值,遠期隨訪結果值得期待[13]。
3 胃癌根治術后輔助HIPEC 治療
德國目前正在進行一項多中心、隨機對照試驗FLOT9(PREVENT 試驗),旨在可切除彌漫型胃癌和胃食管結合部Ⅱ/Ⅲ型腺癌中,探究預防性HIPEC(順鉑+絲裂霉素C)聯合圍手術期FLOT 方案對比單獨FLOT 方案,該研究招募進程順利,研究組希望能夠在未來招募到足夠多的患者,從而獲得德國的一些關于胃癌根治術后輔助HIPEC 治療的數據[14]。法國正在開展著一項前瞻性、多中心、非盲、隨機對照的Ⅲ期臨床試驗GASTRICHIP,擬研究輔助HIPEC 治療(奧沙利鉑)在根治性胃癌術后應用的安全性與有效性,研究假設輔助HIPEC 治療可將胃癌術后5年生存率從30%提升至45%[15]。
在2022年美國臨床腫瘤學會(ASCO)大會上,德國專家報告了40 例胃癌患者進行HIPEC,HIPEC 組患者生存率優于非HIPEC 組(3年生存率:55.0%vs.26.5%,P=0.073;5年生存率:45.0%vs.23.0%,P=0.174),差異無統計學意義。
4 GCPM 姑息性治療的新技術PIPAC
PIPAC 技術由德國Reymond 教授發明,該團隊已經發布了關于在胃癌患者中使用PIPAC 技術的Ⅱ期臨床試驗,經過1 個周期PIPAC 治療后16%患者的組織病理學轉為陰性,之后接受了CRS+HIPEC 手術,顯示出較好的療效[16]。2019年,Alyami 等[17]的研究證實了上述結論,該治療方法對于胃癌治療的客觀緩解率為50%~91%。另一項來自法國的回顧性數據顯示,146 例患者共接受437 個周期PIPAC 治療,其中50% 的患者為GCPM。中位接受PIPAC 治療為3(1~8)個周期。所有患者在PIPAC治療期間都進行系統性化療,PIPAC 治療后并發癥率低,無嚴重并發癥發生,14%的患者能夠轉為可切除狀態,并接受CRS+HIPEC 治療,因此該技術在胃癌根治術后預防腹膜轉移可能也有一定前景[18]。
5 結語
5.1 證據總結
德國首先開展了Ⅱ期FLOT3 研究證實,手術聯合化療可延長局部轉移性胃癌患者的生存期,并開展Ⅲ期試驗FLOT5 研究進一步證實。德國登記中心的數據與法國CYTO-CHIP 試驗均顯示在PCI<6 的胃癌患者中,CRS+HIPEC 手術患者具有更好的生存期,中位生存時間為17~18 個月,表明該手術方式在經驗豐富的中心實施會更安全。而HIPEC對于GCPM的安全性和有效性,德國開展了GASTRIPEC 試驗。HIPEC 在胃癌根治術后的輔助治療作用,德國、法國分別開展了PREVENT 試驗、GASTRICHIP 試驗。PIPAC 技術是新技術,雖然一些高質量研究顯示良好療效,但仍需要進一步研究證實。
5.2 經驗總結
目前,尚缺乏HIPEC 技術所用統一的藥物種類、灌注時間、灌注溫度。根據HIPEC 治療目的進行分類,主要包括治療GCPM、預防性輔助治療胃癌術后腹膜轉移高危患者。治療方法主要分為開放式HIPEC技術和閉合式HIPEC 技術。德國HIPEC 經驗性藥物主要包括多西他賽、奧沙利鉑、順鉑、阿霉素和絲裂霉素C 等,灌注時間30~90 min,溫度41~43℃。
在德國臨床PIPAC 技術實踐中,大多數中心使用10~12 mm trocar 進行藥物輸送,5 mm 光學trocar 進行PIPAC。首先建立CO2氣腹,壓力12 mmHg,而后進行診斷性腹腔鏡檢查,獲取腹水或組織樣本,記錄PCI。隨后,化療藥物(奧沙利鉑或順鉑和阿霉素)通過高壓注射器(最大壓力290 PSI,流速0.5~0.7 mL/s)和專用一次性9 mm 微型注射器變成氣溶膠形態。在這一階段,氣腹壓力保持在12 mmHg,CO2流量為零,持續30 min,使霧化化療藥物保持在腹膜腔內無滲漏。殘留的氣溶膠通過2 個微粒過濾器經氣溶膠廢物處理系統排出,以保護醫療和護理人員免受細胞毒性劑的影響。PIPAC 建議與系統性化療結合使用,兩次PIPAC 的間隔時間大概在6~8 周,至少進行3 個周期PIPAC 術。
綜上所述,CRS+HIPEC 及胃切除術可以在有潛在治愈性的情況下實施,但僅能在經驗豐富的中心并根據多學科診療團隊的臨床決策開展。目前,德國、法國正在開展有關CRS+HIPEC 治療GCPM 的有效性和安全性的高質量臨床試驗,同時也開著著有關胃癌切除術后輔助HIPEC 治療的臨床試驗。德國發明的PIPAC 技術聯合系統性化療作為姑息性治療手段,可有效處理及預防腹水等并發癥。

