404 Not Found
404 Not Found
完全腫瘤細胞減滅術加全盆腔切除加腹腔熱灌注化療在腹膜癌合并盆腔腫瘤中的應用
Pedro Barrios Oriol Crusellas Montse Martín Isabel Ramos
腫瘤細胞減滅術(cytoreductive surgery,CRS)+腹腔熱灌注化療(hyperthermic intraperitoneal chemotherapy,HIPEC)治療腹膜癌療效顯著,已獲得腫瘤學界認可[1]。隨著手術經驗的積累、手術方案的完善和腹膜癌專業中心的支持,CRS+HIPEC 相關病發癥率和死亡率降低[2],促進了其在腹膜癌中的應用。
CRS+HIPEC 療效直接取決于CRS 質量,即腫瘤細胞減滅程度(completeness of cytoreduction,CC)。目前認為,清除肉眼可見腫瘤,達到CC 0,可實現最佳療效[3]。1995年,Paul H. Sugarbaker 等[4]報道了腹膜切除術和多臟器聯合切除術,使CC 0 切除成為可能。
盆腔切除術在局部晚期結直腸癌、泌尿系腫瘤、女性生殖系統腫瘤及盆腔肉瘤的治療過程中發揮了重要作用。部分腹膜癌患者合并晚期盆腔腫瘤,CRS+全盆腔切除術(total pelvic exenteraction,TPE)+HIPEC整合治療策略,是目前唯一可能的治愈療法。
目前,后盆腔切除術作為盆腔腹膜切除的一部分,已得到廣泛應用。而其他盆腔切除方式,如TPE,臨床應用受限,原因:腹膜癌病人體弱且預后不確定;操作復雜、風險大,病發癥率高、死亡率高,對生活質量影響大。因此,嚴格病例篩選,組建專業外科團隊,建立專業腹膜癌中心是非常必要的。
本研究總結本中心CRS+EPT+HIPEC 經驗,描述CRS+EPT+HIPEC 且無造瘺手術策略和技術改進,重點闡述安全性和優化功能重建,并強調了專業手術團隊和專業中心,對促進手術標準化和整體治療方案規范化的重要意義。
1 材料與方法
1.1 臨床資料
研究對象均來源于加泰羅尼亞腹膜癌前瞻性數據庫。選取2006年9月至2021年1月經CRS+HIPEC治療的腹膜癌患者1 172 例,累計接受CRS+HIPEC治療1 314 例次,女性占63.6%,男性占36.4%,平均年齡為57(18~83)歲。1 314 例次CRS+HIPEC 術中,14 例行TPE,且功能重建未行消化道造瘺和尿量改道。納入標準:1)患者符合CRS+HIPEC 適應證。2)手術團隊根據影像學、手術探查結果,評估腫瘤生物學行為、治療風險和身體狀態,決定是否聯合TPE。可行CRS+HIPEC 標準:1)ECOG 評分0~1 分;2)年齡≤75歲;3)主要臟器功能無手術禁忌;4)無其他活動期惡性腫瘤。
1.2 方法
1.2.1 術前護理方案 術前護理方案包括:營養評估,機械性腸道準備,血栓預防等。術前常規預防性使用抗生素,有吻合患者,連續應用3 天。所有患者均行持續胃腸減壓和腸外營養,直到恢復進食。
1.2.2 CRS+TPE+HIPEC 手術技術 所有手術操作均由同一腹膜腫瘤手術團隊完成,無其他外科專家參與。HIPEC 在吻合完成后進行,溫度為42.5 °C,時長為30、60 或90 min,模式為開放式,化療藥物根據腫瘤病理選擇。采用國際直腸癌外科研究組(ISGRCS)系統定義和評價吻合口病發癥[5]。
1.2.3 CRS:全腹膜切除術+聯合臟器切除術 腹膜切除術是指切除肉眼可見腫瘤侵犯的腹膜區域,局限/孤立的腫瘤結節可以電外科設備電灼氣化滅活。臟層腹膜受侵則行受侵臟器聯合切除,涉及臟器包括:胃、小腸、結腸、直腸、膀胱等。腹膜切除術采用電刀操作,以減少出血并清除瘤床的活性腫瘤細胞。
1.2.4 根治性盆腔手術:盆腔切除術 部分腹膜癌患者合并晚期盆腔腫瘤,并常累及多個盆腔區域,盆腔切除術是唯一根治性治療策略。全盆腔切除術需切除小骨盆內的所有臟器:男性包括直腸、膀胱和前列腺,女性包括直腸、子宮、和膀胱。通常為肛提肌上盆腔切除,當腫瘤侵犯尿道、陰道遠端1/3 或肛管時,聯合肛提肌下盆腔部分切除。
肛提肌上全盆腔切除術遵循腫瘤學整塊切除原則,由筋膜外入路,向心性分離,整塊切除盆腔腫瘤及周圍臟器和結構。
1.2.5 改良結直腸端端機械吻合技術 本中心改良了傳統結直腸機械吻合術,實現完全端端吻合,無需預防性造口,結直腸吻合口漏發生率僅為0.85%。
改良技術如下:1)充分游離直腸。直腸后方游離時,沿骶前筋膜至肛尾韌帶,打開肛尾韌帶,游離直腸遠端1/3,至恥骨直腸肌水平。2)直腸殘端準備。裸化直腸殘端,顯露腸壁,距離約距縫合釘線1.5 cm(圖1A)。3)直腸斷端縫合釘線處理。點狀縫合直腸斷端的縫合釘線兩側端,收緊縫線,使縫合釘形成環繞吻合器穿刺桿的環。穿刺桿自縫合釘環中央穿出直腸壁,調整縫合釘環,并在穿刺桿上打結,使其完整進入吻合裝置內(圖1B)。4)環形機械吻合術。閉合吻合裝置前,避免過度推擠殘端組織,使直腸殘端,包含縫合釘線環,松弛的進入吻合裝置,以減少組織損傷(圖1C)。5)閉合吻合裝置并根據組織厚度調整釘高,以避免組織撕裂。HIPEC 后或長時間手術后,腸壁水腫增厚,調整吻合釘高尤為重要。吻合完成后,退出機械吻合器,查看吻合口殘端,確認完整包含直腸殘端和吻合釘環。吻合口完全端端對合,無兩側“耳”,且完全在生物組織釘合,無橫向縫合釘干擾。6)手工加固吻合口。漿肌層間斷縫合加固吻合口整圈。如前所述,直腸殘端充分游離有助于安全完成加固(圖1D)。
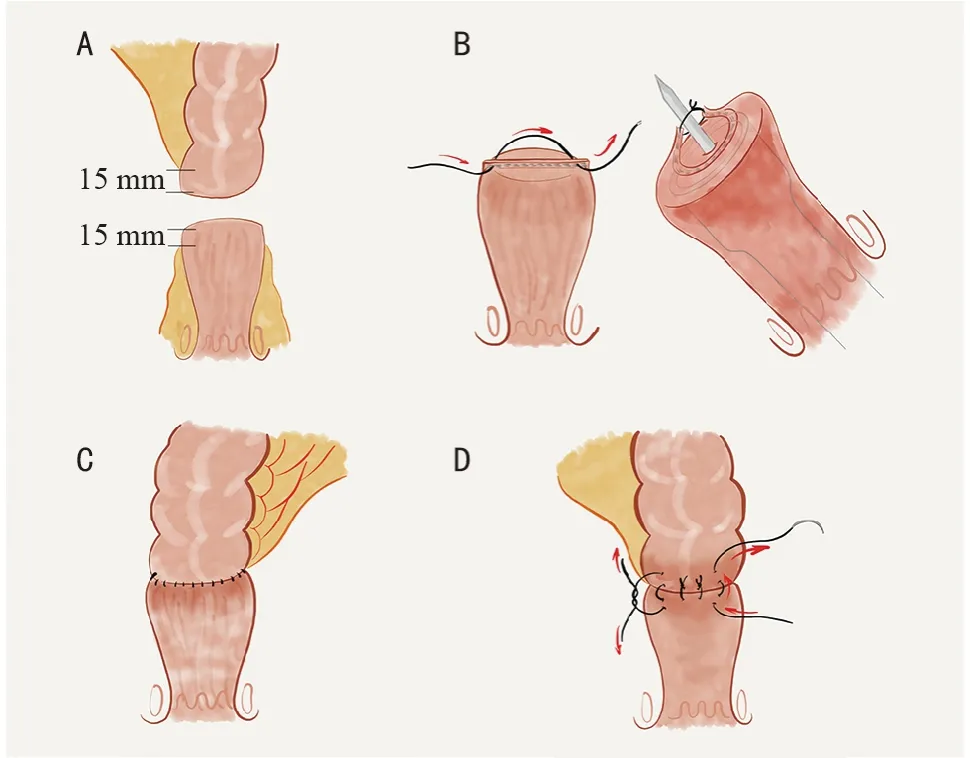
圖1 改良結直腸端端機械吻合技術
1.2.6 尿路重建技術 所有患者均接受了膀胱全切除或次全切除術及相應的泌尿道重建:1)保留兩側輸尿管開口的膀胱次全切除術及膀胱擴容術。輸尿管或膀胱三角未受累者,可行膀胱次全切除術。膀胱重建優先采用游離小腸段、盲腸或乙狀結腸進行膀胱擴容術(圖2)。2)保留單側輸尿管開口的膀胱次全切除及膀胱擴容術。少數患者中,腫瘤只侵犯一側輸尿管膀胱段,可行保留健側輸尿管口的膀胱次全切除術,并在膀胱擴容術后行“Y 行”輸尿管移位。3)膀胱全切除和膀胱重建術。腫瘤累及膀胱頸時,需行膀胱全切除術。根據腸管剩余情況,選用回盲部復合體或游離回腸段行膀胱重建術。在需要切除尿道內括約肌或尿道內口的患者中,通常使用回盲部復合體重建,并保留闌尾近端1/3 及其供血血管,以吻合近端尿道,改善尿失禁(圖3)。
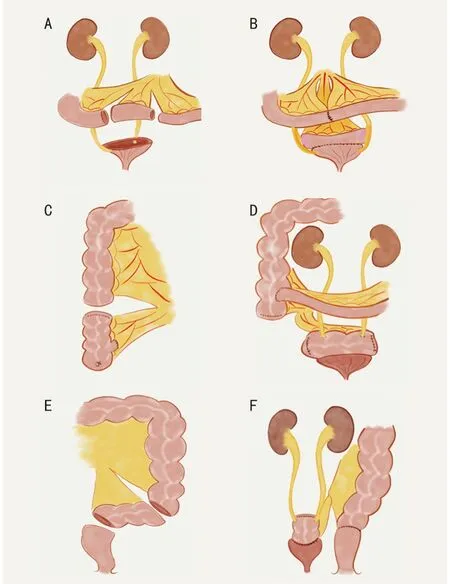
圖2 膀胱次全切除和膀胱擴容術
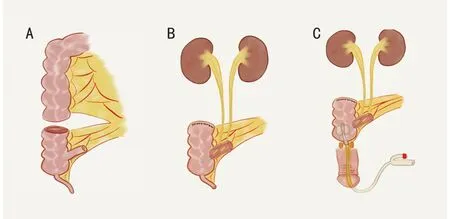
圖3 膀胱全切除和膀胱重建術
輸尿管與新膀胱吻合采用回腸內植入吻合技術,可確保腸腔內輸尿管遠端保留1~2 cm 的長度,促進輸尿管血管化,安全性好。這種輸尿管殘端在腸腔內游離狀態,可作為一種抗反流瓣膜機制。泌尿道重建過程中,雙側輸尿管均常規置入D-J 管,術后保留1 個月。
2 結果
2.1 基線數據
14 例患者中,女性9 例,男性5 例;婦科腫瘤腹膜轉移5 例,結直腸癌腹膜轉移6 例,小圓細胞腫瘤1 例,臍尿管來源腹膜假黏液瘤1 例。
2.2 CRS+TPE+HIPEC
14 例患者均實現了CC 0 切除,腹膜切除區域≥4 個,且包含聯合腹腔臟器切除,吻合口≥2 個。肛提肌上TPE 共11 例,3 例行部分盆底切除,11 例行膀胱擴容術,采用的腸段分別為:回腸6 例,盲腸4 例,乙狀結腸1 例。3 例行回盲部復合體行膀胱重建術,以闌尾近端1/3 與尿道近端吻合。
2.3 安全性
無消化道吻合口病發癥。術后尿漏5 例,其中3例無需侵入性修補,1 例行腎造瘺術,1 例因膀胱過度擴張導致輸尿管植入部位脫出,行二次手術修補。無術后90 天內死亡。
3 討論
CRS+HIPEC 治療腹膜癌安全、有效,而盆腔切除術是目前可能治愈局部晚期盆腔腫瘤的唯一策略[6]。得益于外科專科化和專病中心建設,兩種治療策略得到了良好的發展。CRS+HIPEC 和盆腔切除術都適應于局部轉移癌治療,但前提是轉移灶可徹底切除。此外,術前和術后身體狀態[7-8],營養不良的早期識別和治療[9],及早期和晚期病發癥管理[10]均為重要的考慮因素。
腹膜癌合并晚期盆腔腫瘤并不少見,在本中心數據中,15.3% 的腹膜癌患者需行盆腔切除術,其中1.3%行TPE,56%的患者可避免任何形式的造瘺術。盡管,臨床上已相對廣泛的應用后盆腔切除術聯合CRS+HIPEC 治療腹膜癌。但由于晚期腫瘤預后不確定性,且TPE 操作復雜、難度大、風險高,CRS+TPE+HIPEC 臨床應用仍受限。
在適當選擇的患者中,CRS+TPE+HIPEC 整合治療是安全、有效的,具備臨床可行性。然而,此類患者大多需至少一種造瘺術,嚴重影響了生活質量。
本中心每年由同一外科團隊開展CRS+HIPEC超過120 例次,有豐富的CRS 和TPE 經驗,控制吻合口漏發生率低于1%,術后60 天死亡率低于0.20%(1 314 例CRS+HIPEC 手術,3 例術后死亡)。本文報道25 例CRS+TPE+HIPEC,術中均未行消化道造瘺(2 例術前即為結腸造瘺狀態,因直腸殘端過短,未行還納),14 例患者亦未行尿路改道,證明CRS+TPE+HIPEC 可在無需任何造瘺的前提下完成,極大改善此類患者生活質量。
患者選擇對CRS+TPE+HIPEC 整合治療策略至關重要。僅有治愈可能,且有治愈意愿的患者適用于該治療策略。TPE 過程中涉及的神經和血管切除,僅限于閉孔神經和髂血管,而坐骨神經、主動脈分叉及骨受侵,或需要大規模重建骨盆缺損為該治療策略的禁忌證。推薦術前新輔助化療,以檢測藥物療效,縮小腫瘤體積,降低手術創傷,僅對新輔助化療有客觀響應的患者適用該整合治療。采用腹膜癌指數,評估不同來源腹膜癌完全CRS+HIPEC 及R0 盆腔腫瘤切除的可行性。
本研究聚焦CRS+TPE+HIPEC 聯合應用的臨床指征,首次詳細描述了無需造瘺術的TPE 在切除和重建階段的技術要點,證實了其安全性和可行性,但其短期和長期臨床療效仍需進一步研究驗證。
