Warthin樣黏液表皮樣癌、Warthin瘤合并黏液表皮樣癌及伴黏液化生3例
趙好為 韓琪 孫小欽 王韻 陳宇
口腔疾病研究國家重點實驗室 國家口腔疾病臨床醫(yī)學研究中心四川大學華西口腔醫(yī)院病理科,成都610041
Warthin瘤是良性涎腺腫瘤,幾乎都發(fā)生于腮腺[1-2]。Warthin瘤發(fā)病高峰在50~70歲之間[1]。腫瘤可發(fā)展為多中心或雙側受累,男性多于女性[1,3]。黏液表皮樣癌(mucoepidermoid carcinoma,MEC)是最常見的涎腺惡性腫瘤之一。患者年齡范圍很廣,發(fā)病高峰在30~50歲之間[4-5]。男女比例無明顯差異。大唾液腺最常見的受累部位是腮腺,小唾液腺最常見的受累部位是腭腺[6]。一般MEC分為3種類型:低惡性程度的低級別腫瘤、中惡性程度和高惡性程度的高級別腫瘤[7]。一部分MEC具有t(11;19)(q21;p13)染色體易位及相關的主導控制樣蛋白2(mastermind-like 2,MAML2)基因重排[8]。該染色體易位最常見的結果是cAMP調(diào)節(jié)的轉(zhuǎn)錄共激活因子1(CREB regulated transcription co-activator 1,CRTC1)和MAML2基因融合,產(chǎn)生嵌合蛋白CRTC1-MAML2[9]。MEC已有多種亞型,例如嗜酸性MEC、透明細胞MEC,以及2015年Ishibashi等[10]提出的Warthin樣MEC——形態(tài)上疑似Warthin瘤,但具有t(11;19)(q21;p13)易位。最近有研究[11]顯示,部分Warthin瘤與黏液表皮樣癌具有相似的染色體易位。這提示了2種腫瘤的基因上的關聯(lián)。Warthin瘤罕見與癌共存,例如鱗狀細胞癌、黏液表皮樣癌、嗜酸細胞癌、腺癌。本文報告1例Warthin樣黏液表皮樣癌,1例Warthin瘤合并黏液表皮樣癌,1例Warthin瘤伴黏液化生,并復習相關的文獻。
1 病例報告
1.1 病例1
患者女,50歲,2019年12月2日因“右腮腺包塊3年半,彩超示雙側腮腺腫塊1月”入院。3年半前患者發(fā)現(xiàn)右腮腺無痛性包塊,緩慢生長,未予重視及治療。檢查發(fā)現(xiàn)右側耳前咬肌面可觸及直徑約2.5 cm質(zhì)硬包塊,界清,活動度一般,無明顯觸壓痛。彩超結果:右側腮腺內(nèi)查見低回聲結節(jié),邊界清楚,內(nèi)部回聲欠均勻,大小約24.8 mm×14.8 mm。患者在全麻下行右腮腺包塊及腺體淺葉切除術+筋膜組織瓣形成術+游離皮片植入術。
大體觀:腺體及包塊一個,包塊大小約為2.5 cm×2 cm,切開呈囊實性,有包膜。病理檢查,低倍鏡下顯示一個形似Warthin瘤的邊界清楚的腫瘤。腫瘤由類似Warthin瘤的囊性結構和含生發(fā)中心的淋巴間質(zhì)組成。囊腔內(nèi)充滿蛋白物質(zhì)。囊腫的襯里上皮缺乏Warthin瘤典型特征:嗜酸性細胞組成雙層上皮完全缺失。上皮細胞由復層或雙層表皮樣和/或中間細胞組成,排列較雜亂,胞漿嗜酸性。上皮內(nèi)可見散在的黏液細胞(圖1)。該病例首次診斷為Warthin瘤伴黏液性化生。利用熒光原位雜交(fluorescence in situ hybridiza‐tion,F(xiàn)ISH)技術檢測MAML2基因重排,腫瘤上皮細胞結果陽性(圖1)。結合分子檢測,該病例的最終病理診斷為Warthin樣MEC。患者術后7個月未復發(fā)。
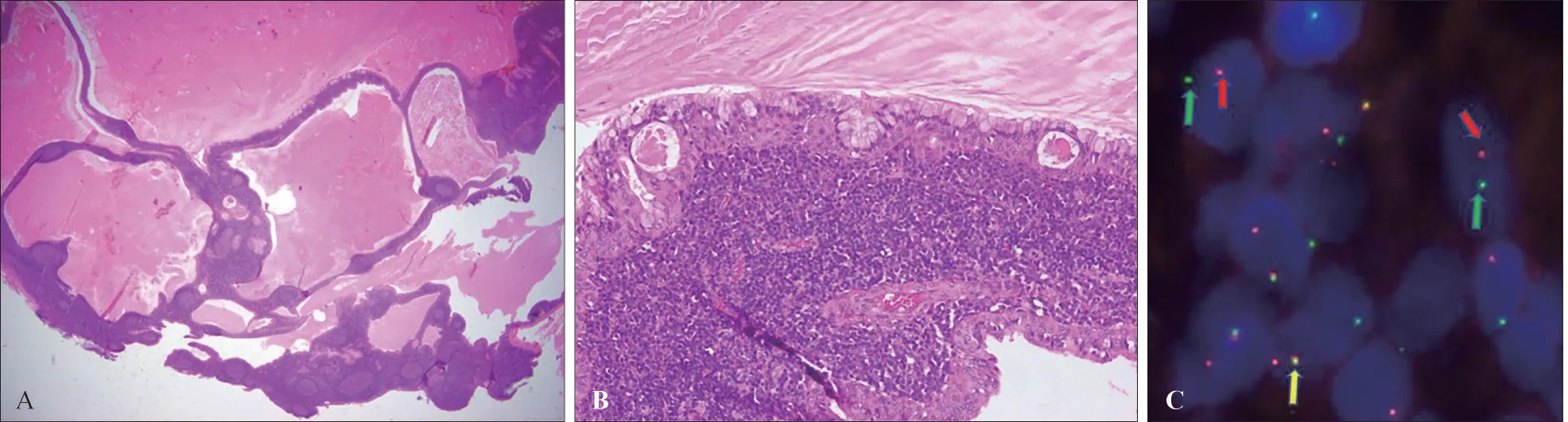
圖1 Warthin樣黏液表皮樣癌Fig 1 Warthin-like mucoepidermoid carcinoma
1.2 病例2
患者男,82歲,2020年1月6日因“發(fā)現(xiàn)左耳下包塊4年余”入院。4年多前發(fā)現(xiàn)左耳下包塊,無明顯疼痛不適,未予以重視,后病變稍長大,患者自述1月前進食補藥(具體不詳)后出現(xiàn)左耳下紅腫疼痛。檢查發(fā)現(xiàn):患者左耳下捫及大小約3.0 cm×4.0 cm的腫塊,邊界清楚,形狀規(guī)則,表面光滑,有輕微壓痛。彩超結果:左側腮腺低回聲團,考慮腮腺混合瘤。患者在全麻下行左腮腺包塊及腺體淺葉切除術+筋膜組織瓣形成術+左面部提升術+游離皮片植入術。
大體觀:紅褐色帶腺體的包塊一個,包塊大小約2.5 cm×1.5 cm。鏡下(圖2)發(fā)現(xiàn):腫瘤的一部分呈Warthin瘤的特征,腫瘤呈囊腔樣,由上皮和淋巴間質(zhì)組成,形成腺管樣和乳頭樣結構。嗜酸性上皮細胞形成經(jīng)典的雙層結構:內(nèi)層由高柱狀細胞組成,呈柵欄狀排列。基底層細胞呈立方或多邊形。腫瘤的另一部分則顯示出黏液表皮樣癌的特征:由黏液細胞、表皮樣細胞以及中間細胞組成實性巢、條索狀結構。特殊染色黏液細胞過碘酸雪夫氏染色(periodic acid schiff,PAS)、阿利辛藍染色(alcian blue,AB)、PAS消化均為陽性。免疫組織化學:CK5/6、P63表達于Warthin瘤的基底細胞。CK7主要表達于Warthin瘤的嗜酸性柱狀細胞。Ki-67在Warthin瘤部分3%~5%,MEC部分7%~10%。對該病例進行MAML2基因重排的FISH檢測(圖2)。腫瘤的MEC部分和Warthin瘤部分都被判定為陰性。根據(jù)蘇木素-伊紅染色形態(tài)學,該病例最終診斷為Warthin瘤合并黏液表皮樣癌。隨訪半年未復發(fā)。
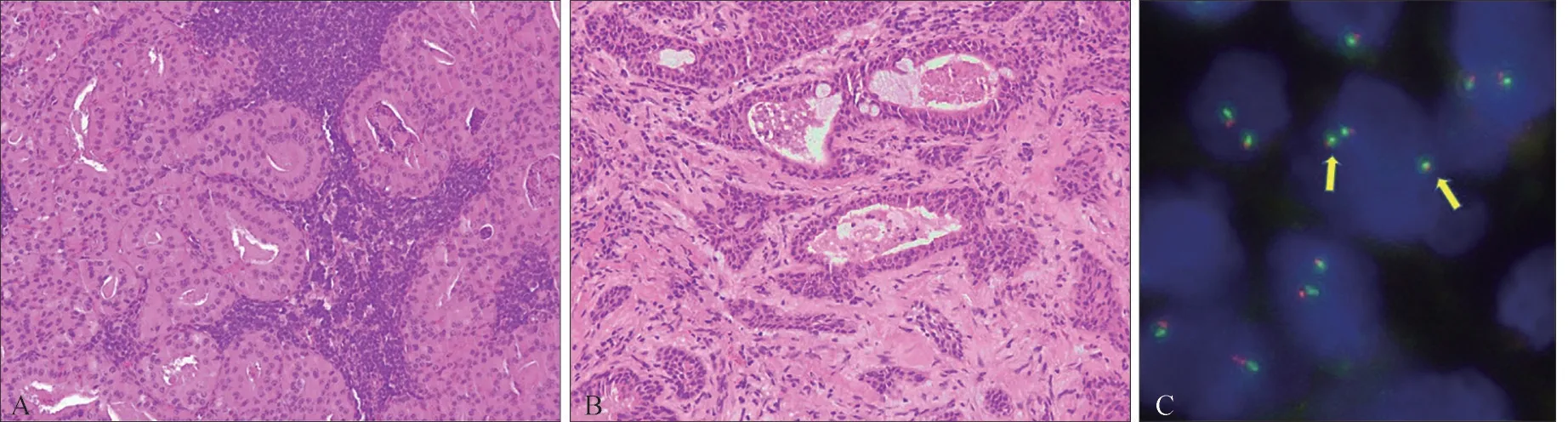
圖2 Warthin瘤合并黏液表皮樣癌Fig 2 MECco-exist with WT
1.3 病例3
患者男,32歲,2018年8月1日因“發(fā)現(xiàn)左耳下包塊1月余”入院。1月前發(fā)現(xiàn)左耳下包塊,無疼痛不適。檢查發(fā)現(xiàn)左耳下觸及大小約2 cm×2 cm質(zhì)中偏韌包塊,界清,可活動,無觸壓痛。增強CT示左側腮腺下份見大小約2.9 cm×2.3 cm稍高密度腫塊影,邊界清晰。患者在全麻下行左腮腺包塊及腺體全葉切除術+左面神經(jīng)解剖術+左面神經(jīng)簡單修復術+游離皮片植入術+筋膜組織瓣形成術。
大體觀:帶包膜的包塊一個,大小約2.8 cm×2.5 cm×2 cm,切面灰褐色。鏡下發(fā)現(xiàn),腫瘤主要由囊腔構成,內(nèi)襯復層/雙層嗜酸性上皮,周圍密集淋巴間質(zhì)。襯里上皮含豐富的黏液細胞(圖3),局部可見雙層嗜酸性上皮向復層上皮的過渡區(qū)。初步病理診斷:傾向Warthin瘤伴黏液化生,但建議做分子檢測排除Warthin瘤合并黏液表皮樣癌。FISH檢測MAML2基因重排陰性。最終診斷為Warthin瘤伴黏液化生。隨訪2年未見復發(fā)。
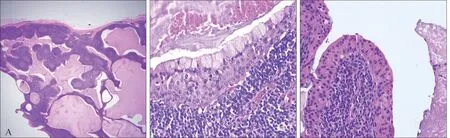
圖3 Warthin瘤伴黏液化生 蘇木素-伊紅染色Fig 3 Warthin tumor with mucinous metaplasia hematoxylin-eosin staining
2 討論
Ishibashi等[10]在2015年提出的一個新黏液表皮樣癌亞型——Warthin樣MEC。迄今僅報道了24例[12-13],本文新報道1例。Warthin樣MEC主要需要與Warthin瘤伴鱗狀化生和黏液化生鑒別。War‐thin瘤可伴有鱗狀化生或黏液化生灶,發(fā)生率大約7.5%。化生性Warthin瘤也可以稱為梗死性Warthin瘤,因為偶爾伴有廣泛的壞死、纖維化和炎癥。Warthin瘤的上皮呈經(jīng)典的雙層結構,而黏液化生則顯示為襯里上皮層次增多,含有較多黏液細胞[14]。Yorita等[15]的報道認為,黏液化生常位于腫瘤壞死區(qū)附近,壞死區(qū)以外的腫瘤未見此類化生;因此他們認為當化生病變局限在Warthin瘤壞死區(qū)附近且黏液化生的細胞不形成癌巢時,更為可能是Warthin瘤而不是MEC;另外,有廣泛化生、壞死和纖維化的Warthin瘤不會顯示出真正的侵襲性。Zhang等[16]推測黏液化生可能是囊腫內(nèi)容物的局部免疫反應有關的適應性現(xiàn)象,更多地發(fā)生在存在時間長的腫瘤中;黏液化生在正常唾液腺導管中也被觀察到,進一步說明其可能代表一種生理適應變化。光鏡下Warthin樣MEC與伴廣泛黏液化生的Warthin瘤鑒別困難,但Warthin樣MEC完全找不到Warthin瘤經(jīng)典雙層上皮結構,例如病例1;而伴廣泛化生的Warthin瘤仍能找到經(jīng)典的雙層嗜酸性上皮,例如病例3,局部可見雙層嗜酸性上皮向復層上皮轉(zhuǎn)化的過渡區(qū)。Ishibashi等[10]將MAML2重排陽性的化生性Warthin瘤重新定義為Warthin樣MEC。但筆者認為此時應盡量多部位組織取材,以蘇木素-伊紅染色鏡下結構為診斷基礎,輔以分子檢測,作出最終診斷。當然,當Warthin瘤的雙層嗜酸性上皮大部分被表皮樣細胞及黏液細胞所取代時,不應只想到Warthin瘤伴黏液化生,應當考慮到Warthin樣MEC的可能,必要時用FISH檢測輔助診斷。本報道病例1中MAML2基因重排陽性,而病例3陰性。
1975年,Gadient等[17]首次描述了Warthin瘤合并MEC。學者[18-19]的報道在鏡下也的確和病例2一樣,觀察到2種腫瘤的結構同時存在。Warthin瘤合并MEC是一種罕見的疾病,迄今僅報告了26例[3,11,14,17-27]。Warthin瘤合并MEC患者的年齡范圍為9~82歲,平均年齡51歲,男女比例為1∶1.15。所有病例均發(fā)生在腮腺。臨床表現(xiàn)為無痛、緩慢生長的面部腫塊。26例中有19例報道了腫瘤平均大小為2.8 cm(范圍0.5~6.0 cm)。
關于Warthin瘤的起源有2種說法:一種是Warthin瘤是由腮腺周圍淋巴結內(nèi)的異位涎腺導管細胞發(fā)展而來,另一種是Warthin瘤為涎腺組織內(nèi)的導管細胞異常增殖,該細胞增殖導致淋巴細胞浸潤。有研究[11]認為Warthin瘤并非真性腫瘤,其具有多中心性生長、無復發(fā)的臨床特性,并且在一些Warthin瘤中未發(fā)現(xiàn)分子改變,這些均支持非腫瘤理論。然而有報道[28]認為,一些Warthin瘤也具有t(11;19)(q21;p13)染色體易位及其相關的CRTC1-MAML融合基因,而這正是MEC的一個特征:t(11;19)(q21;p13)染色體易位存在于超過50%的MEC中[29]。這支持了Warthin瘤具有潛在異質(zhì)性發(fā)病機制的觀點,也引起關于MEC與Warthin瘤是否具有共同起源的討論。Winnes等[28]的研究發(fā)現(xiàn),MAML2重排僅在Warthin瘤的管狀結構和囊性結構襯里的形態(tài)良性的腫瘤細胞中檢測到,淋巴細胞中并未發(fā)現(xiàn)MAML2重排,但這些研究中均未提供蘇木素-伊紅染色的光鏡下結構。相反,Martins等[30]并未在7例Warthin瘤中檢測到MAML2基因重排,不過文中有1例原本診斷為Warthin瘤但后續(xù)更改診斷為Warthin瘤合并黏液表皮樣癌,并且顯示出了更復雜的t(11;16;19)(q21;p13.3;p13)染色體易位。Bell等[11]在War‐thin瘤合并黏液表皮樣癌的2種組分以及Warthin瘤癌變中均檢測到了t(11;19)(q21;p13)染色體易位。病例2中腫瘤MEC以及Warthin瘤部分均并未發(fā)現(xiàn)MAML2重排。一些研究也報道了MEC不僅限于MAML2基因重排,可能還有其他一些分子異常,如MEC有細胞周期依賴激酶抑制基因(cyclin-dependent kinase inhibitor,CDKN2A)缺失[9]等分子異常,病例2是否存在其他分子異常由于條件限制沒有做進一步檢測。
目前存在3種情況:Warthin樣MEC,Warthin瘤合并MEC以及Warthin瘤伴黏液化生。Warthin樣MEC的診斷具有挑戰(zhàn)性。伴有鱗狀和黏液化生的Warthin瘤應該高度懷疑Warthin樣MEC,以蘇木素-伊紅染色診斷為基礎,必要時FISH檢測輔助綜合判定。Warthin瘤合并MEC是一種罕見的疾病,該共存現(xiàn)象究竟是由Warthin瘤逐漸轉(zhuǎn)化為MEC而導致,還是Warthin瘤與MEC同時發(fā)生仍未知,Warthin瘤和MEC之間的真正聯(lián)系還有待深入研究。
利益沖突聲明:作者聲明本文無利益沖突。

