臨床研究樣本量的估計方法和常見錯誤
潘岳松,金奧銘,王夢星
近年來,隨著我國對臨床研究的重視,國內(nèi)腦血管病領(lǐng)域的相關(guān)研究迅速發(fā)展。樣本量估計是臨床研究設(shè)計中的核心問題之一,隨著臨床研究的發(fā)展,也越來越受到關(guān)注和重視。最近的一項統(tǒng)計顯示,N Engl J Med發(fā)表的文章中,使用樣本量計算/統(tǒng)計功效分析的在1978-1979年只有39%,而在2015年增長到了62%,是目前該雜志發(fā)表文章中使用頻率最高的統(tǒng)計學(xué)方法[1]。樣本量的正確估算直接關(guān)系到臨床研究的成敗,也一直是臨床研究者較為關(guān)注且難以把握的關(guān)鍵點之一。如果樣本量太小,研究結(jié)果的可重復(fù)性及代表性就欠佳,可能得出假陰性或假陽性的結(jié)論;如果樣本量過大,研究所需的經(jīng)費和資源就越多,項目執(zhí)行的難度也越大,而且試驗過程中對研究對象可能的潛在傷害越大,還存在倫理問題。那么,臨床研究設(shè)計時如何確定合適的樣本量呢?本文對決定樣本量估計的要素、常用的腦血管病臨床研究樣本量計算方法、樣本量估計中常見的問題等方面進行闡述,以促進腦血管病領(lǐng)域的研究者更好地掌握臨床研究樣本量估算的方法。
1 決定樣本量估計的要素
1.1 研究目的、研究設(shè)計和主要觀察指標的資料類型 臨床研究的樣本量估計首先需考慮研究目的和研究設(shè)計類型,根據(jù)不同的研究類型來選擇對應(yīng)的估計方法[2]。首先應(yīng)明確研究的目的是分析疾病發(fā)病或預(yù)后的危險因素,是驗證某項干預(yù)措施的有效性和安全性,還是評估某項新技術(shù)診斷疾病的準確性。研究目的不同,對應(yīng)的樣本量估計的考慮因素也不同。臨床研究設(shè)計類型是屬于病例對照研究,還是隊列研究、隨機對照試驗?隨機對照試驗是優(yōu)效性設(shè)計,還是非劣效性設(shè)計?暴露因素/干預(yù)措施分組是兩組還是多組?是否匹配設(shè)計?不同的臨床研究設(shè)計類型對應(yīng)的樣本量估計需考慮的因素和計算公式各不相同。在估計樣本量之前,首先要明確和充分理解研究的目的和研究設(shè)計的類型。
樣本量估計需考慮的另一個重要因素是主要觀察指標的資料類型。主要觀察指標的資料類型一般可以分為定性指標和定量指標兩種,對應(yīng)的樣本量估計方法各不相同。腦血管病臨床研究中常用于評估二級預(yù)防效果的結(jié)局指標如卒中復(fù)發(fā)、聯(lián)合血管事件發(fā)生、缺血性卒中復(fù)發(fā)等;常用于溶栓、機械取栓、神經(jīng)保護等臨床試驗的結(jié)局指標如功能預(yù)后良好(mRS 0~1分或mRS 0~2分);Ⅱ期臨床試驗常用的神經(jīng)功能惡化/好轉(zhuǎn)等指標均為二分類定性指標。對主要觀察指標為二分類定性指標的臨床研究,樣本量估計主要采用率的比較計算公式,用到的主要參數(shù)為率。常用于卒中后認知功能障礙、腦小血管病預(yù)后研究的認知功能評分等指標為定量指標,對主要觀察指標是定量指標的臨床研究,樣本量估計主要采用均數(shù)比較的計算公式,用到的主要參數(shù)為觀察指標的均數(shù)和標準差。
1.2 效應(yīng)值 暴露組或干預(yù)組間的主要觀察指標的預(yù)估效應(yīng)值大小是直接決定臨床研究所需樣本量最主要的因素之一。對于兩組比較,以Δ表示兩組總體參數(shù)(均數(shù)或率)的差值或比值。常用的效應(yīng)值包括組間MD、RD、RR、HR、OR等。一般來說,兩組的預(yù)估效應(yīng)值越大,如兩組MD或RD越大,RR、HR或OR越偏離1,所需的樣本量越小。當臨床研究是優(yōu)效性試驗或非劣效性試驗設(shè)計時,還需結(jié)合比較優(yōu)效性界值或非劣效性界值來確定樣本量。
1.3 變異度 一般用方差或標準差反映組間觀察指標的總變異程度。兩組定量指標(均數(shù))的比較,其方差可通過兩組樣本方差估計。兩組定性指標(率)的比較,其方差可通過兩組樣本率估計。一般情況下,變異度,即方差越大,所需樣本量越大。事件率越接近0.5,所需樣本量越小。
1.4 檢驗水準 檢驗水準α,即Ⅰ型錯誤的概率,是指錯誤地拒絕了實際成立的原假設(shè)H0,錯誤地判定為有差異的概率大小。α越小,所需樣本量越大。α的取值常為雙側(cè)0.05或0.1,優(yōu)效或非劣效試驗設(shè)計中常取值為單側(cè)0.025。
當需要多重檢驗時,如設(shè)置了多個主要療效指標、擬進行多組間兩兩比較或在試驗過程中設(shè)計了期中分析,需進行多次比較分析的情況下,則會使Ⅰ型錯誤增加,需對α進行校正。在這一過程中要進行多次重復(fù)顯著性檢驗,每進行一次檢驗都將增加Ⅰ型錯誤的概率,從而使總的顯著性水平α上升。如,以檢驗水準α=0.05,重復(fù)進行10次檢驗為例,發(fā)生Ⅰ型錯誤的總概率將上升到0.19。常用的調(diào)整檢驗水準α的方法,如Bonferroni法,調(diào)整后的α’=α/k(k為統(tǒng)計檢驗的次數(shù)),如總共需進行3次檢驗,則α’=0.05/3,為0.0167。成組序貫研究設(shè)計包含了期中分析,為了使總體顯著性水平維持常數(shù)α,必須調(diào)整每一次分析的顯著性水平,常用的調(diào)整α水平的方法包括Pocock法、O’Brien-Fleming法和Peto法等[3]。
1.5 把握度 把握度,即檢驗效能,是指所研究對象總體間確有差異時,按檢驗水準α能夠發(fā)現(xiàn)此差異的概率。把握度=1-β,其中β為Ⅱ型錯誤的概率,因此指定了β水平也就等于指定了把握度水平。把握度越大,所需樣本量越大,通常將其定為0.80或0.90。一般建議臨床試驗把握度定為0.90。
1.6 其他因素 除了上述主要因素外,其他因素如兩組例數(shù)的分配比例、優(yōu)效性與非劣效性界值、不應(yīng)答或失訪率等均可影響樣本量的估計[4]。一般而言,兩組比較時取相等的樣本含量,此時總的樣本含量最少,且可達到最高的統(tǒng)計效能,因此經(jīng)常使用的是各組等樣本含量設(shè)計。但是,由于某些實際原因,有時可能需要進行各組不等樣本含量設(shè)計,在進行樣本量估計時也應(yīng)予以考慮。通過樣本量估算公式計算得到樣本量后,一般要考慮不應(yīng)答或失訪的影響,增加相應(yīng)的樣本量,以確保實際收集的有效病例數(shù)能足夠達到統(tǒng)計要求。如考慮失訪的影響,可將最后的樣本量定為N’=N/(1-失訪率)。
2 樣本量估計的思路
不同的臨床研究設(shè)計樣本量估計方法也不同,樣本量估計的思路非常重要(表1)。與臨床研究樣本量估計相關(guān)的最核心的參數(shù)是“兩組主要觀察指標的預(yù)估值”。在根據(jù)樣本量估計公式計算之前,需要先明確3個問題:①研究的目的是什么?采用什么樣的設(shè)計?②研究的主要觀察指標是什么?③主要觀察指標有預(yù)估值嗎?其中,研究目的、研究設(shè)計和主要結(jié)局指標在研究方案設(shè)計時應(yīng)該就已經(jīng)確定了。而主要觀察指標的預(yù)估值,則可通過預(yù)試驗或總結(jié)前期數(shù)據(jù)、查閱文獻及結(jié)合專家意見,由臨床專家和統(tǒng)計學(xué)專家聯(lián)合確定。確定了上述3個問題的答案,就確定了研究樣本量估計時需要用到的參數(shù)及參數(shù)的大小,之后將數(shù)據(jù)代入樣本量計算公式,采用軟件計算即可。常用的PASS、SAS、Stata等統(tǒng)計軟件以及一些公眾網(wǎng)站和微信小程序都可以方便地實現(xiàn)樣本量的計算[5]。

表1 樣本量估計的思路
3 常見的臨床研究設(shè)計樣本量估計方法
3.1 臨床登記隊列樣本量估計 在腦血管病臨床研究中,最常見的研究設(shè)計類型是臨床專病隊列,用于探討基線預(yù)后影響因素與患者預(yù)后的關(guān)系。根據(jù)危險因素的有無或高低可分為兩組,進而比較兩組卒中復(fù)發(fā)率的差異或檢驗暴露因素與患者預(yù)后的關(guān)系。兩樣本率比較的樣本量估計可采用公式①進行計算。其中p1與p2分別代表兩組的率,p=(p1+p2)/2。有時實際得到的是對照組的率p1和效應(yīng)值RR或OR值,可通過公式p2=RR×p1或公式p2=(OR×p1)/[1+p1×(OR-1)]進行轉(zhuǎn)化。Z1-α/2和Z1-β分別為α和1-β對應(yīng)的標準正態(tài)分布臨界值。實際工作中,可進一步考慮兩組不等比例、混雜因素的影響等對樣本量做進一步調(diào)整,擴大樣本量。

示例:某研究者擬進行一項臨床登記研究探討基線糖尿病狀態(tài)與卒中患者1年卒中復(fù)發(fā)的關(guān)系。前期資料顯示糖尿病的RR值為1.3,無糖尿病人群的一年卒中復(fù)發(fā)率為8%,取α=雙側(cè)0.05,β=0.20,考慮失訪率為10%,計算得所需樣本量為2529例/組。
3.2 優(yōu)效性臨床試驗兩樣本率比較 優(yōu)效性臨床試驗的目的是評價試驗干預(yù)措施是否優(yōu)于對照措施(陽性或安慰劑對照)。如雙聯(lián)抗血小板治療對比單聯(lián)抗血小板治療的試驗、機械取栓對比傳統(tǒng)治療的試驗均多采用這種研究設(shè)計[6-7]。兩樣本率比較優(yōu)效性臨床試驗的樣本量估計可采用公式②進行計算。其中p1與p2分別代表兩組率,p=(p1+p2)/2,Δ為優(yōu)效性界值。Δ一般取具有臨床意義的最小值,由臨床專家與統(tǒng)計學(xué)專家協(xié)商確定。當Δ=0時,優(yōu)效性檢驗相當于兩樣本率比較的樣本量計算方法。
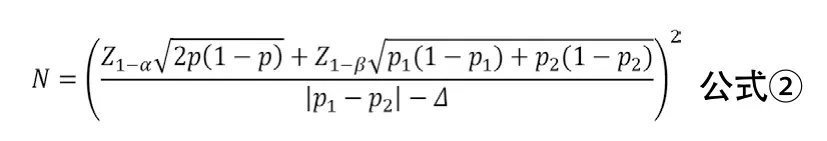
示例:某試驗擬比較阿司匹林聯(lián)合氯吡格雷雙聯(lián)抗血小板治療與單用阿斯匹林治療對預(yù)防卒中復(fù)發(fā)的療效,根據(jù)前期的文獻報告,預(yù)設(shè)阿司匹林聯(lián)合氯吡格雷雙聯(lián)抗血小板治療組3個月卒中復(fù)發(fā)率為8%,單用阿斯匹林治療組3個月卒中復(fù)發(fā)率為10%,優(yōu)效性界值Δ=0,α=0.025,β=0.10,考慮失訪率為5%,計算得所需樣本量為4528例/組。
3.3 非劣效性臨床試驗兩樣本率比較 非劣效性臨床試驗的目的是評價試驗干預(yù)措施在臨床意義上不差于(非劣于)對照措施(通常為已上市的有效藥物或標準治療方案),目的是探索新的治療選擇。這種情況常用于原有上市藥物的療效較好,試驗藥的療效超過標準治療措施的可能性較小,預(yù)計研究藥物的療效與原有上市藥物相當,但研究藥物可能具有其他特點,在其他方面可能有優(yōu)勢,如更好的安全性、使用更方便或依從性更好等。隨著藥物研發(fā)的深入,近年來采用非劣效性設(shè)計的試驗越來越普遍。腦血管病臨床研究中如比較低劑量對比標準劑量阿替普酶溶栓、直接取栓對比橋接取栓、取栓前替萘普酶對比阿替普酶溶栓等試驗多采用這種設(shè)計[8-10]。
兩樣本率比較的非劣效性臨床試驗的樣本量估計可采用公式③進行計算。其中p1與p2分別代表兩組率,p=(p1+p2)/2,Δ為非劣效性界值。非劣效性臨床試驗通常設(shè)兩組的率相等。Δ一般由臨床專家與統(tǒng)計學(xué)專家根據(jù)既往研究證據(jù)結(jié)合臨床意義共同確定,并最終由臨床專家確認。統(tǒng)計上可采用兩步法估算,先估計出陽性對照藥物相對于安慰劑為對照的絕對療效M1,一般取小于陽性對照與安慰劑效應(yīng)之差的95%CI下限(高優(yōu)指標)[11]。臨床可接受的非劣效性界值M2一般通過M2=f×M1計算確定,建議非劣效設(shè)計中取f=0.5。在沒有歷史數(shù)據(jù)可依據(jù)時,Δ的確定也可根據(jù)目標值法取值為陽性對照藥物療效的10%~15%。
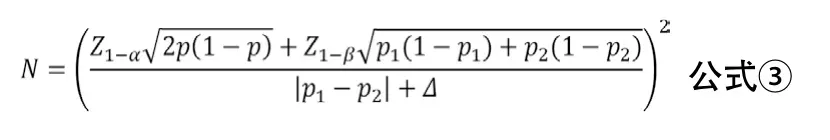
示例:某試驗采用非劣效性試驗設(shè)計,擬檢驗直接取栓治療患者3個月預(yù)后良好的比例不劣于橋接取栓治療的患者。根據(jù)前期數(shù)據(jù)和文獻報告,預(yù)設(shè)兩組患者3個月預(yù)后良好率為60%,非劣效性界值Δ=5%,α=0.025,β=0.10,考慮失訪率為5%,計算得所需樣本量為2124例/組。
以上為腦血管病臨床研究中常見的樣本量估計方法,特殊類型研究,如整群隨機對照臨床試驗、適應(yīng)性設(shè)計臨床試驗、單組目標值試驗、診斷性試驗等的樣本量計算,以及兩樣本均數(shù)比較的樣本量估計方法,可參閱相關(guān)文獻,因為篇幅的限制,本文不作詳述。
4 樣本量估計的常見錯誤
4.1 沒經(jīng)過計算直接確定樣本量 部分研究者在撰寫臨床研究方案時,未經(jīng)過計算就直接確定樣本量(如100例或200例)。這種確定樣本量的做法可能導(dǎo)致樣本量不足,達不到統(tǒng)計學(xué)檢驗的要求,得不到預(yù)期的研究結(jié)果。不過,對于因?qū)嶋H情況限制無法入組過多的研究,或研究本身的目的是為了進行預(yù)試驗探索方案的可行性、初步探索干預(yù)措施的療效和安全性,可不按照樣本量估計的例數(shù)入組,但應(yīng)對預(yù)試驗的研究目的給予明確說明。
4.2 樣本量估計方法與研究設(shè)計和主要觀察指標不對應(yīng) 在樣本量估計過程中,最常見的錯誤之一是樣本量估計方法與研究設(shè)計和主要觀察指標不對應(yīng)。如:研究的目的是采用隊列研究設(shè)計驗證基線時某指標升高與卒中預(yù)后的關(guān)系,但樣本量估計時卻依據(jù)1年卒中復(fù)發(fā)率,采用率的橫斷面調(diào)查公式的方法進行樣本量估計;或者,臨床試驗中設(shè)置的主要觀察指標為3個月預(yù)后良好的比例,但因為缺少前期數(shù)據(jù),主要觀察指標無法預(yù)估,在樣本量估計時采用了3個月卒中復(fù)發(fā)率作為計算的依據(jù)。樣本量的估計方法應(yīng)與研究目的、研究設(shè)計和主要觀察指標相對應(yīng),否則無法得到預(yù)期的效果。
4.3 參數(shù)設(shè)置不合理 樣本量估計的另一個常見錯誤是樣本量估算的參數(shù)設(shè)置缺乏依據(jù),或參數(shù)設(shè)置不合理、不符合臨床實際情況。如:為節(jié)省樣本量有意夸大事件率或預(yù)期的效應(yīng)值,或設(shè)置的脫落率和失訪率過高,設(shè)置的參數(shù)明顯不符合臨床的實際情況。上述情況都可能導(dǎo)致樣本量估計不準確,從而使研究達不到預(yù)期的研究效度。
總之,在臨床研究的過程中,樣本量既不是越大越好,也不是越小越好。合理的樣本量是臨床研究科學(xué)設(shè)計的重要環(huán)節(jié),與研究設(shè)計的其他環(huán)節(jié)密切相關(guān),估計過程應(yīng)充分理解和考慮研究目的、研究設(shè)計和主要觀察指標的資料類型。樣本量需要臨床專家和統(tǒng)計學(xué)專家合作討論確定,選擇正確的計算方法和公式,合理設(shè)置參數(shù),并進行科學(xué)的計算才能保證其準確無誤。

