Gomisin M1協同氟康唑對耐藥白念珠菌毒力因子的作用研究
王應仙,李 俊,秦定梅,張路梅,王夢如,袁 愷,廖一川,李家生,肖偉烈1, *,王睿睿*
Gomisin M1協同氟康唑對耐藥白念珠菌毒力因子的作用研究
王應仙1, 4,李 俊1, 4,秦定梅1, 4,張路梅1, 4,王夢如2,袁 愷3,廖一川1, 4,李家生1, 4,肖偉烈1, 2*,王睿睿1, 4*
1. 云南中醫藥大學中藥學院,云南 昆明 650500 2. 云南大學 自然資源藥物化學教育部重點實驗室和云南生物資源保護與利用國家重點實驗室,云南 昆明 650500 3. 云南中醫藥大學第二臨床醫學院,云南 昆明 650500 4. 云南省民族特色養生理論與健康產品工程實驗室,云南 昆明 650500
探討gomisin M1(從五味子科植物中提取的木脂素類成分)聯合氟康唑抗耐藥白念珠菌的作用及其機制。采用倍比微量稀釋法檢測gomisin M1聯合氟康唑對白念珠菌的最小抑菌濃度;通過時間-生長曲線動態觀察gomisin M1聯合氟康唑對白念珠菌的抑制作用;采用倒置顯微鏡觀察gomisin M1聯合氟康唑在Spider和SD+10%胎牛血清(fetal bovine serum,FBS)液體培養基中對白念珠菌菌絲生長的影響;采用卵黃瓊脂平板法測定gomisin M1聯合氟康唑對白念珠菌胞外磷脂酶活性的影響;采用qRT-PCR法檢測gomisin M1聯合氟康唑對白念珠菌菌絲相關基因及水解酶相關基因表達的影響。Gomisin M1聯合氟康唑對耐藥白念珠菌具有明顯的抑制作用,并能明顯抑制耐藥白念珠菌菌絲的生長;Gomisin M1聯合氟康唑能夠降低白念珠菌胞外磷脂酶活性,顯著下調菌絲相關基因、、增強絲狀生長蛋白1(enhanced filamentous growth protein 1,)、細胞伸長蛋白1(cell elongation protein 1,)、凝集素樣蛋白3(agglutinin-like protein 3,)、菌絲壁蛋白(hyphal wall protein,)和水解酶相關基因分泌型天冬氨酸蛋白酶1(secreted aspartyl protease 1,)、、以及磷脂酶B1(phospholipase B1,)的表達(<0.05、0.01)。Gomisin M1協同氟康唑能夠抑制耐藥白念珠菌菌絲形成相關蛋白和胞外磷脂酶等毒力因子的表達,從而發揮抗菌作用。
gomisin M1;氟康唑;白念珠菌;耐藥性;毒力因子
白念珠菌是一種與人體共生的機會性致病真菌,存在于宿主皮膚、口腔、胃腸道、泌尿生殖道的黏膜上。在健康宿主中不引起疾病,但是當宿主免疫力、內環境菌群和其他因素改變時,可導致白念珠菌過度生長,進而引起淺表黏膜感染,甚至發展成為侵襲性念珠菌病[1]。白念珠菌引起的侵襲性真菌感染的發病率逐年上升,死亡率超過40%[2]。目前抗真菌藥物效率低、可利用度低、對宿主的不良反應多,加之臨床用藥的不合理導致耐藥等問題,真菌防治面臨嚴峻的挑戰[3-4]。因此,尋找新型、有效、低毒的抗真菌藥物或新靶點的協同增效真菌藥物具有重要的意義。
五味子科植物是一類重要的藥用植物,歷史悠久、藥效良好、分布廣泛,主要成分為木脂素類、萜類、揮發油類和有機酸類[5]。其中木脂素類化合物藥理作用廣泛,涉及消化系統、心血管系統、中樞神經系統、生殖系統等方面[6]。Gomisin M1(GM1,圖1)是從五味子科植物中提取的木脂素類化合物[7],具有清除自由基、抗艾滋病等作用[8-9]。本課題組前期研究發現GM1具有協同氟康唑抑制耐藥白念珠菌的活性,本研究旨在闡明GM1協同氟康唑抗白念珠菌的機制,為進一步開發聯合抗耐藥真菌藥物提供靶點和研究思路。

圖1 GM1結構式
1 材料
1.1 菌株
白念珠菌SC5314(ACTT?MYA-2876TM)購自美國ATCC菌種保藏中心;SC5314氟康唑耐藥菌(SC5314-FR):用氟康唑誘導敏感菌SC5314使其對氟康唑耐藥;ATCC10231氟康唑耐藥菌(ATCC10231-FR):用氟康唑誘導標準株ATCC10231使其對氟康唑耐藥,ATCC10231(ACTT?10231-MINI-PACKTM)由中科院昆明植物研究所白雪工程師惠贈;CA23、CA187、CA381、CA808、CA4508均為臨床分離菌株,由昆明醫科大學第一附屬醫院皮膚性病科李玉葉教授惠贈。
1.2 藥品與試劑
GM1由云南大學教育部自然資源藥物化學重點實驗室肖偉烈研究員提取所得,質量分數為99.044%;氟康唑分散片(批號200117)購自南昌弘益藥業有限公司;二甲基亞砜(DMSO,批號EZ6789B127)購自天津市化學試劑一廠;沙氏液體培養基(批號1097061)、沙氏固體培養基(批號1106401)購自環凱微生物科技有限公司;無菌PBS溶液(批號GP20060700911)購自武漢塞維爾生物科技有限公司;cDNA逆轉錄試劑盒(批號0000499195)、qRT-PCR試劑盒(批號0000497768)購自美國Promega公司;Trizol(批號252612)購自上海羅氏制藥有限公司;氯仿(批號20191015)購自汕滇藥業有限公司;營養肉湯Nutrient Broth(批號531F031)購自北京索萊寶科技有限公司;甘露醇(批號20181010)購自北京博奧拓達科技有限公司;磷酸氫二鉀(批號181024)購自西隴科學股份有限公司;Yeast Nitrogen Base(YNB,批號PM291712100)購自北京酷來搏科技有限公司;葡萄糖(批號EZ2811F128)購自廣州賽國生物科技有限公司;胎牛血清(fetal bovine serum,FBS,批號2148169CP)購自美國Gibco公司;環磷腺苷(cycle adenosine monophosphate,cAMP,批號66069)購自美國MCE公司。
1.3 儀器
生物安全柜(新加坡ESCO公司);HWS-250型恒溫恒濕培養箱(上海雙旭電子有限公司);AR24CN型電子分析天平(美國奧豪斯實驗室儀器有限公司);Plus 384酶標儀(美國Molecular Devices公司);血細胞計數板(上海求精生化試劑儀器有限公司);96孔細胞培養板(無錫耐思生命科技股份有限公司);低溫高速離心機(德國Eppendorf公司);倒置生物顯微鏡(德國卡爾蔡司公司);Nanodrop超微量分光光度計(美國Thermo Fisher Scientific公司);LihgtCycler qRT-PCR儀(上海羅氏制藥有限公司)。
2 方法
2.1 菌懸液的制備與培養基的配制
2.1.1 菌懸液的制備 實驗所用白念珠菌菌種采用30%甘油保存于?80 ℃冰箱,用接種環取適量菌液稀釋后在沙氏瓊脂培養基上復蘇,37 ℃恒溫培養24 h后,挑取單一菌落在沙氏瓊脂培養基繼續培養24 h,連續傳代2次,使菌株處于最佳生長狀態,血細胞計數板計數,沙氏液體培養基稀釋至1×105CFU/mL備用。
2.1.2 Spider液體培養基的配制 稱取營養型肉湯Nutrient Broth 3 g,加入300 mL純水,115 ℃高壓滅菌30 min,冷卻至60 ℃,加入甘露醇3 g、磷酸氫二鉀0.6 g,混勻,冷卻后于4 ℃冰箱保存備用。
2.1.3 SD液體培養基的配制 分別量取255、15、30 mL純水于3個試劑瓶中,115 ℃高壓滅菌15 min,純水冷卻至60 ℃,將2.01 g 1×YNB倒入裝有10 mL純水的試劑瓶中,4 g葡萄糖倒入裝有20 mL純水的試劑瓶中,分別混勻后,再將3種不同溶液混在一起,搖勻,冷卻至室溫后置于4 ℃冰箱備用。
2.2 最小抑菌濃度(minimum inhibitory concentration,MIC)的測定[10]
精密稱取50 mg GM1溶于0.5 mL DMSO,配制成質量濃度為100 mg/mL的GM1儲備液,于4 ℃保存備用;取1片氟康唑分散片研成粉末后加入1 mL DMSO,配制成質量濃度為50 mg/mL的氟康唑儲備液,于4 ℃保存備用。
用沙氏液體培養基將GM1和氟康唑儲備液分別稀釋為400 μg/mL,作為初始最大質量濃度,接著采用5倍倍比稀釋法進行稀釋,設置空白組(無藥無菌)、對照組(無藥有菌)、氟康唑組、GM1組及GM1聯合氟康唑組。各孔中DMSO的含量均低于1%。將制備好的培養板置于37 ℃恒溫恒濕培養箱中培養24 h,用酶標儀測定625 nm處的吸光度()值,計算抑制率、抑菌80%的最小濃度(MIC80)和部分抑菌聯合指數(fractional inhibitory concentration index,FICI),上述實驗重復操作3次。其中FICI≤0.5為協同作用,0.5<FICI≤4為無相互作用,FICI>4為拮抗作用。
抑菌率=1-(實驗-空白)/(對照-空白)
FICI=MICAB/A+MICAB/B
A、B分別為2藥單用時的MIC值,MICAB為2藥聯用時的MIC值;藥物單用時若無MIC值,則使用藥物最大濃度的2倍代替MIC值進行計算
2.3 時間-生長曲線
取對數生長期的白念珠菌置于沙氏液體培養基中,調整菌懸液濃度為1×105CFU/mL,制備含藥或不含藥的白念珠菌細胞懸浮液,設置對照組(無藥有菌)、氟康唑(24 μg/mL)組、GM1(12、24 μg/mL)組及GM1聯合氟康唑組,恒溫搖床37 ℃、150 r/min振蕩培養48 h。分別于0、2、4、6、8、12、16、24、36、48 h,于超凈工作臺下取樣200 μL,檢測625 nm波長下的值。以時間為橫坐標,所測得的值為縱坐標繪制曲線,得到不同質量濃度藥物對白念珠菌的生長曲線。
2.4 倒置顯微鏡觀察真菌形態
設置對照組(無藥有菌)、氟康唑(24 μg/mL)組、GM1(24 μg/mL)組及GM1聯合氟康唑組,分別用SD+10% FBS和Spider液體培養基制備含藥或不含藥的白念珠菌細胞懸浮液,菌懸液濃度為1×105CFU/mL,37 ℃恒溫恒濕培養箱中孵育,于2、4、8 h采用倒置顯微鏡拍照,觀察各組菌絲生長情況。
2.5 GM1聯合氟康唑對白念珠菌細胞外磷脂酶活性的影響
設置對照組(無藥有菌)、氟康唑(24 μg/mL)組、GM1(24 μg/mL)組及GM1聯合氟康唑組,取對數生長期的白念珠菌置于沙氏液體培養基中,制備含藥或不含藥的白念珠菌細胞懸浮液,菌懸液濃度均為1×105CFU/mL。吸取10 μL菌液滴加至卵黃培養基上,每組設計3個重復樣本,于37 ℃恒溫恒濕培養箱中培養72 h。觀察到菌落周圍產生大小不同的沉淀圈,用尺子測定菌落直徑和沉淀圈直徑,兩者的比值稱為Pz,磷脂酶活性由Pz值表示。其中,Pz=1,表明磷脂酶陰性;Pz=0.90~0.99,表明磷脂酶活性極低;Pz=0.80~0.89,表明磷脂酶活性低;Pz=0.70~0.79,磷脂酶活性高;Pz≤0.69,表明磷脂酶活性極高。
2.6 GM1聯合氟康唑對白念珠菌菌絲相關基因、水解酶相關基因表達的影響
2.6.1 菌株樣品的制備 取對數生長期的白念珠菌置于沙氏液體培養基中,制備含藥或不含藥的白念珠菌細胞懸浮液,設置對照組(無藥有菌)、氟康唑(24 μg/mL)組、GM1(24 μg/mL)組及GM1聯合氟康唑組,菌懸液濃度均為1×105CFU/mL。各組在37 ℃、150 r/min恒溫搖床培養16 h,離心,用PBS溶液清洗3次,收集細胞沉淀備用。
2.6.2 液氮研磨法提取總RNA和cDNA的合成 液氮研磨法將“2.6.1”項下的菌沉淀提取RNA,用超微量紫外分光光度儀測定RNA濃度,并用1%瓊脂糖凝膠電泳測定RNA純度,然后按反轉錄試劑盒說明書將RNA反轉錄為cDNA,采用20 μL的體系,加入RNA的總量為1000 ng。
2.6.3 qRT-PCR分析 菌絲相關基因、、增強絲狀生長蛋白1(enhanced filamentous growth protein 1,)、細胞伸長蛋白1(cell elongation protein 1,、凝集素樣蛋白3(agglutinin-like protein 3,)、菌絲壁蛋白(hyphal wall protein,)和水解酶相關基因分泌型天冬氨酸蛋白酶1(secreted aspartyl protease 1,)、、以及磷脂酶B1(phospholipase B1,)、引物序列見表1,將引物稀釋為10 μmol(現配現用),設計96孔板上樣順序,每個樣品設3個復孔,用水為模板作陰性對照。qRT-PCR反應體系為20 μL,采用3步法進行PCR擴增。擴增反應結束后,以各基因的表達情況2?ΔΔCt值法進行相對定量分析。
2.7 外源性cAMP實驗
設置對照組(無藥有菌)、氟康唑(24 μg/mL)組、GM1(24 μg/mL)組及GM1聯合氟康唑組,分別用SD+10% FBS和Spider液體培養基制備8份含藥或不含藥的白念珠菌細胞懸浮液,其中4份加入終濃度為10 mmol/L的cAMP,其余4份不加cAMP,調整菌量為1×105CFU/mL,于37 ℃恒溫恒濕培養箱中孵育8 h后,采用倒置顯微鏡拍照,觀察各組菌絲形態。
表1 引物序列
Table 1 Primer sequences
引物序列(5’-3’)長度/bp RAS1F: GTGGTGTTGGTAAATCCGCTT178 R: TCATGGCCAGATATTCTTCTTGTC CDC35F: ACTTGGTGACTGCAGACTGG110 R: ACCCATACGAACCGACAACC EFG1F: AATGTGGCCCAAATGACACG131 R: GCCATGGCCAATGCTCTTTC ECE1F: GCCACTGGTGTTCAACAATCC123 R: AGTTTCCAGGACGCCATCAA ALS3F: TGTTCCTGCCGGTTATCGTC124 R: GAAAGGTGCACGTTGCCAAT HWP1F: CCGGAATCTAGTGCTGTCGT185 R: GCAGCACCGAAAGTCAATCTC SAP1F: GCTACGCTAACGGTCAACCT170 R: AGCAGCAATGTTTGAAGCAGA SAP2F: CAATGAAGCCGGTGGTAG108 R: GTGGCAGCATCTGGAGAA SAP3F: TCAAGCTGGTCAAGGACAAGA196 R: ATCGGCAAATTGTTGCTTTGTG SAP4F: TGCCGATGGTTCTGTTGC154 R: CCTGGTGGCTTCGTTGCT PLB1F: CATTCAGTGGCGGAGGGTAT155 R: TCCAACTAACCACGATCCACC PLB2F: TGGGAGAGCTTTGAGTCACC154 R: GAGCACAGTGTTTGGTTCCC ACT1F: ACGGTGAAGAAGTTGCTGCT180 R: TGGATTGGGCTTCATCACCA
2.8 統計學方法
3 結果
3.1 GM1聯合氟康唑對耐藥白念珠菌的抑制作用
采用微量稀釋法測定GM1聯合氟康唑對耐藥白念珠菌的抑制作用,如表2所示,GM1和氟康唑單用對多株耐藥白念珠菌均無效,但二者聯用抑菌效果明顯,FICI均小于0.5,表現出顯著協同作用。
3.2 時間-生長曲線
7株耐藥株的MIC值都相差不大,且CA23菌相比其他6株較穩定,易于培養,故選定CA23為研究菌株。繪制不同質量濃度的藥物作用于白念珠菌的時間-生長曲線,如圖2所示,對照組、氟康唑組和GM1組的菌體生長周期大致相同,而GM1聯合氟康唑組在8~36 h的值均低于對照組,說明GM1聯合氟康唑組在8~36 h對CA23的生長具有顯著的抑制作用。
表2 GM1聯合氟康唑對耐藥白念珠菌的抑制作用
Table 2 Inhibitory effects of GM1 combined with fluconazole on drug-resistant C. albicans
菌株MIC/(μg·mL?1)FICI 氟康唑GM1氟康唑+GM1 CA23>200>20024.30±1.870.12 CA187>200>20022.92±0.760.11 CA381>200>20025.93±1.220.13 CA808>200>20024.57±1.080.12 CA4508>200>20025.37±0.040.13 SC5314-FR>200>20024.15±2.350.12 ATCC10231-FR>200>20026.02±1.010.13
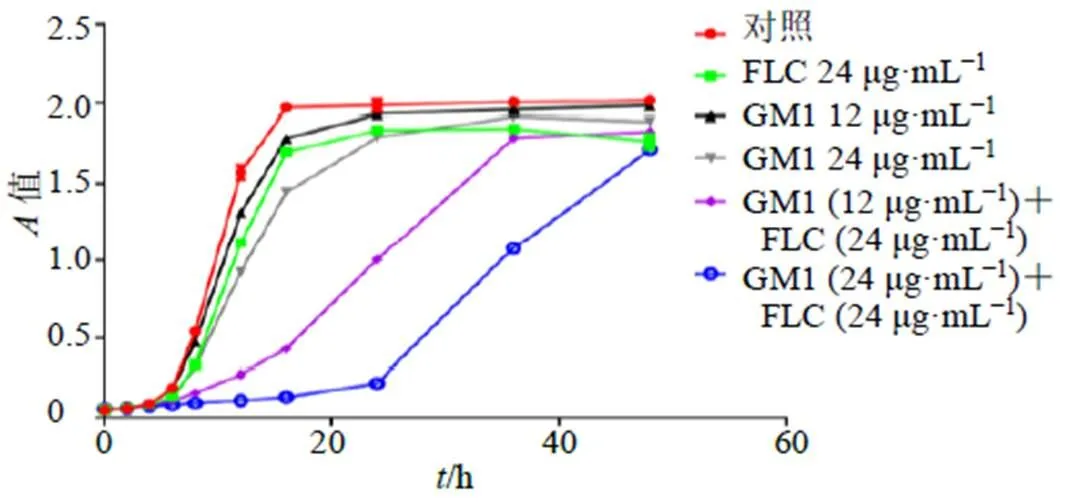
FLC-氟康唑,下同
3.3 GM1聯合氟康唑對耐藥白念珠菌菌絲形成的影響
通過倒置顯微鏡觀察GM1聯合氟康唑對耐藥白念珠菌菌絲形成的影響,如圖3所示,在Spider和SD+10% FBS液體培養基中,對照組的白念珠菌在2 h能形成較長且交錯的菌絲,隨著時間的推移,8 h能形成致密、錯綜復雜、相互纏繞重疊的菌絲;氟康唑單用對耐藥白念珠菌菌絲的形成無明顯的抑制作用;GM1單用在SD+10% FBS液體培養基無抑制作用,而在Spider液體培養基中有一定的抑制作用;但GM1聯合氟康唑后,在2種液體培養基中都能顯著抑制耐藥白念珠菌菌絲的形成。

圖3 GM1聯合氟康唑對SD+10% FBS (A) 和Spider液體培養基(B) 中耐藥白念珠菌菌絲形成的影響 (×200)
3.4 GM1聯合氟康唑對白念珠菌細胞外磷脂酶活性的影響
采用卵黃瓊脂平板法測定GM1聯合氟康唑對白念珠菌胞外磷脂酶的活性,Pz值越低,表明磷脂酶產生越多,活性越強。如表3所示,對照組磷脂酶活性極高,加入氟康唑后可輕微抑制磷脂酶活性,加入GM1未影響磷脂酶活性,但當二者聯用時,白念珠菌胞外磷脂酶活性顯著降低。表明GM1聯合氟康唑可以抑制白念珠菌胞外磷脂酶的活性,從而發揮抗真菌作用。
表3 GM1聯合氟康唑對白念珠菌細胞外磷脂酶活性的影響
Table 3 Effect of GM1 combined with fluconazole on extracellular phospholipase activity of C. albicans
組別劑量/(μg·mL?1)Pz磷脂酶活性 對照—0.67±0.02極高 FLC240.77±0.03高 GM1240.69±0.03極高 GM1+FLC24+240.88±0.03低
3.5 GM1聯合氟康唑對白念珠菌菌絲相關基因和水解酶相關基因表達的影響
采用qRT-PCR法檢測GM1聯合氟康唑對耐藥白念珠菌菌絲相關基因表達的影響,如圖4所示,與對照組相比,GM1聯合氟康唑組、、、、、基因表達水平顯著下調(<0.01)。
為了評價GM1聯合氟康唑對耐藥白念珠菌水解酶的作用,采用qRT-PCR法測定、、和的表達。如圖5所示,與對照組相比,GM1聯合氟康唑組胞外磷脂酶活性相關基因和分泌型天冬氨酸蛋白酶相關基因、、的表達水平顯著降低(<0.05、0.01),說明GM1與氟康唑聯用可以抑制白念珠菌磷脂酶和分泌型天冬氨酸蛋白酶活性,從而發揮抗真菌作用。

與對照組比較:*P<0.05 **P<0.01,圖5同
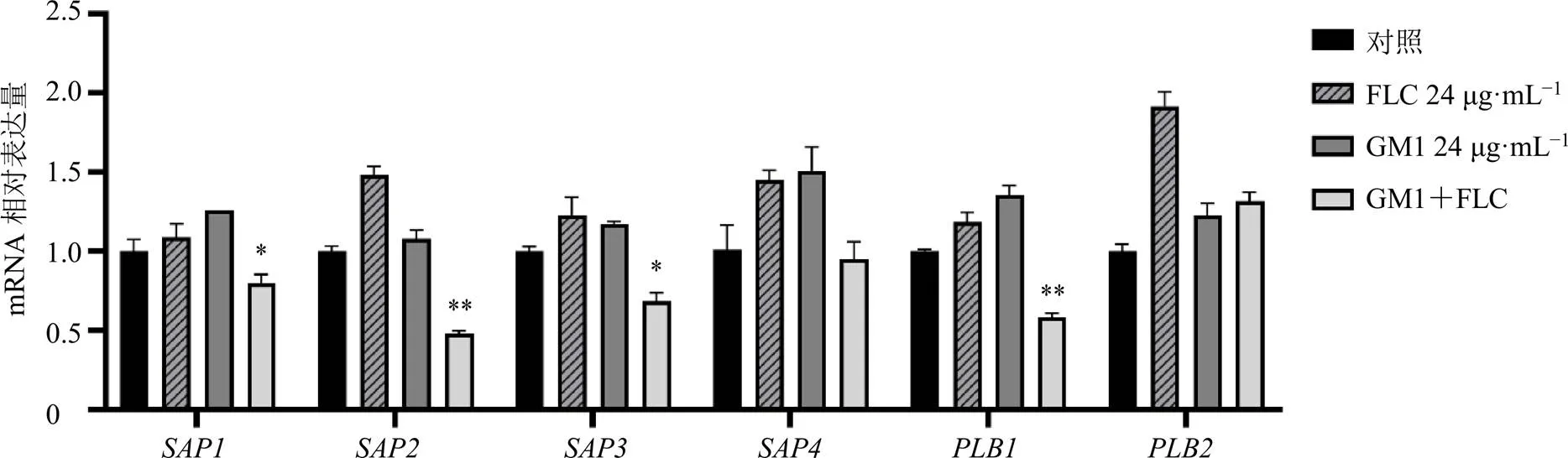
圖5 GM1聯合氟康唑對白念珠菌水解酶相關基因表達的影響
3.6 外源性cAMP實驗
cAMP為菌絲生長相關Ras1/cAMP/蛋白激酶A(protein kinase A,PKA)信號通路的第二信使,通過向白念珠菌菌懸液中添加外源性的cAMP,研究外源性cAMP是否會逆轉GM1聯合氟康唑對白念珠菌菌絲形成的抑制作用,從而驗證菌絲抑制的機制是否與Ras1/cAMP/PKA信號通路有關。如圖6所示,加入外源性cAMP后,白念珠菌菌絲的形成更加密集,并且藥物聯合組在SD+10% FBS和Spider液體培養基中,菌絲的形成相比未加外源性cAMP都有一定的恢復,表明外源性cAMP的加入可以部分逆轉GM1聯合氟康唑對白念珠菌所產生的抑制作用。
4 討論
白念珠菌是念珠菌病的主要病原體,在機體免疫功能受損情況下,白念珠菌可以引起危及生命的全身感染[11]。白念珠菌的毒力特征取決于酵母菌和菌絲體之間的形態轉換、黏附素和侵襲素的表達、生物膜的形成、表型轉換、水解酶的分泌等[12]。毒力因子指病原體表達或分泌的與致病性相關的物白念珠菌的毒力因子包括上述毒力特征表現過程中分泌的念珠菌素、黏附素、水解酶、耐藥蛋白、蛋白酶及其他相關蛋白和分子等[13]。伴隨著念珠菌病的高發病率和高死亡率以及耐藥性,新型治療策略的開發愈發重要,毒力因子在白念珠菌病發病機制中尤其重要,因此,以毒力因子為靶點是抗真菌藥物開發的一種極具吸引力的新途徑[14]。
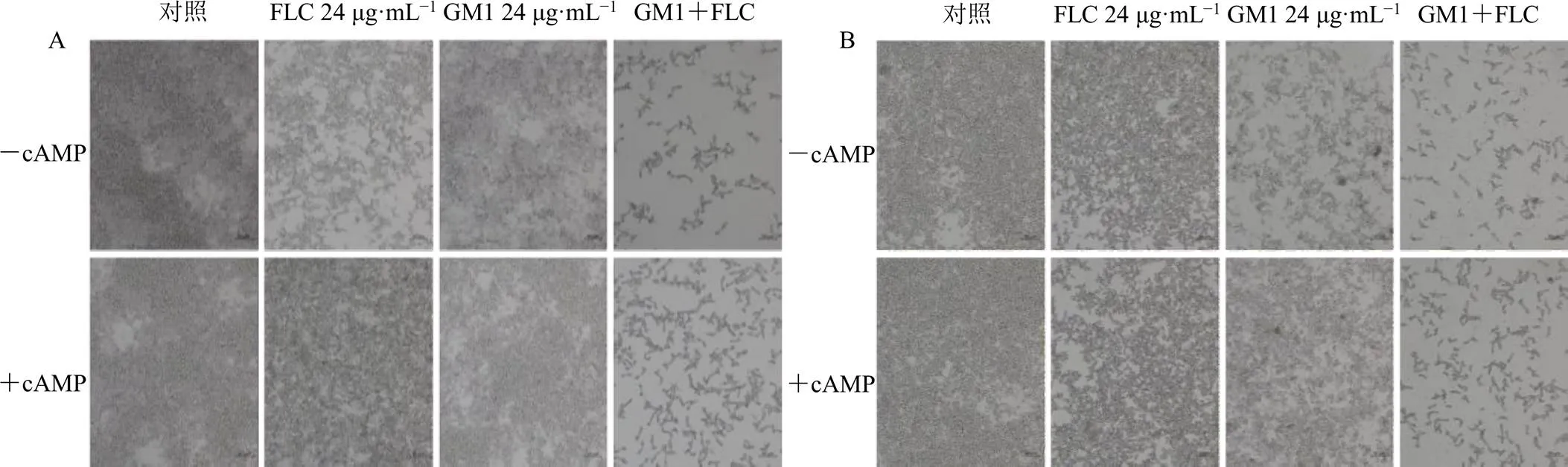
圖6 外源性cAMP對SD+10% FBS (A) 和Spider液體培養基(B) 中白念珠菌菌絲形成的影響(×200)
本研究結果顯示,GM1聯合氟康唑對5株臨床耐藥白念珠菌(CA23、CA187、CA381、CA808、CA4508)和2株耐氟康唑白念珠菌(SC5314-FR、ACTT10231-FR)均具有協同抗菌作用,MIC80值為22~26 μg/mL,表明GM1聯合氟康唑對于唑類耐藥菌株具有普遍的協同抗菌作用,且效果顯著。后續實驗選取CA23為研究對象,探討GM1協同氟康唑對白念珠菌的作用及機制。通過時間-生長曲線,發現GM1(24 μg/mL)聯合氟康唑(24 μg/mL)組在8~36 h動態抑菌效果最佳,具有良好的協同抑制效果,并以此藥物質量濃度處理后續實驗菌株,進一步驗證其協同作用。
白念珠菌酵母和菌絲之間的形態轉換在白念珠菌的毒力中發揮著重要的作用[14]。研究發現,白念珠菌的菌絲形態是其主要的致病形式,且在感染過程中起著關鍵作用,可以促進組織穿透和免疫細胞的逃逸[12,14]。因此,抑制白念珠菌菌絲的形成,可能會抑制其對宿主的致病性。本研究采用Spider和SD+10% FBS 2種菌絲誘導液體培養基,發現8 h后,GM1組和氟康唑組白念珠菌形成大量密集細長的菌絲,GM1聯合氟康唑組的菌絲很少,僅有少量的假菌絲形,其余大部分多為酵母形態,表明GM1聯合氟康唑能夠有效抑制白念珠菌菌絲的形成。
Ras1/cAMP/PKA信號通路在白念珠菌的生長、酵母-菌絲轉換、白色-不透明轉換、有性繁殖、生物膜形成等發面發揮重要的作用[15-16]。在胞外因子(如-乙酰葡糖胺、血清、pH、溫度等)的刺激下,Ras1蛋白轉化為活性形式,并激活腺苷酸環化酶合成第二信使cAMP,進而激活Ras1/cAMP/PKA信號通路調節菌絲的生長[17-18]。EFG1參與Ras1/cAMP/ PKA信號通路的調控,其表達上調能迅速激活一系列菌絲特異性基因如、、的表達[19-21]。為了明確GM1與氟康唑聯用對白念珠菌菌絲抑制作用的信號通路,采用qRT-PCR法檢測了菌絲相關基因的表達情況,結果顯示,GM1聯合氟康唑能夠顯著下調上述信號通路中關鍵基因、、、、、的表達水平。為了進一步驗證GM1聯合氟康唑對白念珠菌菌絲的抑制作用是否與Ras1/cAMP/PKA信號通路有關,通過加入外源性cAMP觀察菌絲的形成情況,結果顯示,加入外源性cAMP后,GM1聯合氟康唑組的菌絲部分恢復,表明GM1聯合氟康唑抑制白念珠菌菌絲形成的作用與Ras1/cAMP/PKA信號通路有關。
水解酶如分泌型天冬氨酸蛋白酶、磷脂酶和脂肪酶是白念珠菌最重要的毒力因子之一[22],這些酶的缺失或表達減少可能導致念珠菌的毒力降低[23]。本研究通過卵黃瓊脂培養基測定GM1和氟康唑單用及聯用對白念珠菌胞外磷脂酶活性的影響,發現GM1與氟康唑聯用時,白念珠菌的胞外磷脂酶活性顯著降低。qRT-PCR實驗結果顯示,GM1聯合氟康唑組的胞外磷脂酶活性相關基因和分泌型天冬氨酸蛋白酶相關基因、、的表達水平下降,表明GM1與氟康唑聯用時可以抑制白念珠菌磷脂酶和分泌型天冬氨酸蛋白酶活性,從而發揮抗真菌作用。
綜上所述,本研究發現GM1協同氟康唑可通過抑制白念珠菌毒力因子而發揮抗真菌作用,為GM1的進一步開發以及毒力因子作為潛在藥物靶點的臨床應用奠定了基礎,對治療白念珠菌感染具有重要的意義,其更深入的作用機制和內在關系有待進一步研究。
利益沖突 所有作者均聲明不存在利益沖突
[1] Nobile C J, Johnson A D.biofilms and human disease [J]., 2015, 69: 71-92.
[2] Pfaller M A, Diekema D J. Epidemiology of invasive candidiasis: A persistent public health problem [J]., 2007, 20(1): 133-163.
[3] White T C, Holleman S, Dy F,. Resistance mechanisms in clinical isolates of[J]., 2002, 46(6): 1704-1713.
[4] Denning D W, Bromley M J. Infectious disease. How to bolster the antifungal pipeline [J]., 2015, 347(6229): 1414-1416.
[5] 徐祥云, 彭君. 五味子科植物化學成分研究進展及其常用分離方法 [J]. 安徽農業科學, 2013, 41(6): 2645-2647.
[6] 黃曉東, 任曠. 五味子木脂素研究進展 [J]. 吉林醫藥學院學報, 2010, 31(1): 46-49.
[7] Ikeya Y, Taguchi H, Yosioka I. The constituents ofBaill. X. The structures of GAMMA-schizandrin and four new lignans, (?)-gomisins L1 and L2, (+)-gomisin M1 and (+)-gomisin M2 [J]., 1982, 30(1): 132-139.
[8] Poornima B, Kumar D A, Siva B,. Advanced glycation end-products inhibitors isolated from[J]., 2016, 30(4): 493-496.
[9] Chen M, Kilgore N, Lee K H,. Rubrisandrins A and B, lignans and related anti-HIV compounds from[J]., 2006, 69(12): 1697-1701.
[10] 尹光美, 蘇劉艷, 李俊, 等. 棋盤法和倍比微量稀釋法在體外聯合抗真菌活性藥物篩選中的應用研究 [J]. 云南民族大學學報: 自然科學版, 2019, 28(3): 246-250.
[11] Mayer F L, Wilson D, Hube B.pathogenicity mechanisms [J]., 2013, 4(2): 119-128.
[12] Pathakumari B, Liang G, Liu W. Immune defence to invasive fungal infections: A comprehensive review [J]., 2020, 130: 110550.
[13] H?fs S, Mogavero S, Hube B. Interaction ofwith host cells: Virulence factors, host defense, escape strategies, and the microbiota [J]., 2016, 54(3): 149-169.
[14] Vila T, Romo J A, Pierce C G,. Targetingfilamentation for antifungal drug development [J]., 2017, 8(2): 150-158.
[15] Hogan D A, Sundstrom P. The Ras/cAMP/PKA signaling pathway and virulence in[J]., 2009, 4(10): 1263-1270.
[16] Huang G H, Huang Q, Wei Y J,. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in[J]., 2019, 111(1): 6-16.
[17] Biswas S, van Dijck P, Datta A. Environmental sensing and signal transduction pathways regulating morphopathogenic determinants of[J]., 2007, 71(2): 348-376.
[18] Grahl N, Demers E G, Lindsay A K,. Mitochondrial activity and Cyr1 are key regulators of Ras1 activation ofvirulence pathways [J]., 2015, 11(8): e1005133.
[19] Mishra S, Rastogi S K, Singh S,. Controlling pathogenesis inby targeting Efg1 and glyoxylate pathway through naturally occurring polyphenols [J]., 2019, 46(6): 5805-5820.
[20] Miwa T, Takagi Y, Shinozaki M,. Gpr1, a putative G-protein-coupled receptor, regulates morphogenesis and hypha formation in the pathogenic fungus[J]., 2004, 3(4): 919-931.
[21] Fan Y, He H, Dong Y,. Hyphae-specific genes HGC1, ALS3, HWP1, and ECE1 and relevant signaling pathways in[J]., 2013, 176(5/6): 329-335.
[22] 馬虎, 崔凡, 林昭春. 白念珠菌致病相關的水解酶 [J]. 中國真菌學雜志, 2012, 7(4): 247-251.
[23] Li X, Hou Y, Yue L,. Potential targets for antifungal drug discovery based on growth and virulence in[J]., 2015, 59(10): 5885-5891.
Effect of gomisin M1 combined with fluconazole on virulence factors of drug- resistant
WANG Ying-xian1, 4, LI Jun1, 4, QIN Ding-mei1, 4, ZHANG Lu-mei1, 4, WANG Meng-ru2, YUAN Kai3, LIAO Yi-chuan1, 4, LI Jia-sheng1, 4, XIAO Wei-lie1, 2, WANG Rui-rui1, 4
1. College of Chinese Materia Medica, Yunnan University of Chinese Medicine, Kunming 650500, China 2. Key Laboratory of Natural Resources Medicinal Chemistry of Ministry of Education and State Key Laboratory of Conservation and Utilization of Biological Resources in Yunnan, Yunnan University, Kunming 650500, China 3. Second Clinical Medical School, Yunnan University of Chinese Medicine, Kunming 650500, China 4. Engineering Laboratory for National Health Theory and Product of Yunnan Province, Kunming 650500, China
To explore the effect and mechanism of gomisin M1 (lignans extracted from Schisandraceae plants) combined with fluconazole against drug-resistant.Multiple microdilution method was used to detect the minimum inhibitory concentration of gomisin M1 combined with fluconazole againstTime-growth curve was used to observe the inhibitory effect of gomisin M1 combined with fluconazole on. Inverted microscope was used to detect the effect of gomisin M1 combined with fluconazole on hyphae formation in Spider and SD + 10% fetal bovine serum (FBS) liquid medium. Yolk agar plate method was used to determine the effect of gomisin M1 combined with fluconazole on extracellular phospholipase activity of. qRT-PCR method was used to detect the effect of gomisin M1 combined with fluconazole on gene expressions of mycelium-related proteins and hydrolase.Gomisin M1 combined with fluconazole had a significant inhibitory effect on drug-resistantand significantly inhibited the hyphae growth of drug-resistant. Gomisin M1 combined with fluconazole reducedextracellular phospholipase activity, significantly inhibited hypha-related genes,, enhanced filamentous growth protein 1 (), cell elongation protein 1 (), agglutinin-like protein 3 (), hyphal wall protein () and hydrolase-related genes secreted aspartyl protease 1 (),,and phospholipase B1 () expressions (< 0.05, 0.01).Gomisin M1 combined with fluconazole can play an antifungal role through inhibiting the expression of virulence factors including hyphae formation related proteins and extracellular phospholipase of drug-resistant.
gomisin M1; fluconazole;; resistance; virulence factors
R285.5
A
0253 - 2670(2022)03 - 0743 - 08
10.7501/j.issn.0253-2670.2022.03.013
2021-09-18
國家自然科學基金地區科學基金資助項目(81660737);云南省科技計劃中醫聯合重點項目(2017FF117[-003]);云南省科學技術廳—云南中醫藥大學應用基礎研究聯合專項(2017FF116[-028]);云南省教育廳科學研究基金資助項目(2014Y238);云南省生物資源保護與利用國家重點實驗室開放基金資助項目(2021KF004)
王應仙(1996—),女,碩士研究生,研究方向為真菌感染。E-mail:1441542085@qq.com
王睿睿,博士,教授,博士生導師,主要從事真菌感染免疫。E-mail: wangrryucm@126.com
肖偉烈,博士,研究員,博士生導師,主要從事天然活性分子的發現及新藥研發。E-mail: xiaoweilie@ynu.edu.cn
[責任編輯 李亞楠]

