“通督啟神”法電針對APP/PS1雙轉基因小鼠皮層區AMPK、mTOR表達的影響
王帥 孫潤權 劉奕志 劉思遠 李志剛 王鑫
阿爾茨海默病(alzheimer’s disease,AD)又稱老年癡呆,是一種持續侵入型的中樞神經系統退行性疾患。其特征性病理改變為細胞外β-淀粉樣蛋白(β-amyloid,Aβ)異常聚積形成淀粉樣斑塊(amyloid plaques),神經元內微管相關蛋白tau蛋白過度磷酸化形成神經纖維纏結[1]。至今,據估計全世界有超過5000萬人患有癡呆癥,死亡率位列第五[2]。
線粒體功能障礙是導致AD發生的重要細胞內變化[3],當自噬被阻斷時,Aβ可以聚集在線粒體膜上,通過改變神經信號因子轉導,破壞線粒體結構和自噬功能,引起線粒體損傷和數量變化[4]。另外,自噬缺陷所導致的Tau 蛋白去除受阻,神經纖維纏結可能是AD的基本病理改變之一,Tau 蛋白的過度磷酸化可以導致線粒體腦內分布失衡[5]。前期研究發現,前額葉區腺苷酸活化蛋白激酶(adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK)是調控線粒體質量的重要因子[6],能有效對抗應激反應。此外,AMPK 能有效抑制雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)表信號傳導,線粒體損傷相關的AMPK/mTOR途徑可以誘導保護性自噬,激活自噬并觸發溶酶體系統清除 Aβ[7]。
本實驗主要探討“通督啟神”法電針能否通過調控小鼠線粒體自噬因子(AMPK、mTOR)的釋放,提高線粒體自噬的活性和質量,從而延緩AD 的病理進程,說明線粒體自噬功能不全可作為AD治療靶點,為 AD的預防和治療提供實驗依據。
1 材料與方法
1.1 實驗動物
清潔級6月齡雄性APPswe/PS1dE9(Amyloid Precursor Protin/Presenilin-1)雙轉基因小鼠30只,遺傳背景相同的C57BL/6小鼠10只,體質量(28±2)g,購自江蘇金致和生物科技有限公司(實驗動物許可證號:SCXK(京)99 2014-0004)。飼養于首都醫科大學附屬北京中醫醫院中心屏障系統。
1.2 試劑與儀器
3-甲基腺嘌呤(3-Methyladenine,3MA)(貨號:HY-19312)(規格:50.0 mg) 上海皓元生物醫藥科技有限公司; AMPK Alpha Monoclonal(Ptg公司,編號:66536-1-Ig);MTOR Monoclonal Antibody(ptg公司,編號:66888-1-Ig);丙烯酰胺,雙丙烯酰胺,蛋白質分子量Marker(美國Bio-rad公司,貨號:161-0374,310007919);辣根過氧化物酶標記山羊抗兔IgG(北京中杉金橋生物技術有限公司,貨號:ZB-2301,批號:128964);辣根過氧化物酶標記山羊抗小鼠IgG(北京中杉金橋生物技術有限公司,貨號:ZB-2305,批號:129736)
ZYTH2013030504型無菌針灸針 (北京中研太和醫療器械有限公司);華佗牌電子電療儀(蘇州醫療用品廠有限公司);XR-XM101型Morris水迷宮圖像自動采集和軟件分析系統(上海欣軟信息科技公司)。
1.3 干預方法
將30只清潔級APP/PS1雙轉基因小鼠, 隨機分為模型組、電針+抑制劑組(線粒體自噬抑制劑為3-MA)和電針組,每組10只,C57BL/6 小鼠10只作為空白對照組。實驗全程將實驗動物固定于自制鼠板上,使其保持清醒,電針組參照全國針灸學會實驗針灸研究會制定的“實驗動物針灸穴位圖譜”選取百會穴、印堂穴、水溝穴三個穴位,用華佗牌30號1寸毫針進行電針。水溝穴向鼻尖方向點刺,百會穴向下平刺進針、印堂穴向上平刺進針(注意兩針尖不要在小鼠體內接觸,防止短路),進針深度為0.5 cm,膠帶固定,針柄連接華佗牌電子電療儀,電針頻率為2 Hz,疏密波,電壓為2 V, 電流強度為0.2 mA,電針強度以大鼠頭部微顫為宜[8]。每次20分鐘,每天1次,共治療15天。
電針+抑制劑組在針刺前30分鐘予以2 mg/kg濃度計量的3MA溶于PBS溶液中,腹腔注射,并與電針組進行相同條件的針刺和束縛;
空白對照組、模型組和電針組在干預前30分鐘時注射(1.2±0.1) mL PBS溶液。空白組和模型組在電針組束縛治療時進行同等時間和力度的抓取和束縛;各組小鼠每天上午干預1次,共干預15天。
1.4 Morris水迷宮隱蔽平臺實驗
實驗第1天,讓動物在不含平臺的水池中自由游泳60秒,上午、下午各1次,使其熟悉迷宮環境。實驗時平臺位置固定不變,先將動物置于平臺上訓練10秒,在Ⅱ、Ⅲ、Ⅳ象限分別選一固定位置作為入水點,將小鼠面壁放入水中,水迷宮圖像自動采集和軟件分析系統自動記錄小鼠的逃避潛伏期,并選取Ⅲ象限數據進行統計分析,超出60秒沒有登臺的,其逃避潛伏期自動記60秒,然后人為將小鼠放在平臺上學習15秒,每天上午測試1次, 共測試5天,以檢測小鼠的空間記憶和學習能力。
1.5 Morris水迷宮空間探索實驗
隱蔽平臺實驗結束以后的第2天上午,撤除Ⅰ象限的平臺,在Ⅱ、Ⅲ、Ⅳ象限分別選一固定位置作為入水點,將小鼠面壁放入水中,并選取Ⅲ象限數據進行統計分析,水迷宮圖像自動采集和軟件分析系統自動記錄小鼠穿越平臺次數,在Ⅰ象限的游泳時間,并計算其與總游泳時間的比值,即目標象限游泳時間/總游泳時間,共測試1天,該實驗的目的是檢測小鼠的空間記憶能力。
1.6 免疫組化DAB染色
每組隨機選取4只小鼠,0.3%戊巴比妥鈉(30 mg/kg)腹腔麻醉后,4%多聚甲醛灌注取全腦,放入4%多聚甲醛中固定24小時,石蠟包埋,切片,厚度為6 μm。石蠟切片經常規脫蠟處理后,用枸椽酸緩沖液進行抗原修復15分鐘,待涼至室溫,PBS漂洗;3%H2O2室溫孵育10分鐘,PBS漂洗;正常非免疫羊血清37℃孵育10分鐘,PBS漂洗;一抗稀釋液(AMPK 1∶50;mTOR 1∶100),放入濕盒,4℃冰箱孵育過夜;第2天PBS漂洗,生物素標記的羊抗兔IgG 37℃孵育10分鐘,PBS漂洗;鏈霉菌抗生物素蛋白—過氧化酶37℃孵育10 分鐘,PBS漂洗;DAB顯色試劑盒顯色,顯微鏡下觀察并終止顯色;蘇木素復染,酒精梯度脫水,二甲苯透明,中性樹脂封片,晾干,留以觀察。以額葉皮層部分為圖片分析區域,每組取相互不重疊的6個視野,用 ImageJ對圖像分析系統進行圖像處理 ,計數其中陽性細胞,每組小鼠所有切片陽性細胞數量作為該組動物免疫陽性細胞密度代表值,以陽性細胞數表示,進一步進行統計分析。
1.7 Western blot 檢測小鼠前額葉組織AMPK、mTOR的蛋白表達
檢測時取冰凍保存的小鼠海馬組織加入裂解緩沖液,研磨均勻后冰上靜置20分鐘后取上層清液,4 ℃、10 000 r/min、離心10分鐘,,提取組織總蛋白樣品,使用 BCA 蛋白定量測定試劑盒對蛋白濃度進行測定。剩余蛋白樣品加入等體積的2×SDS上樣緩沖液,沸水中煮5分鐘,充分變性蛋白。SDS-PAGE 電泳,轉膜,漂洗5分鐘,封閉處理1小時。分別加入一抗(AMPK為1∶3 000;mTOR為1∶500;β-actin 1∶5 000),4 ℃孵育過夜。洗膜后,加入二抗(AMPK為1∶2 000;mTOR為1∶1 000),室溫孵育 2小時。加入HRPECL發光液,于暗室中X光膠片曝光,顯影、定影、標定Marker,最后清水沖洗,晾干,掃描,用IPP軟件對掃描圖象的目的條帶進行灰度分析。以各目的蛋白相對于內參蛋白β-actin 的表達量作為該蛋白的相對表達量。

2 結果
2.1 各組隱蔽平臺實驗結果比較
重復測量和組間效應方差分析,隨訓練天數增加,小鼠的逃避潛伏期都有所縮短。對逃避潛伏期做兩兩比較,模型組長于空白對照組,電針組短于模型組,電針+抑制劑組長于電針組,電針+抑制劑組有短于電針組的趨勢,但無統計學意義。見表1,圖1。

表1 不同組別逃避潛伏期比較

注:AMPK免疫組化:A1 空白對照組;B1 模型組;C1 電針組;D1 電針+抑制劑組;mTOR免疫組化:A2 空白對照組;B2 模型組;C2 電針組;D2 電針+抑制劑組。
2.2 各組空間探索實驗結果比較
各組空間探索實驗穿越平臺次數及平臺象限游泳時間均采用單因素 ANOVA,穿越平臺次數,空白對照組明顯優于其他三組(P<0.05),電針組優于電針+抑制劑組(P<0.05),但電針組和電針+抑制劑組與模型組比較無明顯統計學意義。就目標象限游泳時間和目標象限游泳時間百分比而言,空白對照組明顯優于模型組和電針+抑制劑組(P<0.05),電針組優于電針+抑制劑組(P<0.05),見表2。

表2 不同組別目標象限游泳時間/總時間、穿越平臺次數比較
2.3 免疫組化DAB染色結果
AMPK主要表達于小鼠前額葉區的細胞核和胞漿中,以細胞核著色為主,胞漿呈淡染,蛋白陽性區域顯色為棕黃色至棕褐色。空白對照組的陽性細胞數多且著色深;模型組的陽性細胞較空白對照組明顯減少,且著色淺;電針+抑制劑組和電針組的陽性細胞數介于模型組與空白對照組之間,電針組著色最深。空白對照組的陽性細胞數多于模型組(P<0.05),電針組多于模型組(P<0.05)和電針+抑制劑組(P<0.05),模型組多于電針+抑制劑組(P<0.05)。
mTOR主要表達于小鼠前額葉線粒體自噬細胞的細胞器,少數表達與細胞核中,陽性細胞呈淡黃色發散狀團塊。空白對照組的陽性細胞數少且著色淺;模型組的陽性細胞較空白對照組明顯增多,且著色較深;電針+抑制劑組和電針組的陽性細胞數及顏色介于模型組與正常對照組之間。模型組的陽性細胞數多于空白對照組(P<0.05),模型組與電針+制劑組比較無明顯差異,電針組少于模型組和電針+制劑組(P<0.05),見圖1,表3。
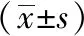
表3 各組小鼠前額葉區AMPK、mTOR免疫組化陽性表達比較
2.4 Western blot檢測結果
與空白對照組相比,模型組AMPK條帶較細,蛋白表達明顯較少,mTOR條帶增粗,蛋白表達增加,差異均有統計學意義(P<0.05);與模型組相比,電針組AMPK表達均明顯增加(P<0.05),電針+抑制劑組表達也有所增加,但差異均無統計學意義,電針+抑制劑組與電針組比較其表達明顯減少(P<0.05);電針組mTOR表達明顯少于模型組和電針+抑制劑組,差異均有統計學意義(P<0.05)和(P<0.05),模型組高于電針+抑制劑組(P<0.05),見表4,圖2。

表4 不同組別前額葉區AMPK、mTOR表達水平比較

注:1 空白對照組;2 模型組;3 電針組;4 電針+抑制劑組
3 討論
本實驗結果表明電針干預后實驗組AD小鼠空間學習記憶能力較模型組增強,大腦皮層中AMPK蛋白表達水平上調,mTOR蛋白表達水平下調,說明電針干預可以改善小鼠認知能力,調節自噬相關蛋白表達。電針組在行為學方面優于電針+抑制劑組,促進AMPK表達,抑制mTOR表達,說明電針能通過誘導或繼發線粒體自噬,增強自噬作用,突破抑制劑作用,起到延緩疾病進展的目的;由線粒體障礙造成的細胞凋亡等一系列細胞癥狀是加速 AD 患者祌經元受損的生物級聯反應之一,線粒體自噬發揮神經保護作用的機制是降解和去除 Aβ 淀粉樣沉積及其造成的神經元損傷。同時本實驗說明線粒體自噬在分子層面的作用效果和機制,為自噬通路的研究構筑更堅實的實驗依據。
在AD中發現的可溶性Aβ和異常磷酸化的Tau蛋白直接與線粒體相互作用并損害其功能,線粒體結構基因、自噬基因和線粒體自噬特異性基因都已被證明以某種方式發生變化[9]。AMPK是生物體內普遍存在的一種絲氨酸/蘇氨酸蛋白激酶,以異源三聚體形式存在[10],主要協調代謝和能量的需要,是感受細胞能量變化的關鍵分子, 細胞代謝應激或能量失衡引起 ADP/ATP 或 AMP/ATP 比率升高, 導致AMPK 的激活,進而調控了線粒體的功能, 調控細胞能量循環。AMPK 參與生理和病理狀態下的神經保護,從而協調許多組織中特定情境的代謝反應[11]。mTOR是結合線粒體自噬的重要位點。當細胞能量充足時,AMPK處于失活狀態,mTOR 處于活化狀態,mTOR是與AMPK能量狀態相反的感應器,其活性是自噬起效的關鍵和負性調節因子,在AMPK介導的自噬信號通路中,mTOR 是其下游重要的信號分子。細胞遭受應激損傷過程中 mTOR 即被抑制,主要通過上游AMPK調控激活[12]。神經系統集成各種中央和外圍信號以維持體內平衡,神經系統 AMPK 被證明在能量平衡中具有重要且復雜的作用[13]。
“通督啟神”針法是以針灸作用基本特點為基礎,結合臨床實際,總結提煉出的用于治療神志病的系統化治療處方[14]。神智病主要病變部位在腦,腦為“神明之府”,主宰人的一切精神意志及思維活動,神失所養則發為神志病。根據“氣街”理論,“頭氣有街,氣在頭者,止之于腦”(《靈樞·衛氣》),即頭部經氣與腦聯系密切。頭為“諸陽之會”,督脈為“陽脈之海”,《靈樞·營氣》:“上額,循巔,下項中,循脊,入骶,是督脈也。”《素問·骨空論篇》:“入于腦,上頭頂,下額,聯系心、腎、腦[15]。”督脈虛衰則腎精無法充盈灌注腦髓,清陽不升,濁陰不降,竅閉神溺,發為“呆病”。因此,在穴位的選取上,以督脈的百會穴、印堂穴和人中穴為主穴。百會又名三陽五會、巔上、天滿,根據“四海”理論,“腦為髓海,其氣上輸腦蓋百會穴,下輸風府也”。百會穴為督脈經氣之所歸,清竅神氣之所息,為神志病變局部必選穴。印堂,原為經外奇穴,后結合穴位位置與功能被歸為督脈,《新集備急灸經》:“患大風病,兩眉中名光明穴,灸隨年。”具有清利頭目、開竅醒神益智的功效,調和陰陽氣機,達到陰平陽秘的生理狀態。人中穴又名溝洫、壽堂、子庭,《神應經》云:“善悲哭憂不休, 針百會、人中。”又為十三鬼穴中的鬼宮,鬼穴為《千金要方》所載,是古代治療神志疾患的十三個經驗效穴[16]。此三穴皆為頭部腧穴,符合“腧穴所在,主治所在”的局部選穴原則;皆為督脈腧穴,同氣相求;也是符合神志病的病因病機的辨證對癥選穴,位置與辨證相宜。選此三穴為伍,通督以啟神,方能調陰與陽,精氣乃光,合形與氣,使神內藏。
綜上所述,實驗可見,本實驗應用3MA線粒體自噬抑制劑可延緩AD小鼠認知能力改善,弱化電針對小鼠前額葉區相應蛋白水平的調節,說明AD的發病機制可能與線粒體自噬有十分緊密的關聯。與此同時,AMPK/mTOR這一負性調節環路在自噬發生和發展過程中也起到了重要作用,為自噬研究提供了新的參考。
本實驗就“通督啟神”法電針對AD的治療作用及作用途徑進行了分子層面的驗證,但線粒體自噬這一重要的細胞內事件的激活、形成、凋亡,是否呈有規律的起落消漲現象,以及各個過程和現象間的相互影響作用,仍是醫療生物界有待攻克的主題和難題,進行更深層次的研究與討論是總結AD治療策略的必經之路。

