犬瘟熱病毒單克隆抗體的研制及膠體金試紙條檢測方法的建立
張 敏,李 建,舒金秀,馮超林,石寶蘭,鄭良益,牟林琳,柏 嬌, 胡玉立,徐 松,劉國興,閔娟娟,石 瑛,顧素云,謝紅玲*
(1.國藥集團動物保健股份有限公司,武漢 430075;2. 湖北省獸藥監察所,武漢 430070)
犬瘟熱(Canine distemper, CD)是由犬瘟熱病毒(Canine distemper virus, CDV)引起的一類在多種肉食性犬類(尤其是幼仔)、貂類等動物中急性高度接觸性、致死性傳染病,同時可感染非人靈長類動物[1]。該病廣泛分布全球,且各季節均有發生。根據臨床癥狀可分急性和慢性期,常引起劇烈的如結膜炎、腸胃炎等炎癥反應和各種慢性神經癥狀[2],感染動物死亡率高達80%[3]。犬瘟熱已成為阻礙寵物飼養業、毛皮動物養殖業等發展的主要疫病之一。由于缺乏簡便快捷、準確、便于操作的檢測方法,常常延誤病機,錯過治療機會,導致動物死亡[4]。因此,開展對于CDV感染早期臨床診斷檢測研究具有重要意義。
CDV為有囊膜的單股負鏈RNA病毒,基因組6個開放閱讀框分別編碼6種結構蛋白:核衣殼蛋白(N)、磷蛋白(P)、基質膜蛋白(M)、融合蛋白(F)、血凝蛋白(H)和大蛋白(L),其中核衣殼蛋白在病毒裝配、轉錄和復制過程中起重要作用,能刺激機體產生強烈的體液免疫反應[5-6]。核衣殼蛋白的結構核心和功能核心高度保守,是保守性較強的免疫原性蛋白,為單克隆抗體、膠體金檢測試紙條的研制等研究提供必要條件[7]。
目前CDV檢測方法包括病毒學診斷、電鏡顯微鏡診斷、病毒分離與鑒定[8]、免疫學診斷、分子生物學等多種檢測手段,免疫膠體金試紙條檢測技術無疑是最為簡便、快捷、高效、靈敏的病毒診斷方法,不受環境及人員限制,無需儀器設備輔助,對于動物感染的早期診斷及控制具有重要意義[9]。本研究用原核表達的N蛋白,免疫小鼠制備單克隆抗體,建立一種敏感性、特異性良好的免疫膠體金試紙條檢測方法。
1 材料與方法
1.1 毒種、細胞和其他試劑 SP2/0細胞、表達載體pET-28a、Vero細胞、MDCK細胞、F81細胞、BHK細胞、CDV(YD株、Snyder Hill株、WH-G株)、犬細小病毒(canine parvovirus, CPV)、犬腺病毒2型(canine adenovirus type 2, CAV2)、狂犬病病毒(rabies virus, RV)為國藥集團動物保健股份有限公司保存;FITC標記羊抗小鼠IgG、HRP標記羊抗小鼠IgG,Thermo公司;DMEM培養基,Hyclone公司;HAT、HT,Sigma公司;單抗亞類鑒定試劑盒,洛陽賽爾維公司。安捷犬瘟熱病毒抗原快速檢測試紙,購自韓國安捷公司,貨號RG1103DF。
1.2 CDV N蛋白表達載體的構建與蛋白表達純化
1.2.1 引物設計 根據GenBank中登錄的CDV N全基因序列,設計RT-PCR擴增引物,預期擴增片段為1572 bp。引物序列如下:
CDV-NF:5′-GGTGCCGCGCGGCAGCCATATGATGGCTAGCCTTCTCAAGAG -3′ (NdeI)
CDV-NR:5′-GTGGTGGTGGTGGTGGTGCTCGAGATTAAGTAGCTCTCTATCATTATA-3′ (XhoI)
1.2.2 CDV中N基因的擴增及重組表達質粒的構建 參照RNA 提取試劑盒說明書提取總RNA并以其為模板,按上述引物擴增CDV的N基因。RT-PCR 的反應參數是:98 ℃預熱2 min,98 ℃變性10 s,55 ℃退火溫度15 s,72 ℃延伸2 min(從第二步98 ℃變性到第四步72 ℃延伸進行35個循環),72 ℃延伸10 min。回收純化的PCR產物經NdeI和XhoI酶切后克隆至pET-28a載體中,構建重組表達質粒。
1.2.3 重組CDV N蛋白的表達、純化及鑒定
將pET-28a-N轉化至受體菌BL21,待OD600達到0.4~0.5時,IPTG誘導表達,將BL21誘導后的培養物離心取菌體進行超聲破碎,破碎后的上清和沉淀進行SDS-PAGE電泳。表達的上清過Ni柱進行純化,分別收集流穿液和各洗脫峰,并將各樣品進行SDS-PAGE電泳。將純化后的CDV N蛋白樣品進行SDS-PAGE電泳、轉膜,加入合適稀釋倍數的陽性兔血清作一抗,用羊抗兔IgG-HRP為二抗,進行Western Blotting鑒定。
1.3 單克隆抗體的研制
1.3.1 動物免疫 將CDV N蛋白與等體積的弗氏完全佐劑混合并完全乳化后,小鼠腹股溝兩側靠近淋巴結區和頸部皮下多點免疫,每只50 μg/0.5 mL,21 d后2免,免疫劑量為首次免疫的一半,佐劑用弗氏不完全佐劑,間隔21 d后3免,免疫劑量和佐劑同2免,10 d之后采用腹腔注射進行加強免疫,劑量同首免,3 d后融合。
1.3.2 細胞融合 按照常規方法無菌采取小鼠的脾細胞,與骨髓瘤細胞按10∶1比例混合,用PEG1450進行融合,將融合之后的細胞加入鋪好飼養細胞的96孔板中。
1.3.3 雜交瘤細胞株篩選 利用間接ELISA法和間接免疫熒光法對所培養的雜交瘤上清進行檢測,有限稀釋法對檢測陽性的雜交瘤細胞進行至少三次以上的克隆直至陽性率為100%為止。
1.4 單克隆抗體的鑒定
1.4.1 腹水的生產及其純化 選擇12周齡以上的雌性BALB/C小鼠,腹腔注射單克隆雜交瘤細胞,7 d之后收取小鼠腹水,采用辛酸-硫酸銨法純化腹水。
1.4.2 單克隆抗體的亞類測定 按照洛陽賽爾維公司單抗亞類試劑盒說明書進行單克隆抗體亞類的測定。
1.4.3 單克隆抗體敏感性鑒定 將不同CDV株(YD株、Snyder Hill株、WH-G株)分別接種長滿單層的Vero細胞的96孔板中,置37 ℃ 5% CO2培養箱中進行培養72 h后用冷丙酮固定;以CDV N蛋白單克隆抗體作為一抗,FITC標記的抗鼠IgG作為二抗進行間接免疫熒光檢測,于熒光顯微鏡下觀察試驗結果。
1.4.4 單克隆抗體特異性鑒定 將CDV、CPV、CAV2、RV分別接種長滿單層的Vero細胞、F81細胞、MDCK細胞、BHK細胞的96孔板中,置37 ℃ 5% CO2培養箱中進行培養72 h后用冷丙酮固定;以CDV N蛋白單克隆抗體作為一抗,FITC標記的抗鼠IgG作為二抗進行間接免疫熒光檢測,于熒光顯微鏡下觀察試驗結果。
1.5 免疫膠體金試紙條的制備及檢測
1.5.1 CDV膠體金快速檢測試紙條的制備 用檸檬酸三鈉還原法制備25 nm的金顆粒溶液,標記量為30 μg/mL膠體金溶液的單克隆抗體D3,攪拌30 min,在加入終濃度20%的PEG 20000穩定未結合的膠體金顆粒,8700 r/min離心30 min,棄上清,再用金標緩沖溶液定容至2 mL。標記好的膠體金溶液均勻涂布于金標墊上,37 ℃烘干2 h備用。再將羊抗小鼠IgG二抗和單克隆抗體D6分別以1 mg/mL濃度包被硝酸纖維素膜作為質控線和檢測線,37 ℃烘干2 h備用。將準備好的硝酸纖維素膜、樣品墊、金標墊和吸水紙按順序粘貼到背襯板上,切條機切割成4 mm條,組裝成檢測試紙條。
1.5.2 CDV膠體金快速檢測試紙條檢測
1.5.2.1 試紙條對不同毒株CDV的敏感性檢測 將Snyder Hill株和WH-G株進行1∶50、1∶100、1∶200、1∶400、1∶800、1∶1600、1∶3200系列稀釋,YD株進行1∶5、1∶10、1∶20、1∶40系列稀釋;加樣量均為0.1 mL/孔,分別用本試紙條進行檢測,評判試紙條檢測敏感性。
1.5.2.2 試紙條特異性檢測 取CPV、CAV2、RV、CDV陰性對照樣品,分別用本試紙條進行檢測,評判試紙條特異性。
1.5.3 臨床試驗樣本適用性試驗及對比試驗
分別用本研究制備試紙條、安捷試紙條及PCR擴增法檢測50份犬鼻液或眼分泌物樣品,具體參照《犬瘟熱病毒病診斷技術國家標準》(GB/T 27532-2011),計算本研究試紙條與安捷試紙條、PCR檢測方法的符合率。
符合率=結果符合的樣品數/總樣品數×100%
2 結果與分析
2.1 CDV重組N蛋白表達及鑒定
2.1.1 CDV N基因的PCR擴增 PCR擴增出CDV N蛋白基因片段,電泳檢測結果(圖1)顯示,目的基因CDV N蛋白基因片段長度為1572 bp,與預期結果相符。
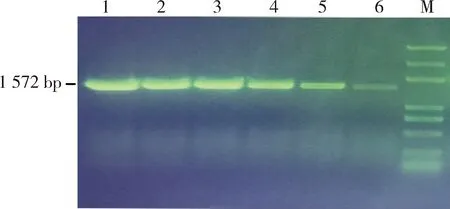
1-6:CDV N基因;M:Trans2K Plus Ⅱ DNA Marker1-6:CDV N gene;M:Trans2K Plus Ⅱ DNA Marker圖1 CDV N基因PCR擴增圖Fig 1 The PCR results of CDV N gene
2.1.2 CDV N蛋白表達、純化及鑒定 原核表達系統誘導表達CDV N蛋白,菌體破碎后上清及沉淀進行SDS-PAGE電泳結果(圖2)顯示,表達純化后的N蛋白分子量大小在58 kD 附近,大量存在于破碎后的上清液中。上清液純化后雜蛋白被去除,可見明顯單一目的蛋白條帶(圖3)。同時將純化后的N蛋白進行Western Blotting鑒定,N蛋白樣品孔出現一條與目的蛋白大小相同的條帶,表明純化后的N蛋白反應原性良好(圖4)。
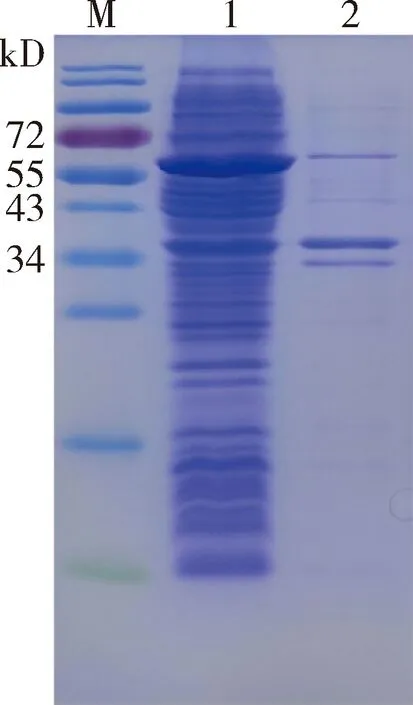
1:菌體破碎后上清;2:菌體破碎后沉淀;M:PageRuler非預染蛋白Marker1:Supernatant after induction;2:Supernatant of the bacteria lysate after induction;M:PageRuler unstained protein ladder圖2 CDV N蛋白表達各成分鑒定圖Fig 2 Identification of CDV N protein
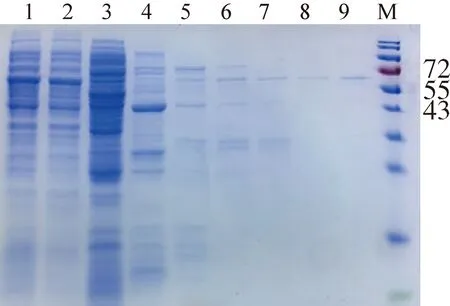
1:CDV N蛋白純化前;2:流穿雜蛋白樣;3-9:各洗脫時間段收獲CDV N蛋白樣;M:PageRuler非預染蛋白Marker1:Unpurified CDV N protein;2:Impure protein;3-9:Purified CDV N protein;M:PageRuler unstained protein ladder圖3 CDV N蛋白柱純化鑒定圖Fig 3 Identification and purification of CDV N protein
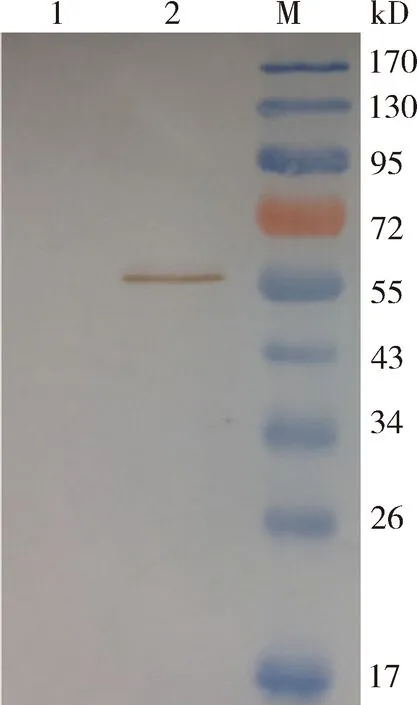
1:陰性對照;2:CDV N蛋白;M:PageRuler預染蛋白Marker1:Negative control;2:Purified CDV N protein;M:PageRuler prestained protein ladder圖4 CDV N蛋白純化Western blotting鑒定圖Fig 4 Western blotting identification of purified CDV N protein
2.2 單克隆抗體研制及鑒定 共篩選2株分泌CDV N蛋白抗體單克隆雜交瘤細胞株,分別命名為D3和D6。
2.2.1 單克隆抗體亞類測定 D3、D6亞類均為IgG1。
2.2.2 腹水的純化 純化抗體D3、D6進行SDS-PAGE鑒定分析,結果見圖5,2株單克隆抗體均出現大小50 kD左右的重鏈和25 kD左右的輕鏈,且雜蛋白去除較好,單抗純凈度較高。
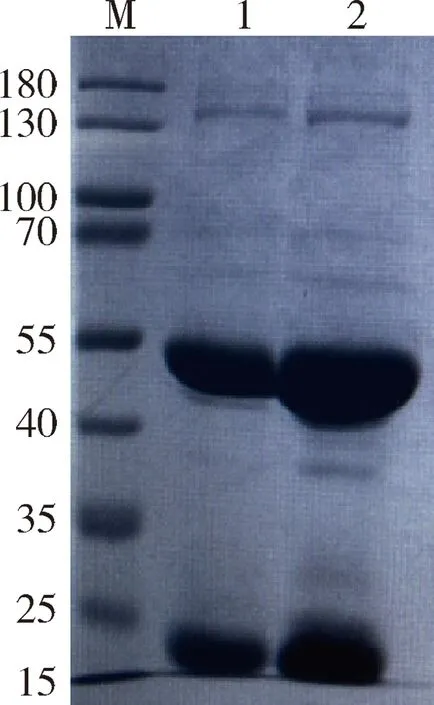
1:D3單抗;2:D6單抗;M:PageRuler非預染蛋白Marker1:Monoclonal antibody D3;2:Monoclonal antibody D6;M:PageRuler unstained protein ladder圖5 CDV N蛋白單抗純化SDS-PAGE鑒定圖Fig 5 SDS-PAGE identification of purified McAbs against CDV N protein
2.2.3 單克隆抗體敏感性鑒定 D3、D6單克隆抗體均能與不同CDV株(YD株、Snyder Hill株、WH-G株)感染的Vero細胞反應,可見明顯綠色熒光,與陰性細胞無熒光,說明D3、D6單克隆抗體敏感性良好,能識別結合多株CDV(圖6、圖7)。
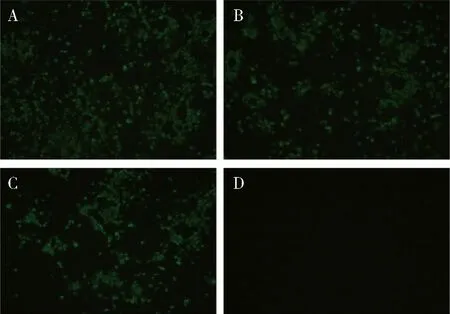
A:感染CDV-YD株細胞孔;B:感染CDV-Snyder Hill株細胞孔;C:感染CDV- WH-G株細胞孔;D:正常細胞對照A:Infected CDV-YD;B:Infected CDV-Snyder Hill;C:Infected CDV- WH-G;D:Negative control圖6 單克隆抗體D3敏感性鑒定(×40)Fig 6 Immunofluorescence assay(IFA) analyze the binding sensitivity of antibody D3(×40)
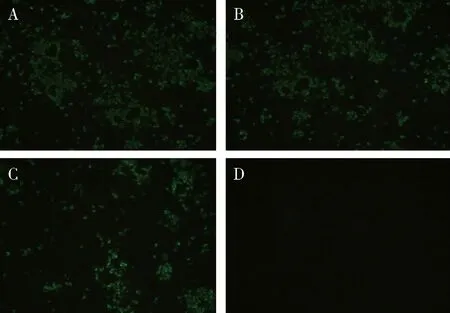
A:感染CDV-YD株;B:感染CDV-Snyder Hill株;C:感染CDV- WH-G株;D:正常細胞對照A:Infected CDV-YD;B:Infected CDV-Snyder Hill;C:Infected CDV- WH-G;D:Negative control圖7 單克隆抗體D6敏感性鑒定(×40)Fig 7 Immunofluorescence assay(IFA) analyze the binding sensitivity of antibody D6(×40)
2.2.4 單克隆抗體特異性鑒定 D3、D6單克隆抗體均能與感染CDV的Vero細胞反應,可見明顯綠色熒光,與陰性細胞無熒光。與感染CPV、CAV2、RV的細胞均不發生特異性反應,無熒光信號,說明D3、D6單克隆抗體僅與CDV發生特異性反應,與CPV、CAV2、RV均不結合,單克隆抗體特異性良好(圖8、圖9)。
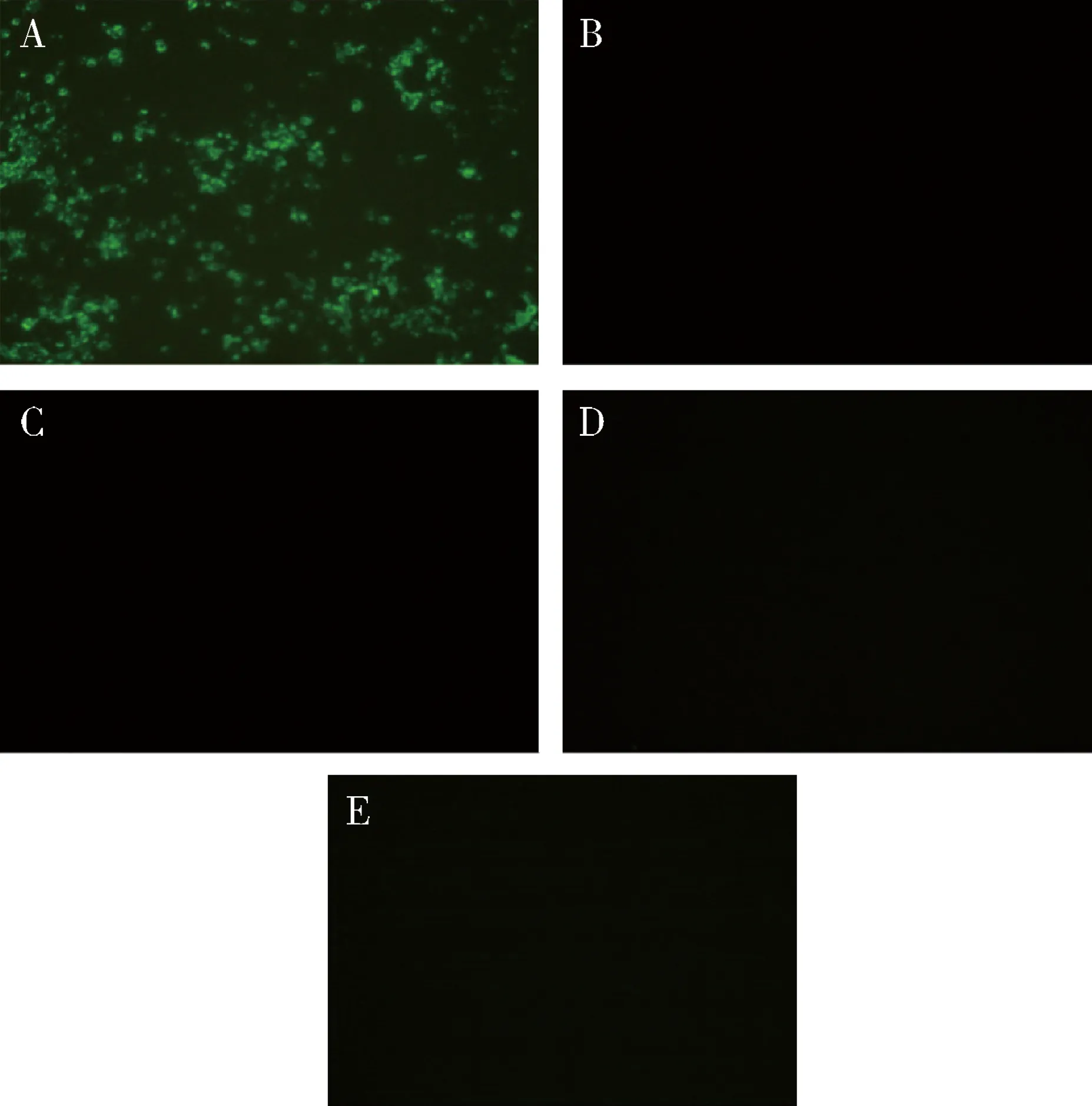
A:感染CDV;B:感染CPV;C:感染CAV2;D:感染RV;E:正常細胞對照A:Infected CDV;B:Infected CPV;C:Infected CAV2;D:Infected RV;E:Negative control圖8 單克隆抗體D3特異性鑒定(×40)Fig 8 Immunofluorescence assay(IFA) analyze the binding specificity of antibody D3(×40)

A:感染CDV;B:感染CPV;C:感染CAV2;D:感染RV;E:正常細胞對照A:Infected CDV;B:Infected CPV;C:Infected CAV2;D:Infected RV;E:negative control圖9 單克隆抗體D6特異性鑒定(×40)Fig 9 Immunofluorescence assay(IFA) analyze the binding specificity of antibody D6(×40)
2.3 免疫膠體金試紙條檢測方法的敏感性及特異性
2.3.1 試紙條檢測敏感性 本試紙條檢測不同CDV株,檢測105.3TCID50/mL的YD株病毒液,1∶5、1∶10稀釋度檢測結果均為陽性,1∶20、1∶40稀釋度檢測結果為陰性;檢測106.5TCID50/mL的Snyder Hill株和WH-G株病毒液,1∶50、1∶100、1∶200、1∶400稀釋度檢測結果均為陽性,1∶800、1∶1600、1∶3200稀釋度檢測結果為陰性(圖10)。本試紙條檢測不同株CDV的最低限均為1000 TCID50,敏感性良好。
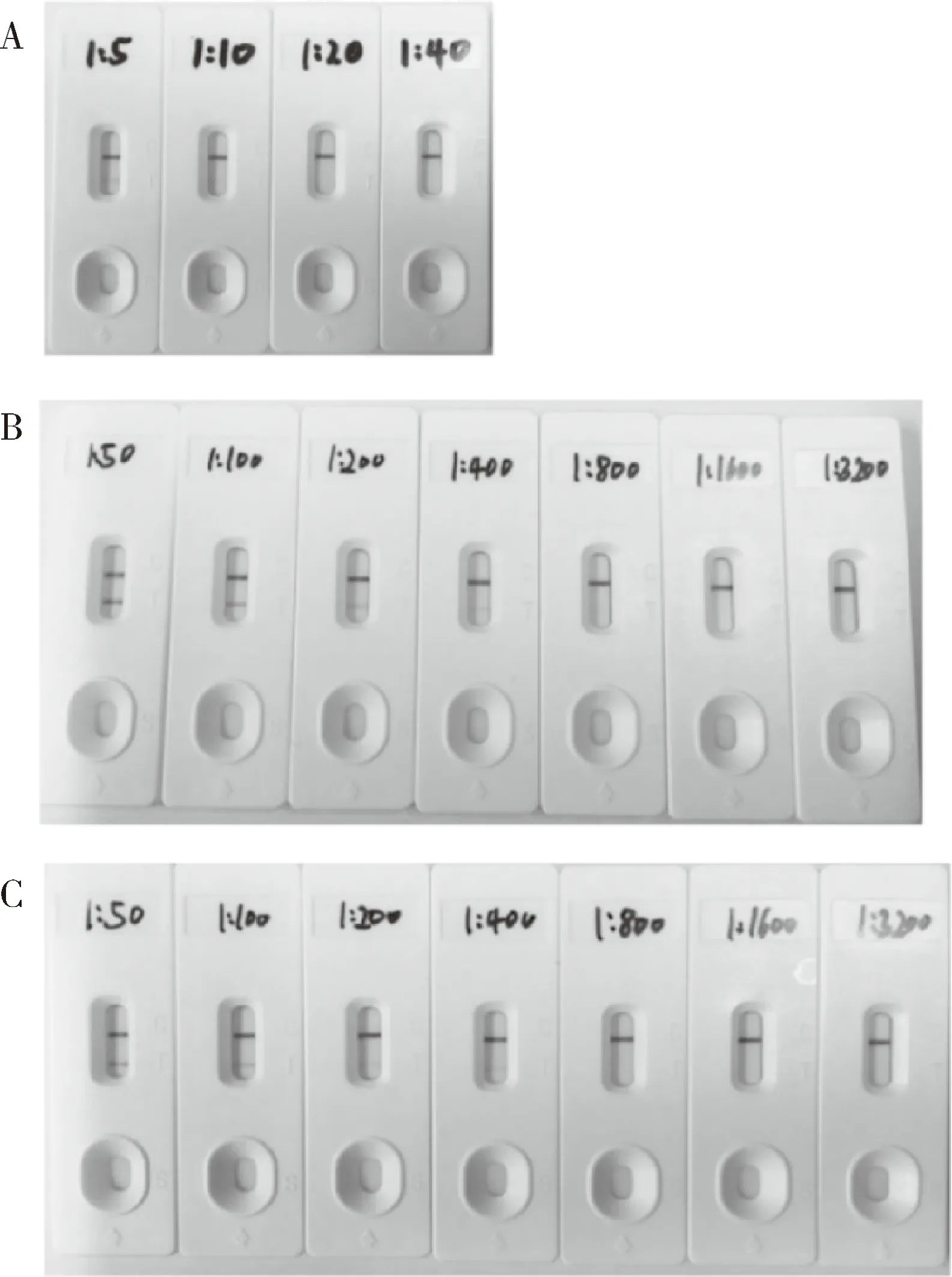
A:YD株;B:Snyder Hill株;C:WH-G株A:YD;B:Snyder Hill;C:WH-G圖10 試紙條敏感性結果Fig 10 Sensitivity test of dipstick
2.3.2 試紙條檢測特異性 本試紙條檢測CPV、CAV2、RV、CDV陰性對照,結果均為陰性,表明該試紙條不與犬其他常見病毒反應,特異性良好,檢測結果見圖11。

1:CPV;2:CAV2;3:RV;4:陰性對照1:CPV;2:CAV2;3:RV;4:Negative control圖11 試紙條特異性檢測結果Fig 11 Specificity test of dipstick
2.4 試紙條臨床適用性及同類產品、PCR法符合率 檢測臨床犬鼻液或眼分泌物樣品50份,其中陽性樣品16份,陰性樣品34份,陽性率為32%。安捷試紙條檢測陽性結果17份,陰性結果33份。兩種試紙條的檢測符合率為98%。PCR檢測陽性結果17份,陰性結果33份。本試紙條與PCR檢測符合率為98%。各檢測結果見表1。
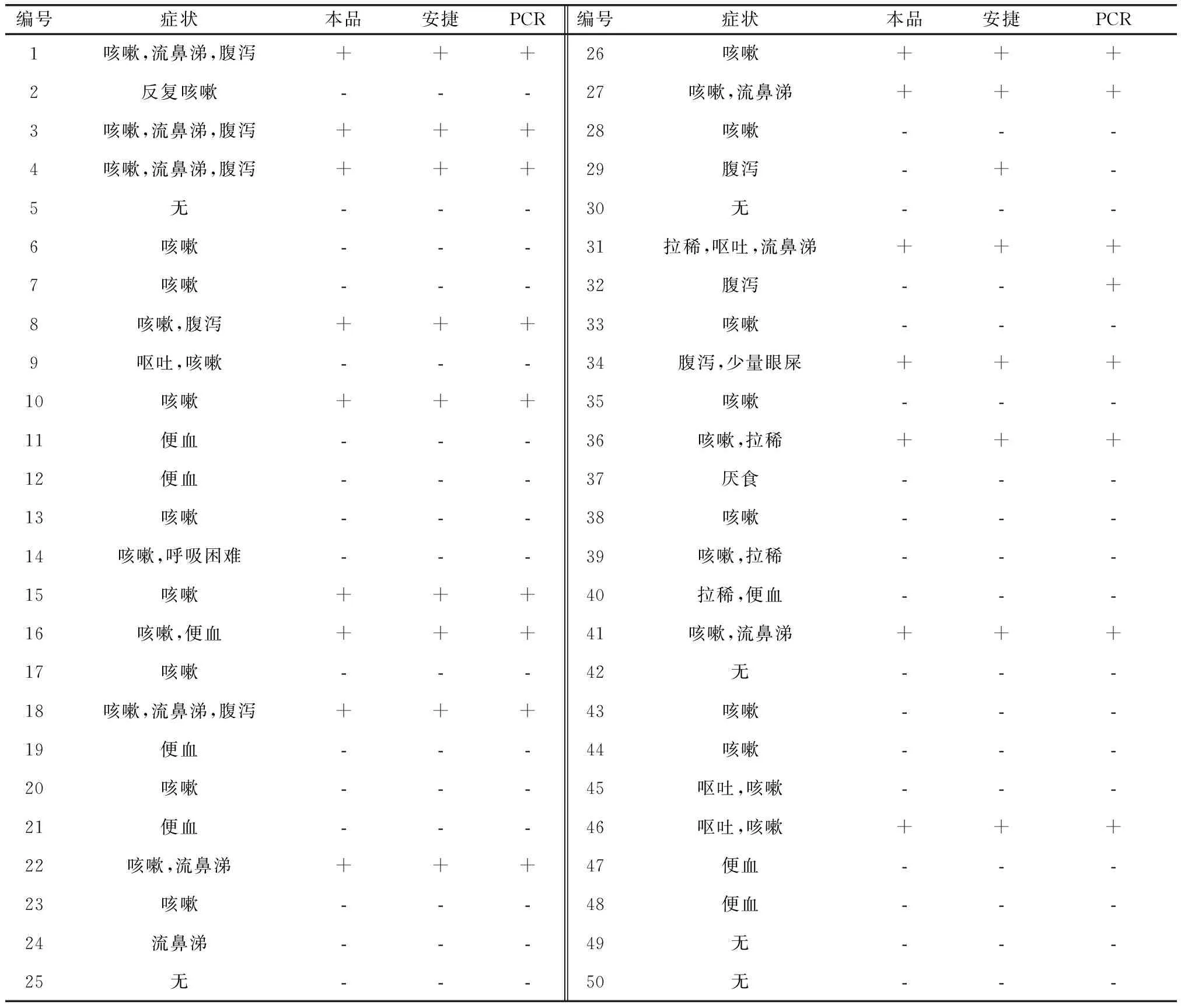
表1 臨床試驗檢測結果Tab 1 Clinical test
3 討論與小結
CDV自然感染的宿主范圍廣泛,造成的危害及經濟損失逐步擴大,以幼犬最為易感。目前實驗室診斷雖快速高效、特異性強,但常用的RT-PCR法、電鏡法等對人員的專業技術和儀器設備要求較高。基于單克隆抗體和免疫膠體金技術構建的檢測方法完美地規避上述難題,提供一種可現場檢測、操作簡單、結果直觀可見的診斷方法[9-10]。犬瘟熱膠體金試紙條為目前寵物醫院等臨床用于CDV檢測中使用最廣泛的檢測方法,但主要存在的問題為敏感性較低,為解決該問題,高敏感性單克隆抗體的研制顯得尤為關鍵[11-12]。使用CDV全“+”為陽性,“‐”為陰性病毒研發的單克隆抗體,應用于試紙條產品較為常見[13],但存在不同來源的病毒株檢測敏感性低、假陽性、特異性不強等問題[14-15]。區別于傳統的試紙條研發,本研究專注于開發針對CDV亞單位的單克隆抗體并進行試紙條的研發,能較大幅度地提高試紙條檢測方法的敏感性及特異性。CDV N蛋白結構及功能高度保守,以其作為免疫抗原得到的單克隆抗體,構建膠體金試紙條檢測方法,靈敏性特異性強[16]。本研究研制的CDV膠體金檢測試紙條有很好的臨床適用性,與目前寵物診所廣泛使用的韓國安捷公司生產的CDV抗原快速檢測試紙對比有較高的符合率,為臨床快速診斷CDV提供參考方法,同時降低了動物診所的使用成本。
本研究成功構建了CDV N蛋白原核表達載體,通過大腸桿菌表達系統高效表達,純化獲得免疫原性良好的CDV N蛋白。應該雜交瘤技術,成功篩選到2株敏感性及特異性良好的單克隆抗體D3、D6,可識別不同CDV株(YD株、Snyder Hill株、WH-G株)。以此單抗為基礎,成功構建免疫膠體金試紙條檢測方法,實驗室檢測證實能有效區分CDV、CPV、CAV2、RV,特異性良好。本研究研制的CDV檢測試紙條,在臨床應用方面仍需進一步研究完善,臨床樣本(口鼻、眼結膜分泌物)雜質多[17],檢測方法需進一步優化驗證。

