微生物菌劑對干旱脅迫下小麥生長生理和葉綠素?zé)晒鈪?shù)的影響研究
屈魏蕾,田玉磊,井方宇,孫婷婷,張蓓蓓
(陜西省災(zāi)害監(jiān)測與機理模擬重點實驗室/寶雞文理學(xué)院 地理與環(huán)境學(xué)院,陜西 寶雞 721013)
0 前言
植物在生長過程中會面臨多種非生物脅迫,干旱脅迫是植物最容易遭受的非生物脅迫之一,缺水是制約半干旱地區(qū)作物生長的關(guān)鍵因素之一[1-2]。研究表明,干旱脅迫會造成植物低矮、葉面積減少等變化,導(dǎo)致葉綠素含量下降、細(xì)胞活性氧(ROS)增加以及膜脂過氧化損傷,同時降低光合碳同化、光合相關(guān)酶活性[3],促使作物減產(chǎn),甚至?xí)?dǎo)致植物死亡。小麥?zhǔn)前敫珊档貐^(qū)廣泛種植的一種禾本科作物,養(yǎng)活了全世界35%~40%的人口[4]。因此,尋找干旱脅迫的改良措施對于提高小麥產(chǎn)量與品質(zhì)的穩(wěn)定性以及保障糧食安全具有重要的意義。微生物菌劑作為一類由有益微生物組成的新型肥料[5],近年來已被視為逆境環(huán)境下提高農(nóng)作物產(chǎn)量和質(zhì)量的優(yōu)良替代品。芽孢桿菌(Bacillus)是應(yīng)用最為廣泛的微生物菌劑之一,其能通過自身代謝分泌IAA、VOCs等刺激植物生長[6]。叢枝根菌真菌(Arbuscular Mycorrhiza Fungi, AMF)可以與植物共生,其菌絲可以通過分泌球囊霉素(GRSP)來提高土壤持水性,使根系從土壤吸收更多的營養(yǎng)和水分[7],從而提高作物的品質(zhì)及產(chǎn)量。芽孢桿菌和AMF皆能改善植物生長,促進土壤養(yǎng)分的良性循環(huán),幫助農(nóng)作物抵御干旱、鹽脅迫等逆境,促使作物增產(chǎn)增收[8-9]。
光合作用是作物積累生物量的生理過程,其對干旱較敏感。植物進行光合作用時,主要依靠葉綠體中的天線色素(Chl)吸收光能,光能會以光合電子傳遞、熱能、葉綠體熒光這3種形式被利用或釋放[10]。葉綠素?zé)晒饧夹g(shù)以生物膜流動為基礎(chǔ),可以不損傷植物的葉片,通過快速熒光誘導(dǎo)動力學(xué)曲線監(jiān)測植物光合生理的變化,從而可以了解在逆境脅迫、病蟲害危害、水肥管理中植物在光能利用、分配以及光合電子傳遞等方面的狀況[11]。近年來,關(guān)于干旱脅迫的研究多集中于作物生長生理[12]和光合特性[13]等方面;關(guān)于微生物菌劑與小麥互作的研究則多集中于小麥生長發(fā)育[14]、病害防治[15]、土壤改良[16]等方面,而對于嚴(yán)重干旱脅迫下微生物菌劑對小麥生長及光合熒光生理的研究較少。鑒于此,本文采用30%土壤含水量來模擬干旱脅迫,分析了在該脅迫下不同微生物菌劑接種對小麥生長及光合作用的改良效果,以期篩選出適宜的微生物菌劑接種方案,為提高小麥產(chǎn)量提供參考。
1 材料與方法
1.1 試驗材料
供試小麥品種為小偃22號。供試芽孢桿菌菌劑為枯草芽孢桿菌(Bacillus subtilis);供試叢枝菌根菌劑為根內(nèi)根孢囊霉(Rhizophagus intraradices)及異形根孢囊霉(Rhizophagus irregularis),其中,枯草芽孢桿菌購自綠龍生物科技有限公司,叢枝菌根菌劑由華南師范大學(xué)姚青老師提供。供試土壤由寶雞地區(qū)大田土壤和栽培基質(zhì)(用于增加土壤的疏松度)按5∶1混合而成,其全氮含量為1.51 g/kg,全磷含量為0.86 g/kg,pH值為7.40。
1.2 試驗設(shè)計
試驗于2022 年3 月在寶雞文理學(xué)院地理與環(huán)境學(xué)院植物生長模擬室進行。首先選擇顆粒飽滿的小麥種子,對其進行消毒、催芽處理,然后放置于25 ℃恒溫箱內(nèi),進行黑暗發(fā)芽;待種子露白后,將其播種于直徑為12 cm、高為10 cm 的花盆中,每盆定植10 株。設(shè)5 個處理:T1、T2、T3、T4分別接種菌劑Bs(枯草芽孢桿菌)、Rin(根內(nèi)根孢囊霉)、Bs+Rin、Rin+Rir(異形根孢囊霉);CK 不接種菌劑;每個處理3 次重復(fù)。將各處理的麥苗放置在FytoScope LED 光源培養(yǎng)箱中進行培養(yǎng),其光周期為光照16 h/黑暗8 h,晝/夜溫度為25 ℃/15 ℃。芽孢桿菌菌劑按0.5 kg/hm2的劑量接種;叢枝菌根菌劑按每盆15 g 的劑量均勻接種至土壤表面1~2 cm 深處;雙菌接種時每種菌劑的劑量減半。采用稱重法每隔1 d 補水1 次,使土壤含水量保持在30%左右。
1.3 測定指標(biāo)及方法
1.3.1 生長指標(biāo)及生理指標(biāo)的測定 在接種處理后第30天,每個花盆隨機選取1株小麥,利用直尺分別測定其株高(PH)、葉長(LL)和葉寬(LW);用萬分之一天平測定葉片的鮮重(FW),并將葉片在純水中浸泡24 h后測定其飽和重(TW),之后將葉片在75 ℃下烘干至恒重,測定其干重(DW)。比葉面積(SLA)根據(jù)公式SLA=(LL×LW×0.75)/DW計算;葉片含水量(RWC)根據(jù)公式RWC(%)=(FW-DW)/(TW-DW)×100%計算。
可溶性蛋白含量采用考馬斯亮藍(lán)G-250法測定[17];可溶性糖含量采用蒽酮法測定[18];葉綠素含量用乙醇—丙酮(體積比為1∶1)法測定[19]。
1.3.2 葉綠素?zé)晒庹T導(dǎo)動力學(xué)曲線和參數(shù)的測定 采用FluorPen FP 100 Max(Brno, Czech)對不同微生物菌劑處理下的小麥葉片進行測定。先隨機選取葉片進行20 min暗適應(yīng),再測定快速熒光誘導(dǎo)動力學(xué)曲線,相關(guān)的熒光參數(shù)如表1所示。利用Vt=(Ft-Fo)/(Fm-Fo)、△Vt=處理的Vt-對照的Vt對OJIP曲線進行歸一化處理,得到標(biāo)準(zhǔn)化后的相對可變熒光曲線Vt以及相對于對照的可變熒光曲線△Vt。
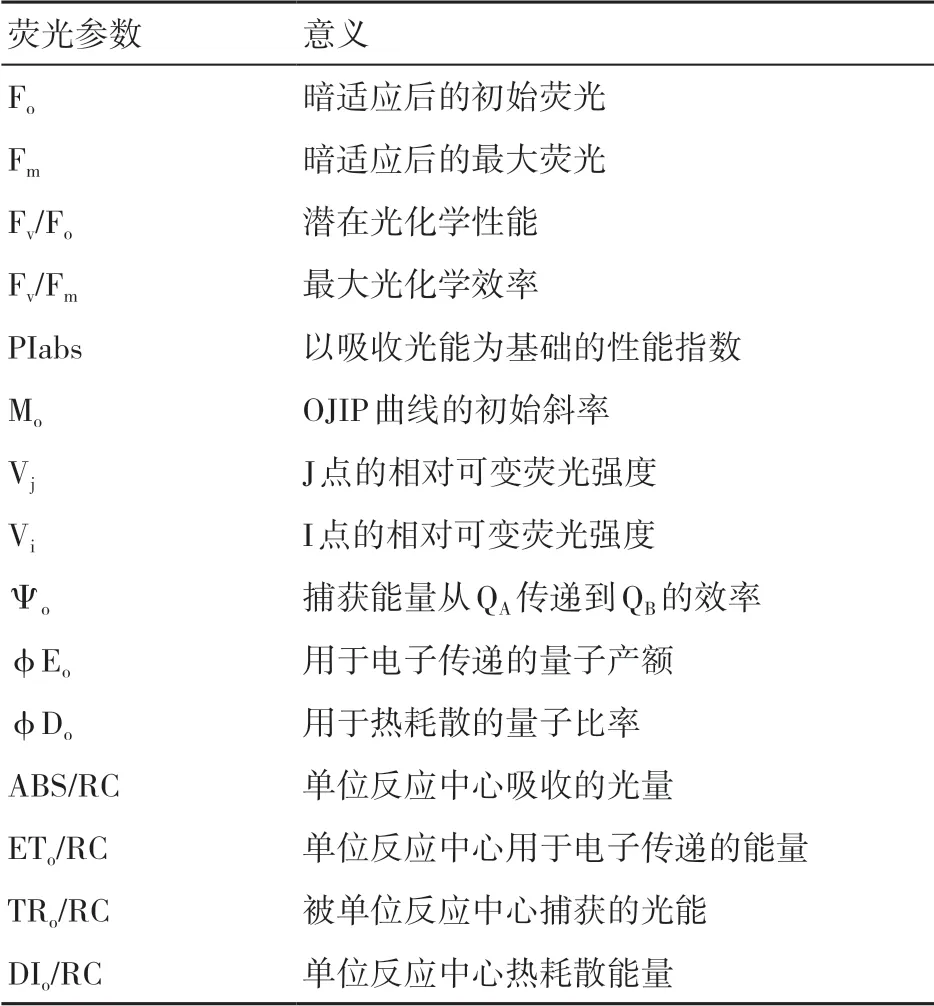
表1 葉綠素?zé)晒獾南嚓P(guān)參數(shù)
1.4 數(shù)據(jù)處理
采用Excel 2016軟件整理試驗數(shù)據(jù);用SPSS 25.0軟件進行單因素方差分析;采用LSD法進行差異多重比較(P<0.05);利用Origin 2021軟件制作插圖。
2 結(jié)果與分析
2.1 不同微生物菌劑對小麥生長的影響
由表2可知,不同微生物菌劑處理下小麥的株高、葉長、葉重、比葉面積以及葉片含水量均有顯著性差異(F=25.17、7.54、42.50、5.63、8.98,P<0.05)。其中,T4處理下小麥的長勢最好,其株高、葉長、葉重、比葉面積及葉片含水量分別較CK增加了44.01%、23.03%、71.88%、18.89%和0.11個百分點;T2處理小麥的長勢次之,其株高、葉長、葉重、比葉面積及葉片含水量均較CK有所增加。說明在干旱脅迫下,不同接菌處理均能顯著促進小麥的生長,但以T4處理的促生效果最好,T2次之。
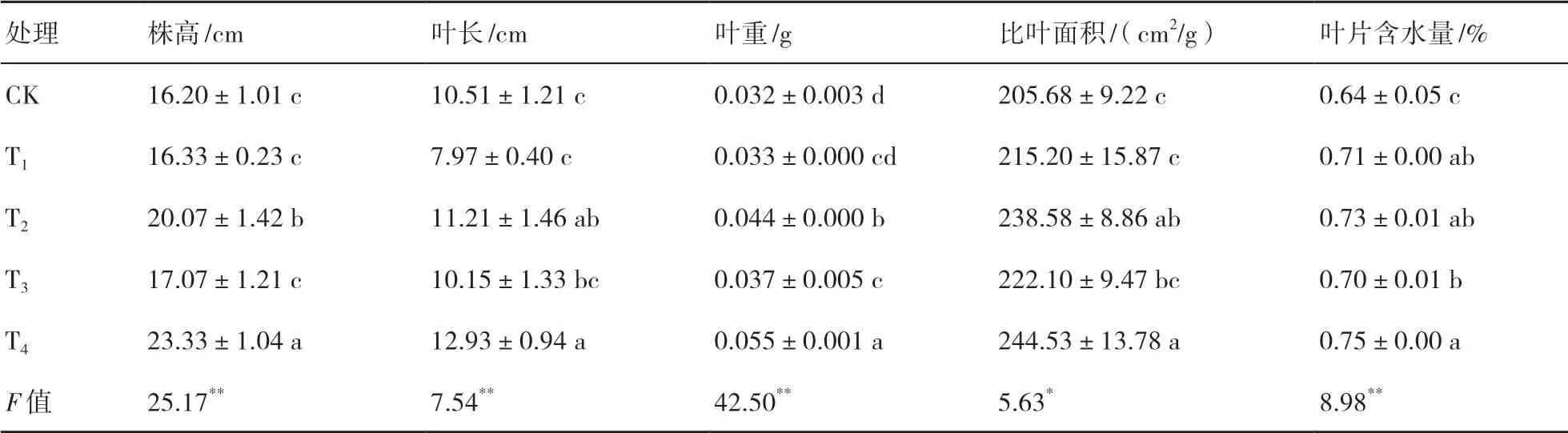
表2 菌劑接種對小麥生長的影響
2.2 不同微生物菌劑對小麥生理的影響
由表3可知,在不同處理下小麥的可溶性蛋白、可溶性糖、葉綠素a、葉綠素b以及總?cè)~綠素含量具有顯著性差異(F=20.24、87.89、469.08、10.58、122.67,P<0.01)。可溶性蛋白、可溶性糖和葉綠素a含量均以T4處理最高,分別較CK高15.94%、100.67%和27.40%。葉綠素b和總?cè)~綠素含量均以T2處理最高,分別較CK高31.58%和27.17%。葉綠素a/b值以T2處理最小,T4處理最大,但各處理間差異不顯著(F=1.15,P>0.05)。說明在嚴(yán)重干旱脅迫下,T2和T4處理下小麥葉片吸收和捕獲的光能較多,光合效能較強。
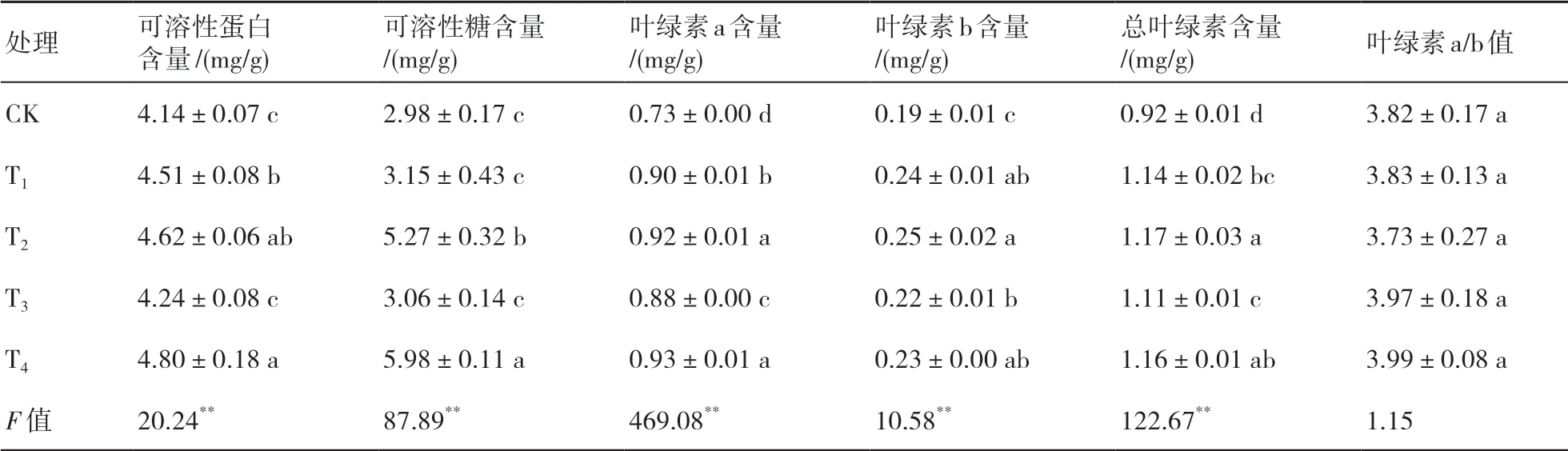
表3 菌劑接種對小麥葉片生理的影響
2.3 不同微生物菌劑對小麥葉片葉綠素?zé)晒鈪?shù)的影響
由表4可以看出,接菌處理對小麥葉片的Fo和Fm均有顯著影響(P<0.01)。在不同微生物菌劑處理下,F(xiàn)o在T3處理下達到最大,與其他處理存在顯著差異(P<0.05);Fm以T4處理最大,與T1、CK差異顯著(P<0.05),且以CK下最小。Fv/Fo反映PSⅡ反應(yīng)中心的潛在活性[20];Fv/Fm是PSⅡ的最大光化學(xué)效率,反映植物的光抑制程度[21]。Fv/Fo、Fv/Fm均在T4處理下達到最大,分別較CK增加了50.92%和9.21%。PIabs是光化學(xué)性能指數(shù),反映植物光合機構(gòu)的整體狀態(tài)[22],較Fv/Fm更加靈敏,其在T2處理下最高,T4處理次之,且這2個處理顯著高于其他處理的。
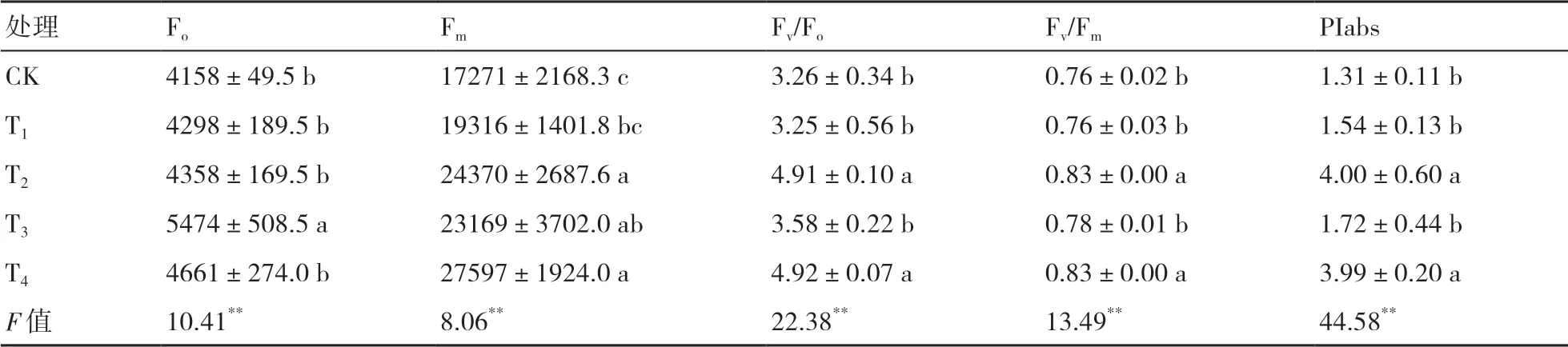
表4 菌劑接種對小麥葉片葉綠素?zé)晒鈪?shù)的影響
Mo、Vj、Vi、Ψo、φEo、φDo等參數(shù)可以反映PSⅡ受體側(cè)的變化[23]。Mo代表PSⅡ的初始斜率。從表5可以看出,Mo在CK下達到最大,顯著高于T2和T4處理的,說明在CK下QA-被還原的程度最大,電子傳遞能力最弱。Vj和Vi分別表示PSⅡ在J和I點時反應(yīng)中心的關(guān)閉程度,均以CK最高。Ψo和φEo以T4處理最大,說明在T4處理下電子傳遞的量子產(chǎn)額和相對速率最大。φDo為用于熱耗散的量子比率,以CK、T1處理最大,與T2、T4存在顯著差異,說明CK、T1用于熱耗散的電子較多。
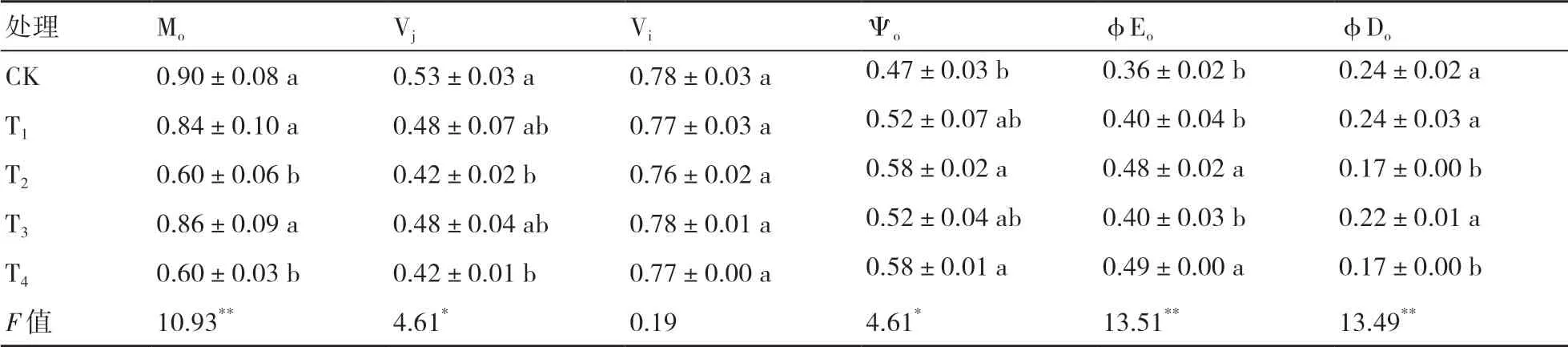
表5 菌劑接種對小麥PSⅡ受體側(cè)的影響
活 性 參 數(shù)ABS/RC、TRo/RC、ETo/RC和DIo/RC能反映PSⅡ中光合機構(gòu)對光能的吸收、傳遞以及耗散狀況[13]。由表6可知:T1、T3處理的ABS/RC、TRo/RC、ETo/RC較CK均有所增加,但無顯著差異;T2、T4處 理 的ABS/RC、TRo/RC、DIo/RC較CK顯 著下降,而ETo/RC較CK略微增加,差異不顯著。
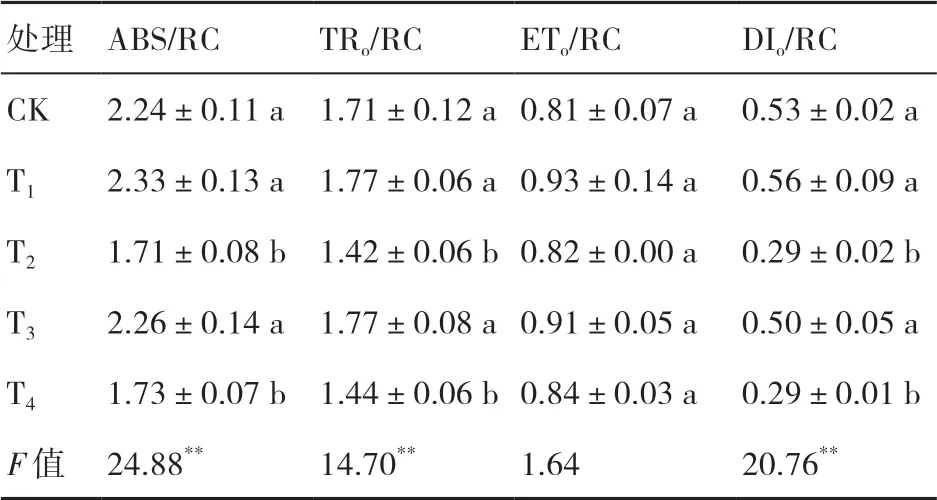
表6 菌劑接種對小麥PSⅡ反應(yīng)中心活性參數(shù)的影響
2.4 不同微生物菌劑對小麥OJIP曲線的影響
葉綠素快速熒光誘導(dǎo)(OJIP)曲線能反映PSⅡ反應(yīng)中心的原初光化學(xué)反應(yīng)信息[24]。J相熒光強度的升高與部分光反應(yīng)中心的閉合相關(guān),反映了QA-的還原水平及累積程度;I相與QB、PQ庫的還原程度相關(guān);P相與PSI受體側(cè)電子受體的還原相關(guān)[25]。在不同微生物菌劑處理下小麥葉片的OJIP曲線如圖1A所示:在O點(0.02 ms)時,在各處理間小麥葉片的熒光強度差異較小,以T3處理最高,CK最低;在J點(2 ms)時,在各處理間熒光強度的差異逐漸增大,但仍然以T3最高,T2和T4次之,三者分別比CK高28.89%、25.83%和25.55%;在I點(30 ms)時,在各處理間熒光強度差異顯著增大,以T4處理的熒光強度最大,比CK、T1、T2、T3處理分別高46.22%、26.64%、5.08%和7.45%;在P點時,各處理的熒光強度在達到最大值后趨于穩(wěn)定,表現(xiàn)為T4>T2>T3>T1>CK。
歸一化處理可以減少誤差,更加真實地反映小麥葉片的光化學(xué)過程[22]。由標(biāo)準(zhǔn)化后的相對可變熒光Vt(圖1B)可知,在不同微生物菌劑處理間Vt值在J點的差異最為顯著。從相對于CK的可變熒光ΔVt(圖1C)可以看出,隨著時間的推移,在各處理之間的ΔVt值差異呈先增大后減小的變化趨勢,且ΔVt值大多小于0,說明接菌處理提高了放氧復(fù)合體的OEC活性,有效地緩解了水分虧缺對小麥葉片光系統(tǒng)的傷害。
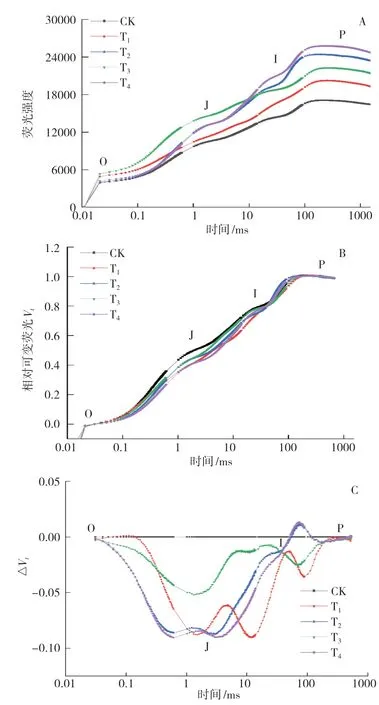
圖1 菌劑接種對小麥葉片OJIP曲線(A)、V(tB ) 和ΔV(tC)的影響
2.5 不同微生物菌劑對小麥葉片光響應(yīng)曲線的影響
對比5種不同處理的小麥葉片光響應(yīng)曲線(圖2),可以看出:T2、T4處理下葉片的量子產(chǎn)額(QY)在50 μmol/(m2·s) PPFD左右達到最大值0.64,表明其光補償點(LCP)在50 μmol/(m2·s)PPFD左右;在其余處理下葉片的QY在20 μmol/(m2·s) PPFD左右達到最大值。上述結(jié)果表明T2、T4處理下的小麥更適宜在光照下生長。
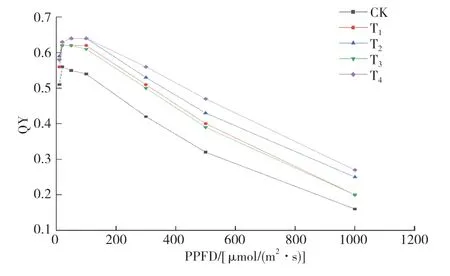
圖2 不同菌劑接種下小麥葉片量子產(chǎn)額(QY) 的光響應(yīng)曲線
2.6 不同處理下小麥葉片生長、生理指標(biāo)與葉綠素?zé)晒鈪?shù)的相關(guān)性分析
由表7可以看出:小麥葉片的生長指標(biāo)(株高、葉長、葉重、比葉面積、葉片含水量)與葉綠素?zé)晒鈪?shù)(Fv/Fo、Fv/Fm、PIabs、Ψo、φEo)總體上呈顯著正相關(guān),而與Mo、Vj、φDo、ABS/RC、TRo/RC、DIo/RC總體上呈顯著負(fù)相關(guān);小麥葉片的生理特性指標(biāo)(可溶性蛋白、可溶性糖、葉綠素a、葉綠素b、總?cè)~綠素含量)與Fv/Fo、Fv/Fm、PIabs、Ψo、φEo均呈顯著正相關(guān),而與Mo、Vj、φDo、ABS/RC、TRo/RC、DIo/RC均呈負(fù)相關(guān);葉片葉綠素a/b值與Fv/Fo、Fv/Fm、PIabs、Ψo、φEo呈負(fù)相關(guān),與其余參數(shù)呈正相關(guān)。
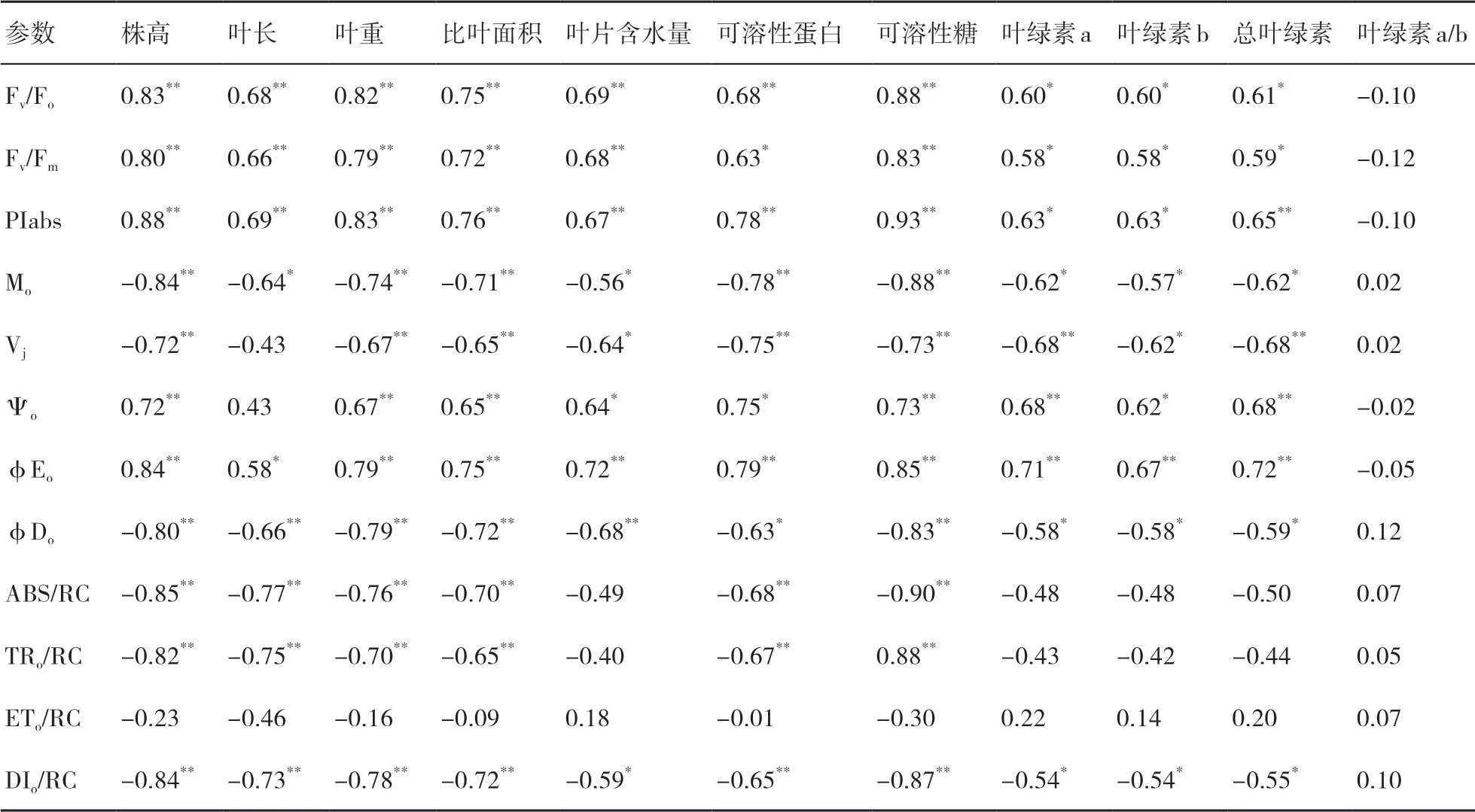
表7 小麥生長、生理指標(biāo)與葉片葉綠素?zé)晒鈪?shù)間的相關(guān)系數(shù)
3 小結(jié)與討論
前人的研究結(jié)果表明,干旱會抑制植物的生長和產(chǎn)量的提高,而適量的微生物菌劑可以改善植物的生長狀況,緩解干旱壓力[26];其本質(zhì)是利用不同菌種的功能提高植物生存所需要的養(yǎng)分含量或改善植物根系的生長[12]。在本試驗中,接種不同微生物菌劑能有效地提高小麥的株高、葉長、葉重、比葉面積和葉片含水量,其中接種Rin+Rir的生長效果最好,其原因可能是叢枝菌根混合接種提高了菌根的侵染率,易于在小麥根際形成更加復(fù)雜的菌絲網(wǎng)絡(luò),從而改善了小麥植株的營養(yǎng)與水分狀況,提高了葉片的水分傳導(dǎo)率。這與在玉米上的研究結(jié)果[27]類似。
本試驗發(fā)現(xiàn),接種微生物菌劑對小麥葉片的生理指標(biāo)(可溶性糖、可溶性蛋白、葉綠素a、葉綠素b及總?cè)~綠素含量)都有顯著的提升效果。洪文君等[28]研究發(fā)現(xiàn)微生物菌肥能減緩?fù)脸料阌酌缛~綠素的分解;適量施磷可以促進葉片葉綠素的合成[29]。本試驗發(fā)現(xiàn)接種Rin和Rin+Rir后小麥葉片的葉綠素a、葉綠素b和總?cè)~綠素含量均處于較高的水平,這可能是由于根內(nèi)根孢囊霉和異形根孢囊霉雙接種處理更有效地活化了土壤中的磷,提高了磷元素的有效性[30],使植物對土壤磷的吸收能力增強,從而促進了葉片ATP、NADPH的合成,有效地減緩了干旱對葉片葉綠素合成的抑制作用。可溶性蛋白和可溶性糖含量通常是反映植物細(xì)胞、組織的滲透調(diào)節(jié)能力以及植株代謝能力的指標(biāo)。本試驗結(jié)果表明,經(jīng)接菌處理后小麥葉片的可溶性糖和可溶性蛋白含量都有顯著提高,植株長勢也優(yōu)于對照,說明接菌能有效地增加小麥植株內(nèi)滲透調(diào)節(jié)物質(zhì)的含量。這是由于接菌有利于增強植物體內(nèi)的淀粉水解作用,從而促使糖類不斷積累,同時通過調(diào)節(jié)自身激素促進氨基酸合成為可溶性蛋白[31];此外接菌后形成的菌根結(jié)構(gòu)可以增強小麥根系對水分的吸收,減緩干旱脅迫對植物細(xì)胞和組織的損傷,保證植株代謝活動的正常進行。
葉綠素?zé)晒鈪?shù)能反映接菌處理對干旱脅迫下小麥葉片光反應(yīng)系統(tǒng)PSⅡ的影響。在本試驗中,Rin+Rir處理提升了小麥葉片的Fo、Fm值,說明該處理增大了葉片的熒光強度,降低了PSⅡ反應(yīng)中心的非輻射耗散,從而提高了葉片對光能的捕獲能力[32]。其次,在Rin和Rin+Rir處理下小麥葉片的Fv/Fm、Fv/Fo、PIabs值較大,表明在這2個處理下小麥葉片的光合性能較優(yōu),比其他處理更能有效地減緩干旱脅迫的光抑制效應(yīng)[23]。同時,接種Rin和Rin+Rir處理導(dǎo)致PSⅡ受體側(cè)參數(shù)Mo、Vj、Vi較CK顯著降低,說明接種Rin和Rin+Rir處理能有效地減少Q(mào)A-的積累,減小PSⅡ受體側(cè)的電子傳遞阻力,同時可以提高PQ庫的電子接受能力[13]。與CK相比,其他接菌處理的Ψo、φEo增大而φDo減小,這進一步說明接菌處理可以減少還原QA的能量,將能量更多地用于PSⅡ電子傳遞[25]。綜合上述結(jié)果可知,接種Rin和Rin+Rir處理的小麥葉片的光反應(yīng)活性居前2位,這與張文科等[33]的研究結(jié)果一致。同時,經(jīng)Rin和Rin+Rir處理的小麥葉片的ABS/RC、TRo/RC、ETo/RC、DIo/RC較低,說明這2個處理能更好地維持干旱脅迫下PSⅡ反應(yīng)中心吸收和捕獲的能量轉(zhuǎn)移之間的能量平衡[34-35]。
OJIP曲線可以清晰地反映小麥葉片PSⅡ的光合生理的變化。與CK相比,接菌處理的熒光值在OJ段差異逐漸增大,說明葉片的ROC數(shù)量減少,而QA-的積累量增加;在JI段和IP段熒光值大幅上升,說明PQ庫的電子數(shù)量減少,PQH2向PSⅠ末端電子受體(鐵氧還原蛋白和NADP)的電子轉(zhuǎn)移速率和量子產(chǎn)率增加[10,36]。對比OJIP、Vt和ΔVt曲線并結(jié)合PIabs來看,Rin+Rir為本試驗條件下的最適處理,說明根內(nèi)根孢囊霉+異形根孢囊霉混合接種處理可以有效地保護小麥葉片的PSⅡ,使小麥葉片表現(xiàn)出更強的光合能力和更高的光化學(xué)效率。
本研究的相關(guān)分析結(jié)果表明,在小麥植株生長指標(biāo)、生理指標(biāo)、葉片葉綠素?zé)晒鈪?shù)之間具有顯著的相關(guān)性,推測是由于微生物菌劑接種處理不同程度地改善了小麥根際環(huán)境和土壤團聚體結(jié)構(gòu),促進了小麥對水分、N、P 等營養(yǎng)元素的吸收[6-9,27,30]。
綜上所述,在4種微生物菌劑接種處理下小麥的生長、生理指標(biāo)以及光合性能均有所提高。其中,在Rin+Rir處理下小麥的株高、葉面積、葉重和葉片含水量達到最大,長勢最好,且可溶性蛋白、可溶性糖、葉綠素含量和PSⅡ光化學(xué)性能也得到了顯著提升,因此,Rin+Rir處理為本研究條件下的最適菌劑接種方案。
- 江西農(nóng)業(yè)學(xué)報的其它文章
- 我國農(nóng)業(yè)生產(chǎn)轉(zhuǎn)型及其環(huán)境效應(yīng)的空間規(guī)劃與實施路徑
- 綠色農(nóng)業(yè)視角下新疆農(nóng)業(yè)生產(chǎn)效率研究
- 沙雅縣農(nóng)戶綠色農(nóng)業(yè)技術(shù)采納行為的影響因素研究
- 全球糧食危機背景下中國糧食安全問題研究
- 鄉(xiāng)村振興戰(zhàn)略背景下陜西省城鄉(xiāng)融合測度研究
- 人口城鎮(zhèn)化背景下產(chǎn)業(yè)技術(shù)創(chuàng)新、結(jié)構(gòu)調(diào)整和空間聚集對碳排放的影響研究

