深色有隔內生真菌Ochroconis guangxiensis X22誘導子對香蕉的促生和抗枯萎病效果
邱美莎,張艷,曾鳳花,林珊宇,龍艷艷,孫正祥*,謝玲*
(1長江大學農學院,湖北荊州 434025;2廣西農業科學院植物保護研究所/農業農村部華南果蔬綠色防控重點實驗室/廣西作物病蟲害生物學重點實驗室,廣西南寧 530007)
0 引言
【研究意義】香蕉枯萎病是由尖孢鐮刀菌古巴專化型(Fusarium oxysporumf.sp.cubense,Foc)侵染引起的一種毀滅性土傳病害(Ploetz,2015),近年來該病害發生面積呈上升趨勢,對香蕉產業造成了嚴重影響。目前化學防治被認為是植物病害最有效的防治手段,但長期大量使用農藥容易引發病原菌產生抗藥性,同時對人、畜和環境造成危害。抗病、高產和優質在作物育種中仍難以兼顧和突破,因此環保友好的生物防治逐漸成為學者們的研究熱點。已報道具有良好生防潛力的菌株有芽孢桿菌(Bacillus)、假單胞菌(Pseudomonas)和鏈霉菌(Streptomyces)等(楊迪等,2021;Li et al.,2021)。雖然防治香蕉枯萎病的微生物報道較多,但受土壤環境因子影響較大,大多數菌株田間防效不穩定,因此,篩選新的生防菌株及其代謝物對香蕉產業的健康發展具有重要意義。【前人研究進展】深色有隔內生真菌(Dark septate endophyte,DSE)是定殖在植物根組織但對宿主無致病性的一類植物共生真菌,菌絲深色有分隔,能形成“微菌核”(Jumpponen and Trappe,1998)。DSE通過與宿主植物互惠共生,促進植物生長發育,提高植物的抗逆性和抗病蟲能力(劉茂軍等,2009)。Narisawa等(2004)發現從植物根系中分離的DSE生防菌株福廷頭瓶霉(Phialocephala fortinii)對大白菜黃萎病的防治效果達80%以上。Zhang等(2022)發現DSE生防菌株P.fortiniiJ2PC4能有效降低南方水稻黑條矮縮病的發病率,防效達28.5%,并對傳播媒介白背飛虱具有明顯的致死作用。誘導植物抗性是植物抵御病原菌侵染的重要機制之一(Lahlali et al.,2014),近年來許多學者提出一類新型的植物調節因子——誘導子,誘導子最早是指一種能誘導植保素合成的物質,隨著研究的深入,目前廣泛指能誘導植物防衛反應的因子。王曉梅等(2006)從鏈格孢菌(Alternaria alternata)中提取的蛋白能顯著增強玉米對大斑病和銹病的抗性。陸紅霞等(2016)從真菌細胞壁提取的殼寡糖能有效防治辣椒炭疽病,濃度為100 mg/L的殼寡糖對辣椒炭疽病的防治效果達65%。Bouissil等(2022)從褐藻(Bifurcaria bifurcata)中提取的多糖能誘導棗椰樹防御基因的表達,從而降低由尖孢鐮刀菌引起的棗椰樹病害發生率,相對防效達80%。以上研究表明生物型真菌誘導子(如多糖、寡聚糖和激活蛋白類)具有調控植物生長發育、繁殖、防病和抗病等功能。【本研究切入點】目前,關于DSE對香蕉抗枯萎病誘導作用的報道甚少。菌株Ochroconis guangxiensisX22是本團隊前期分離獲得的一株新物種DSE菌株(Chen et al.,2020),前期研究表明菌株X22可顯著提高香蕉對枯萎病的抗病能力,但關于其誘導抗病機制尚不清楚。【擬解決的關鍵問題】通過提取菌株X22的菌絲體多糖、寡聚糖和激活蛋白,評價該3種物質對香蕉苗的促生效果及對香蕉抗枯萎病的誘導作用,初步探討O.guangxiensis誘導香蕉抗病的作用機制,為香蕉枯萎病的誘抗劑開發打下理論基礎。
1 材料與方法
1.1 試驗材料
1.1.1 供試菌株與植物DSE菌株X22由植物內生菌與生物防治研究團隊從香蕉根圍分離篩選獲得,保藏于中國微生物菌種管理委員會普通微生物中心(保藏號:CGMCC NO.19656),已獲授權國家發明專利(專利號:ZL 202010731813.3)。香蕉枯萎病病原菌尖孢鐮刀菌4號生理小種(Foc4)由廣西作物病蟲害生物學重點實驗室分離保存;供試香蕉組培苗桂蕉1號購自廣西植物組培苗有限公司。
1.1.2 供試培養基.燕麥培養基(OMA):燕麥粉10.0 g、瓊脂粉10.0 g、MgSO4·7H2O 1.0 g、KH2PO41.5 g、NaNO31.0 g、蒸餾水1000 mL;水瓊脂培養基:瓊脂粉10.0 g、蒸餾水1000 mL;馬鈴薯葡萄糖固體培養基(PDA):葡萄糖20.0 g、土豆200.0 g、瓊脂15.0 g、蒸餾水1000 mL;馬鈴薯葡萄糖液體培養基(PDB):葡萄糖20.0 g、土豆200.0 g、蒸餾水1000 mL。
1.2 試驗方法
1.2.1 菌株X22對香蕉枯萎病的室內防效.菌株X22活化后接種于燕麥培養基上,每皿(d=5.5 cm)接3個大小相同(Ф=5 mm)的菌塊,待培養至第10 d菌落直徑達2.5 cm時,選擇株高長勢基本一致(高5~8 cm,3~5葉)的香蕉組培苗移栽至菌落上,使根系充分接觸菌株X22菌體,每個菌落移栽1株組培苗。將移栽后的香蕉苗放至組培瓶(直徑×高=7.5 cm×9.5 cm)內,于26℃、光強10000 lx和光周期為16 h/d的人工氣候箱中培養,以未接種菌株X22的香蕉組培苗為對照,每處理3個重復,每重復4皿。將Foc4在PDA培養基上活化后接種于水瓊脂培養基上培養(每皿接種3個菌塊),待菌株X22與香蕉苗共培養18 d后,將共生體轉移至含有Foc4的水瓊脂培養基上,對照組也接入帶有Foc4的水瓊脂培養基上培養20 d左右。觀察并記錄香蕉苗的發病情況與病級,計算病情指數。香蕉葉片病情分級參照曾莉莎等(2015)的方法:0級,無病害;1級,葉片黃化或萎蔫<50%;2級,葉片黃化或萎蔫≥50%;3級,葉片萎蔫或枯死,僅生長點存活;4級,整株枯死。病情指數=∑(病株株數×代表數值)(/株數總和×最高病級代表值);防治效果(%)=(對照病情指數-處理病情指數)/對照病情指數×100。
1.2.2 菌株X22及發酵濾液對Foc4菌絲生長的抑制作用
1.2.2 .1 菌株X22對Foc4的抑制作用.采用兩點對峙法(周瑩等,2020)測定。在PDA平板左側接種菌株X22菌餅(Ф=5 mm),距中心2.0 cm,7 d后在右側對稱接種Foc4菌餅,以單獨接種Foc4的PDA平板為對照,每組5皿,3個重復,28℃倒置培養20 d,觀察Foc4菌落的生長情況。
1.2.2 .2 菌株X22發酵濾液對Foc4的抑制作用.將菌株X22接種于PDB培養基中,120 r/min振蕩培養10 d后,使用3層無菌紗布過濾菌液,濾液經離心后過濾(Ф=0.22 μm)即為發酵濾液。將發酵濾液與PDA培養基(滅菌后降至50℃)以1∶3配制成平板,在平板中心接入Foc4菌餅(Ф=5 mm),以未混入發酵濾液的PDA平板接入Foc4為對照,每組5皿,重復3次,置于28℃培養。待對照組中Foc4近乎長滿平板時觀察并記錄Foc4的生長狀況。
1.2.3 菌株X22寡聚糖、多糖和激活蛋白的提取使用勻漿法制備真菌細胞壁。將活化后的菌株X22菌塊接入PDB培養基,置于搖床中28℃下120 r/min振蕩培養14 d,然后用3層滅菌紗布過濾收集菌絲體并稱重,將菌絲體與0.5 mol/L的NaCl溶液按1∶5混合,高速攪拌破碎至勻漿液,用濾紙過濾并用0.5 mol/L NaCl洗滌2次,收集到的菌絲體即為菌體細胞壁,將其真空干燥待用。參照劉元召等(2008)利用熱解法提取菌株X22的寡聚糖,將菌體細胞壁與雙蒸水按1 g∶100 mL懸浮,于高壓滅菌鍋中121℃加壓保溫3 h,置于室溫冷卻后8000 r/min離心10 min,收集上清液,并用0.2 μm的微孔濾膜過濾,使用旋轉蒸發儀將濾液體積濃縮至5%后凍干至粉末;參照郭志勇等(2003)利用浸提法提取菌株X22的多糖,將菌體細胞壁破碎后置于80℃水浴浸提3次,收集的上清液按1∶5加入無水乙醇于4℃醇析過夜,用去離子水充分溶解收集沉淀,采用Sevag法脫蛋白3~7次,最后用無水乙醇靜置醇析,收集沉淀經冷凍干燥即得多糖;參照仲新華等(2005)的方法提取菌株X22的激活蛋白,將菌壁研磨至粉末狀加入0.05 mol/L磷酸提取緩沖液,加熱煮沸15 min后迅速放于冰水混合物中,待其降溫后于冷凍離心機(12000 r/min,20 min)離心,收集上清液加入10%硫酸銨,置于0℃條件下沉淀粗蛋白30 min,離心收集沉淀并用提取液溶解后過脫鹽柱1~2次即獲得激活蛋白。
1.2.4 菌株X22提取物對香蕉苗生長的促生作用建立水培系統種植香蕉苗,采用水培試驗評價提取物對香蕉生長的作用。將香蕉組培苗根部清洗干凈,挑選大小均一(3~4葉)的香蕉組培苗待用。使用透明塑料杯作為水培杯培育香蕉苗,杯底使用陶粒鋪平墊底,盆中加滿純凈水,杯上放置厚度為2~3 cm的泡沫板并開孔用以固定香蕉組培苗,每杯放置7株苗,加入適當的營養液以保證其生長,待香蕉苗長至4~5葉即可進行提取物處理。將塑料杯中水倒掉,分別添加寡聚糖、多糖和激活蛋白提取物進行水培試驗,3種提取物的濃度均為50 mg/L。設4個處理:(1)X22-激(菌株X22激活蛋白);(2)X22-寡(菌株X22寡聚糖);(3)X22-多(菌株X22多糖);(4)清水對照(CK),每處理2杯香蕉苗,3次重復。將所有處理置于人工氣候箱中培養,30 d后測量香蕉苗的株高、根長、鮮重、葉綠素含量、赤霉素(GA3)含量、吲哚乙酸(IAA)含量等指標。
1.2.5 菌株X22提取物對香蕉枯萎病的防治作用菌株X22提取物試驗設計同1.2.4。將香蕉苗設4個處理進行水培試驗,經提取物處理后第20 d,每杯香蕉苗澆灌35 mL Foc4孢子懸浮液(1×106CFU/mL),30 d后調查水培香蕉苗葉片的病情指數,解剖香蕉球莖,觀察并記錄發病情況,參照1.2.1公式,計算病情指數與防治效果。地上部分(葉片)病情分級標準與1.2.1相同。球莖病情分級標準參照謝玲(2018)的方法:0級,球莖健康無變色;1級,球莖變色面積占球莖面積<20%;2級,20%≤球莖變色面積占球莖面積<40%;3級,40%≤球莖變色面積占球莖面積<60%;4級,60%≤球莖變色面積占球莖面積<80%;5級,球莖變色面積占球莖面積≥80%。
1.2.6 菌株X22提取物對香蕉幾種抗病相關指標的影響.與1.2.5方法相同,將4個處理組的香蕉苗培養至20 d后,每杯澆灌35 mL濃度為1×106CFU/mL的Foc4孢子懸浮液,分別在接種后第1、3、5、7和9 d剪取香蕉頂端葉片,參照試劑盒(蘇州科銘生物技術有限公司)方法測定可溶性糖和脯氨酸(PRO)含量及多酚氧化酶(PPO)、過氧化物酶(POD)、超氧化物歧化酶(SOD)和苯丙氨酸解氨酶(PAL)活性。
1.3 統計分析
試驗數據通過Excel 2010和DPS 7.05進行處理和統計分析,采用Duncan’s新復極差法比較不同處理間的差異顯著性水平。
2 結果與分析
2.1 菌株X22對香蕉枯萎病的室內防治效果
從圖1可看出,對照香蕉組培苗接種Foc4后20 d,葉片發黃,呈現出香蕉枯萎病的典型癥狀,而先用菌株X22處理再接種Foc4的香蕉苗葉片顏色正常,植株相對健康粗壯,其防治效果為58.9%。

圖1 菌株X22對香蕉枯萎病的室內防治效果Fig.1 Indoor control effect of strain X22 on banana Fusarium wilt
2.2 菌株X22的菌體和發酵濾液對Foc4菌絲生長的抑制作用
由圖2可看出,菌株X22與Foc4對峙培養后無明顯的抑菌圈,菌絲相互交叉覆蓋,表明菌株X22對Foc4的菌絲生長無明顯的抑制作用。由圖3可看出,Foc4在混有菌株X22發酵濾液的平板上生長14 d后菌落大小、顏色與CK相比均無明顯差異,表明菌株X22的發酵濾液對Foc4菌絲生長也無明顯的抑制作用。
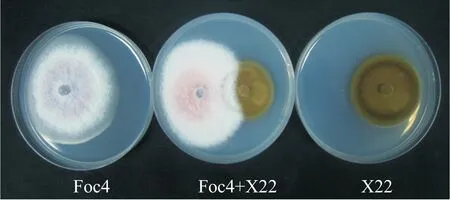
圖2 菌株X22對Foc4菌絲生長的抑制作用Fig.2 Inhibitory effect of strain X22 on the growth of Foc4 mycelium
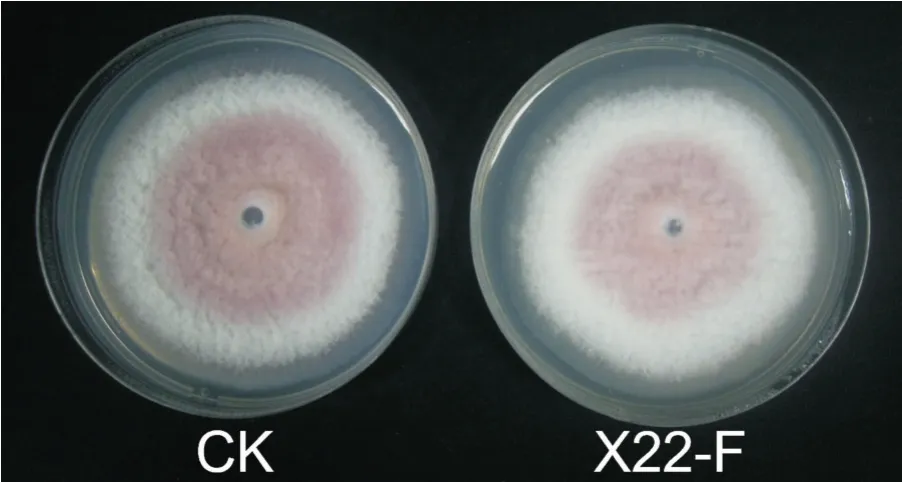
圖3 菌株X22發酵濾液對Foc4菌絲生長的抑制作用Fig.3 Inhibitory effect of strain X22 fermentation broth on Foc4 mycelium growth
2.3 菌株X22提取物對香蕉苗生長的促生作用
從表1可看出,X22-激、X22-寡和X22-多3種提取物均能提高香蕉的株高、根長及鮮重,其中,X22-激處理的香蕉苗株高、根長和鮮重分別較CK增加6.8%、50.5%和1.7%;X22-寡處理分別較CK增加6.8%、40.5%和0.6%;以X22-多處理的香蕉苗促生效果最明顯,株高、根長及鮮重分別較CK顯著增加16.9%、57.8%和3.9%(P<0.05,下同)。同時,X22-激、X22-寡和X22-多3種提取物均能增加香蕉苗頂葉的葉綠素、GA3和IAA含量,其中,X22-激處理的香蕉苗頂葉葉綠素、IAA和GA3含量分別較CK增加16.8%、24.2%和7.4%;X22-寡處理分別較CK增加19.5%、13.3%和10.3%;以X22-多處理對香蕉苗的促生效果最明顯,香蕉苗頂葉的葉綠素、IAA和GA3含量分別較CK增加15.2%、39.6%、11.8%。
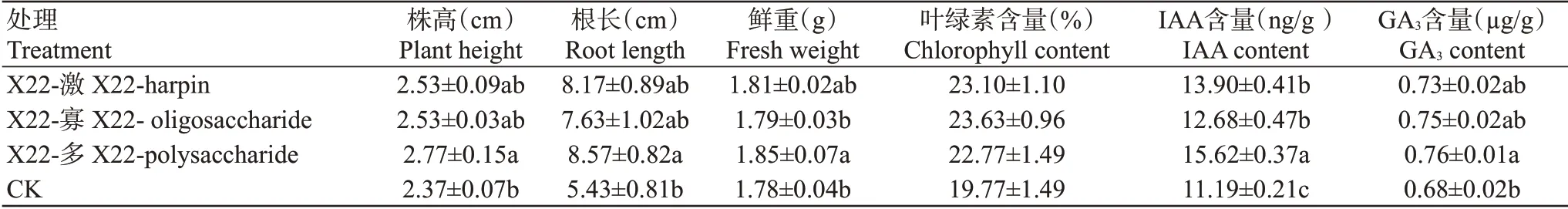
表1 菌株X22的3種提取物對香蕉苗的促生作用Table 1 Growth promotion function of three extracts from strain X22 on banana seedlings
2.4 菌株X22提取物對香蕉枯萎病的防治作用
由圖4和圖5可看出,對照香蕉苗葉片發黃,球莖解剖后不同程度變褐,而X22-激、X22-寡和X22-多3種提取物處理的香蕉苗發病較輕,對地上部分和地下部分香蕉枯萎病均具有一定的防效。其中地上部分的防效分別為31.90%、46.24%和43.37%,相互間無顯著差異(P>0.05);對地下部分的防效分別為23.46%、54.73%和39.09%,以X22-寡處理的防效最好,顯著高于其他2種提取物處理(表2)。
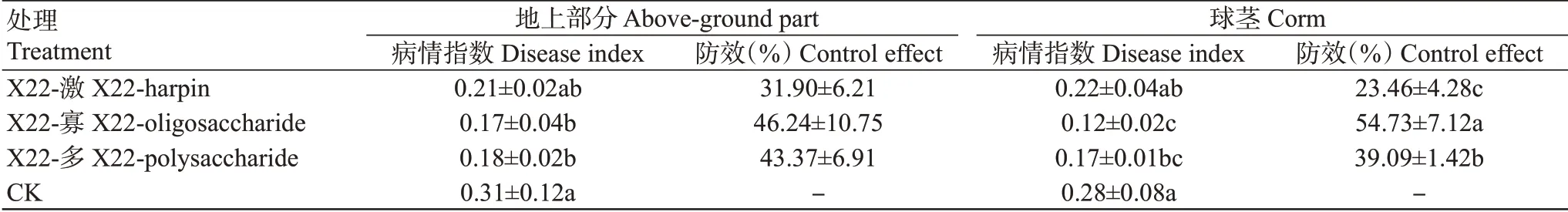
表2 菌株X22的3種提取物對香蕉枯萎病的防治作用Table 2 Control effect of the three extracts from strain X22 on banana Fusarium wilt

圖4 菌株X22的3種提取物對香蕉枯萎病的防治作用(地上部分)Fig.4 Control effect of the three extracts from strain X22 on banana Fusarium wilt(above-ground parts)
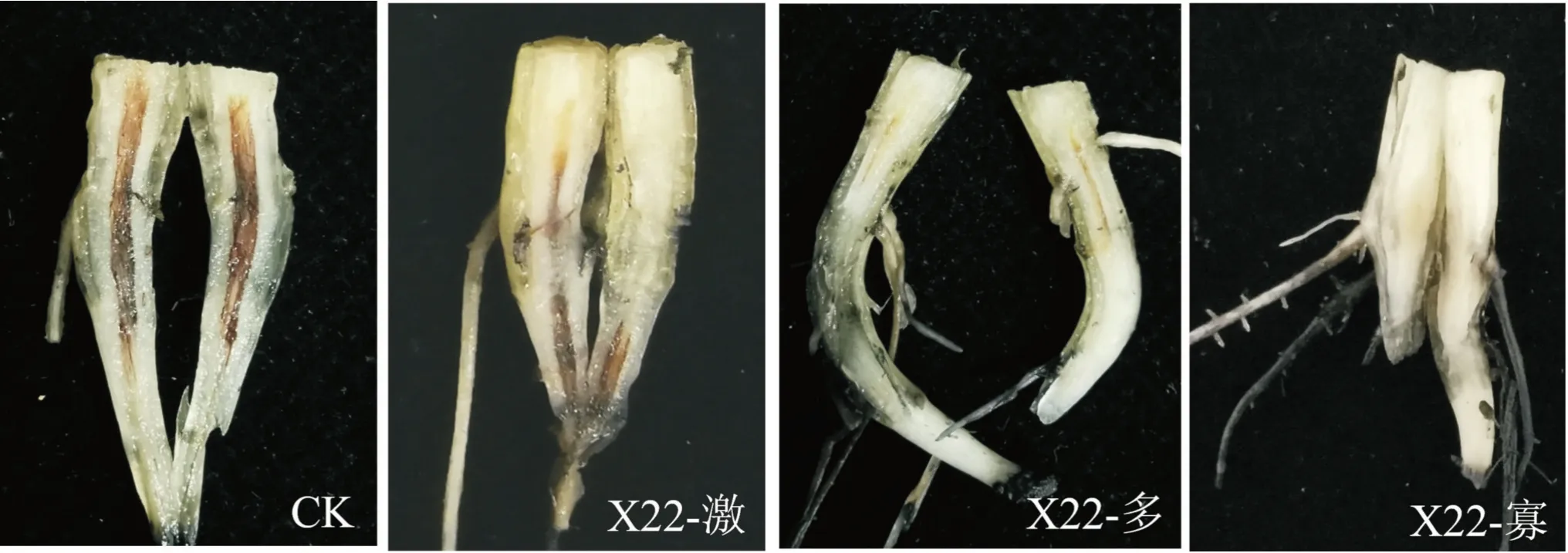
圖5 菌株X22的3種提取物對香蕉枯萎病的防治作用(地下球莖)Fig.5 Control effect of the three extracts from strain X22 on banana Fusarium wilt(corm)
2.5 菌株X22提取物對香蕉幾種抗病相關指標的影響
X22-激、X22-寡和X22-多3種提取物對香蕉葉片防御酶活性均有一定影響。對于SOD活性,X22-多處理的香蕉苗在1、3、5、7和9 d時均顯著高于對照,分別為CK的1.65、1.97、1.34、1.29和1.30倍(圖6-A)。對于POD活性,X22-多和X22-寡處理的香蕉苗在1、3、5、7和9 d時顯著高于對照,其中X22-多處理的香蕉苗分別為CK的1.61、1.11、1.18、1.62和1.26倍,X22-寡處理的香蕉苗分別為CK的1.72、1.11、1.31、1.42和1.82倍(圖6-B)。對于PAL活性,X22-多處理的香蕉苗在1、7和9 d時均顯著高于對照,分別為CK的1.43、1.57和1.17倍;X22-寡處理的香蕉苗在3、5、7和9 d時均顯著高于對照,分別為CK的1.93、2.65、1.27和1.14倍(圖6-C)。對于PPO活性,X22-多處理的香蕉苗在3、5、7和9 d時均顯著高于對照,分別為CK的1.92、2.38、3.96和1.23倍;X22-激和X22-寡處理的香蕉苗在1、3、5、7和9 d時均顯著高于對照,其中X22-激處理的香蕉苗分別為CK的1.26、2.32、2.32、3.95和1.78倍,X22-寡處理的香蕉苗分別為CK的1.81、2.44、2.12、3.25和1.75倍(圖6-D)。對于可溶性糖含量,X22-多處理的香蕉苗在7 d時顯著高于對照,為CK的1.36倍;X22-激處理的香蕉苗在7和9 d時均顯著高于對照,分別為CK的1.22和1.56倍;X22-寡處理的香蕉苗在5和7 d時均顯著高于對照,分別為CK的1.21和1.41倍(圖6-E)。對于PRO含量,X22-激和X22-寡處理的香蕉苗在1、3、5、7和9 d時均高于或顯著高于對照,其中X22-激處理的香蕉苗分別為CK的1.70、1.88、1.11、1.58和2.37倍,X22-寡處理的香蕉苗分別為CK的1.72、1.95、1.22、1.37和1.86倍;X22-多處理的香蕉苗在1、3、5和7 d時均顯著高于對照,分別為CK的1.74、2.06、1.33和1.21倍(圖6-F)。
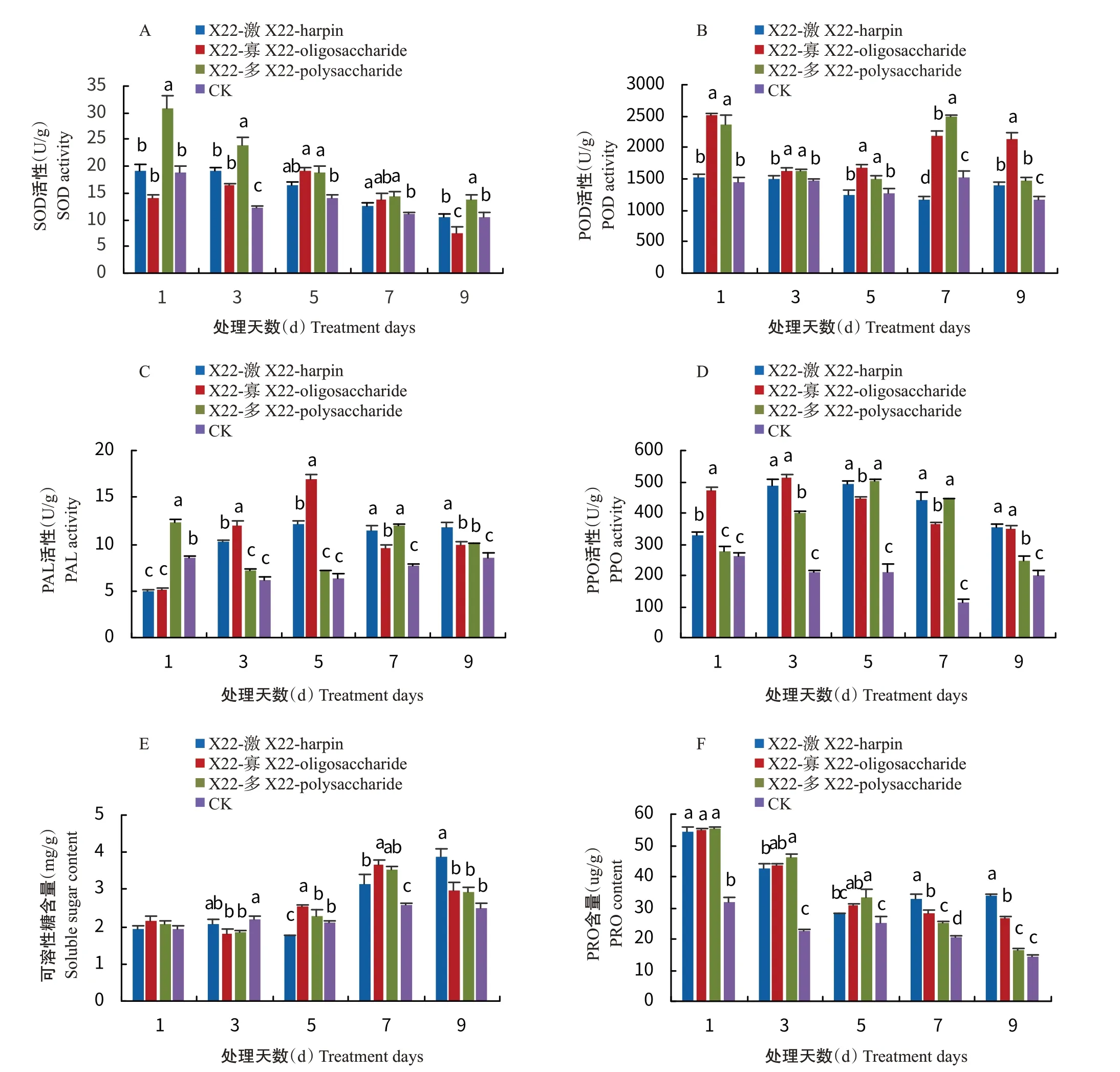
圖6 菌株X22提取物對香蕉幾種抗病相關指標的影響Fig.6 Effects of extracts from strain X22 on disease-resistance-related indexes of banana
3 討論
近年來,關于DSE防治植物病害的研究備受學者的關注。Terhonen等(2016)發現DSE真菌Phialocephala sphareoides能產生多種活性物質,可有效抑制小孔異擔子菌(Heterobasidion parviporum)對挪威云杉的侵染。Harsonowati等(2020)發現DSE真菌Cladophialophora chaetospiraSK51能促進草莓生長并對草莓枯萎病的防治效果達90.48%。本研究利用從香蕉根圍中分離得到的DSE菌株X22接種香蕉苗,發現對香蕉枯萎病的防治效果達58.7%,這是首次Ochroconissp.防治香蕉枯萎病的報道。另本研究發現菌株X22及其發酵濾液對Foc4菌絲生長無直接抑制作用,因此推測其抗病機理可能是由于某些物質誘導植物產生了抗性。
誘導植物系統抗性是內生真菌防治植物病害的作用機理之一。來源于真菌的寡聚糖、多糖和蛋白等誘導子物質在調節植物生長發育及誘導植物抗病方面發揮著重要作用(劉元召,2008)。本研究比較了3種DSE誘導子對香蕉組培苗的影響,從促生作用來看,多糖類誘導子相比于寡聚糖類和激活蛋白類誘導子可顯著促進香蕉的株高、根長和鮮重增長,分別較對照增加16.9%、57.8%和3.9%,且頂端葉片的GA3和IAA含量分別較對照顯著增加11.8%和39.6%。Zhao等(2014)發現苦蕎內生真菌菌絲多糖對蕎麥芽生長和蘆丁產量均有較佳的促進作用;田佩雯(2019)發現植物生長及活性物質含量受內生真菌1-N2誘導子的影響,且誘導子對白芨組培苗次生代謝物質的有效影響主要來源于1-N2中的多糖部分。本研究結果表明多糖誘導子對香蕉組培苗具有較佳的促生作用,與前人研究報道一致。而從抗病作用來看,3種類型的誘導子對香蕉枯萎病均有良好的誘抗效果,其中寡聚糖誘導子防治效果最佳,且對香蕉地下球莖的防效高達54.73%,與趙小明和杜昱光(2006)研究發現寡聚糖類誘導子種類豐富,對真菌病害具有良好的防治效果研究結論一致。有研究表明不同種類的誘導子被細胞受體識別的信息類型、時間和強度不同,且誘導反應的類型與強度也存在差異(張瑞芬等,2008)。本研究中的寡聚糖可能相較于多糖和激活蛋白更易與宿主相互識別,誘導香蕉苗產生更強的抗性。
防御酶活性的提高和滲透調節物質含量的增加在一定程度上表征了植物在抗病過程中細胞代謝和抵抗逆境能力的增強(Ascensao and Dubery,2000)。大量研究表明,多糖、寡聚糖和激活蛋白類物質可誘導植物產生不同的反應,特別是一些防御氧化酶酶活性的變化。張志剛等(2007)研究發現極細鏈格孢(Alterneria tenuissima)蛋白激發子能提高苗期棉花黃萎病的抗病相關酶活性。李培琴等(2015)利用從內生真菌Berkleasmiumsp.Dzf12中提取的寡聚糖處理宿主盾葉薯蕷培養物,發現能有效提高防御酶活性并激活宿主的防衛機制。本研究發現香蕉苗接種Foc4后,菌株X22的多糖、寡聚糖和激活蛋白均能明顯提高SOD、POD、PPO、PAL酶活性和增加可溶性糖、脯氨酸含量,且在1~9 d內表現出明顯的動態變化,其活性峰值均顯著高于對照。然而,本研究發現香蕉苗經3種提取物處理后并非所有防御相關酶活性一直高于對照,其滲透調節物質含量也存在這種情況,與胡桂馨等(2001)的研究結論一致,推測可能是由于施用不同種類誘導子激發了香蕉某種酶活性而抑制另一種酶的活性而引起。另外,本研究中的3種物質對香蕉苗相關酶活性的誘導以及對滲透調節物質含量的影響,在一定程度上揭示了誘導抗性的生理生化機制。
綜合本研究結果表明,菌株X22的多糖和寡聚糖對香蕉促生和抗枯萎病表現出較佳的誘導抗性作用。然而,誘導子之間存在著協同作用,可嘗試將2種效果較佳的誘導子配合后施加,以尋求更有效的誘導方式。目前內生真菌提高植物抗病性的機制包括競爭、抗生、重寄生和誘導植物抗性反應等(農倩等,2017;施文廣等,2021),本研究僅在誘導植物系統抗性方面作初步嘗試,并且本研究中提取的3種物質均為粗提物,今后將進一步提純鑒定出具體的物質,同時有關菌株X22防治香蕉枯萎病的生防機制還有待進一步深入研究。
4 結論
菌株X22及其多糖和寡聚糖提取物對香蕉苗具有促生與抗病作用,能明顯提高香蕉苗的株高、根長、鮮重等生物量,增加SOD、POD、PPO和PAL酶活性,提高可溶性糖和脯氨酸含量,可作為研制香蕉抗病誘抗劑的重要資源。

