基于SCoT分子標記的黃河鯉抗嗜水氣單胞菌不同群體遺傳多樣性分析
張嵐,姜淑泓,陳玉函,常樂,管俊翔,林強,于淼,喬志剛,王磊*
(1河南師范大學水產學院/河南省水產動物養殖工程技術研究中心/水產動物疾病控制河南省工程實驗室,河南新鄉 453007;2中國水產科學研究院珠江水產研究所,廣東廣州 510380)
0 引言
【研究意義】黃河鯉(Cyprinusy carpio)隸屬于鯉形目(Cypriniformes)鯉科(Cyprinidae),主產于黃河流域,是我國重要的淡水經濟魚類,也是我國四大淡水名魚之一;因其適應性廣,肉質鮮嫩,營養價值高且寓意美好而受到廣大消費者喜愛,目前已發展成為我國主要的淡水養殖品種之一。近年來,由嗜水氣單胞菌(Aeromonas hydrophila)等引起的敗血病頻發導致黃河鯉大量死亡(Jiang et al.,2022),給黃河鯉養殖業帶來巨大經濟損失。抗生素等藥物的廣泛使用極易造成細菌耐藥性增加及環境污染等問題(楊先樂和鄭宗林,2007)。因此,加快抗病品種培育對保障黃河鯉養殖業健康綠色發展具有重要意義。【前人研究進展】遺傳多樣性是一個物種群體生存適應和發展進化的前提。在遺傳相似性較高的宿主間,病原體傳播的可能性更高,而遺傳多樣性高的群體抵抗疾病暴發的能力更強(Altizer et al.,2003;King and Lively,2012;Gibson,2021;Pérez-González et al.,2021)。在羅氏沼蝦(Macrobrachium rosenbergii)(朱其建等,2013;董丁健和戴習林,2020)、尼羅羅非魚(Oreochromis niloticus)(張棟,2018)、凡納濱對蝦(Litopenaeus vannamei)(方振朋,2019)、黃顙魚(Pelteobagrus fulvidraco)(張佳佳,2019)中的研究均表明物種遺傳多樣性對其抗病性能、生長性狀、營養價值等方面具有積極作用。也有研究表明,近交過程中遺傳多樣性降低會從根本上影響種群抵御各種病原體的能力(Amills et al.,2004;Wang et al.,2020)。因此,抗病品種的選育通常伴隨著某些基因的雜合及群體遺傳多樣性的提高(董丁健和戴習林,2020)。目標起始密碼子多態性(SCoT)作為一種新型的分子標記(Collard and Mackill,2009),具有操作簡單、重復性好、可在物種中通用等優點(Gorji et al.,2011;Korir et al.,2012),特別是作為一種目的基因分子標記,不僅能獲得與性狀聯系緊密的目的基因,還能對性狀進行跟蹤,非常有利于分子標記輔助育種(Poczai et al.,2013)。目前,SCoT分子標記廣泛應用于農作物品種鑒定(Korir et al.,2012)、DNA指紋圖譜構 建(Cabo et al.,2014;Hamidi et al.,2014)及遺傳多樣性分析(Etminan et al.,2016;歐景莉等,2019)等研究領域。【本研究切入點】SCoT分子標記在水生生物中的研究主要集中在群體遺傳變異(Marie and Allam,2017;Abu Almaaty et al.,2020)及性別特異性分子標記篩選(Mohamed et al.,2019;Mahgoub et al.,2021)等方面,但針對魚類抗病育種的研究鮮見報道。【擬解決的關鍵問題】利用SCoT分子標記對黃河鯉抗嗜水氣單胞菌不同群體的遺傳多樣性及遺傳結構進行分析,探討遺傳多樣性與其抗嗜水氣單胞菌能力的關系,為黃河鯉的抗病育種提供理論依據。
1 材料與方法
1.1 試驗材料
供試黃河鯉(平均體質量130 g)購自山東省東阿縣繡青水產養殖專業合作社,暫養于室內有效養殖水體1.7 m3的帆布池中,水溫控制在(28±2)℃,持續24 h增氧,確認健康、無不良癥狀后用于后續試驗。嗜水氣單胞菌由中國水產科學研究院珠江水產研究所提供,4℃保存備用。
1.2 感染處理方法
將嗜水氣單胞菌菌液加入100 mL腦心浸液肉湯(BHI)培養基中,經28℃搖床(180 r/min)過夜培養12~18 h后取1 mL菌液進行PCR驗證,防止PCR擴增過程中受污染;菌液8000 r/min離心10 min,收集菌體,以無菌PBS進行重懸并稀釋至1.23×107CFU/mL。隨機挑選300尾黃河鯉放入試驗池中,水溫保持在(28±2)℃,暫養2 d,禁食。然后按照2 μL/g的劑量對每尾黃河鯉進行腹腔注射嗜水氣單胞懸液,腹腔注射后每2 h觀察1次,如遇魚體死亡及時撈出并記錄死亡時間,剪取鰭條保存于無水乙醇中。連續7 d無死亡后停止試驗并統計數據。
1.3 DNA提取與檢測
根據死亡順序分別選取最先死亡(The first dead population,FP)、最后死亡(The last dead population,LP)及存活(Survival population,SP)的黃河鯉各30尾,按照編號選取相應鰭條,取相同大小(約0.5 cm×0.5 cm)的鰭條剪碎,然后采用動物組織/細胞基因組DNA提取試劑盒(D2100-100T,北京索萊寶科技有限公司),按照試劑盒說明提取基因組DNA。以1.0%瓊脂糖凝膠電泳進行檢測,通過NanoDrop One/OneC微量核酸蛋白濃度測定儀測定DNA濃度,質量合格的DNA置于-20℃冰箱保存備用。
1.4 SCoT引物篩選及PCR擴增
隨機選取4份DNA樣品進行SCoT引物初篩選,從80條SCoT引物中篩選多態性好、重復性高、條帶清晰的引物(表1)。SCoT-PCR反應體系20.0 μL:2×TaqPCR Master Mix 10.0 μL,SCoT引物1.0 μL,DNA模板20 ng,ddH2O補足至20.0 μL。PCR擴增程序:95℃預變性4 min;95℃40 s,50℃50 s,72℃90 s,進行36個循環;72℃延伸10 min,PCR擴增產物4℃保存。取8.0 μL SCoT-PCR擴增產物經1.8%瓊脂糖凝膠電泳后,以BIO-RAD凝膠成像系統檢測并拍照保存。
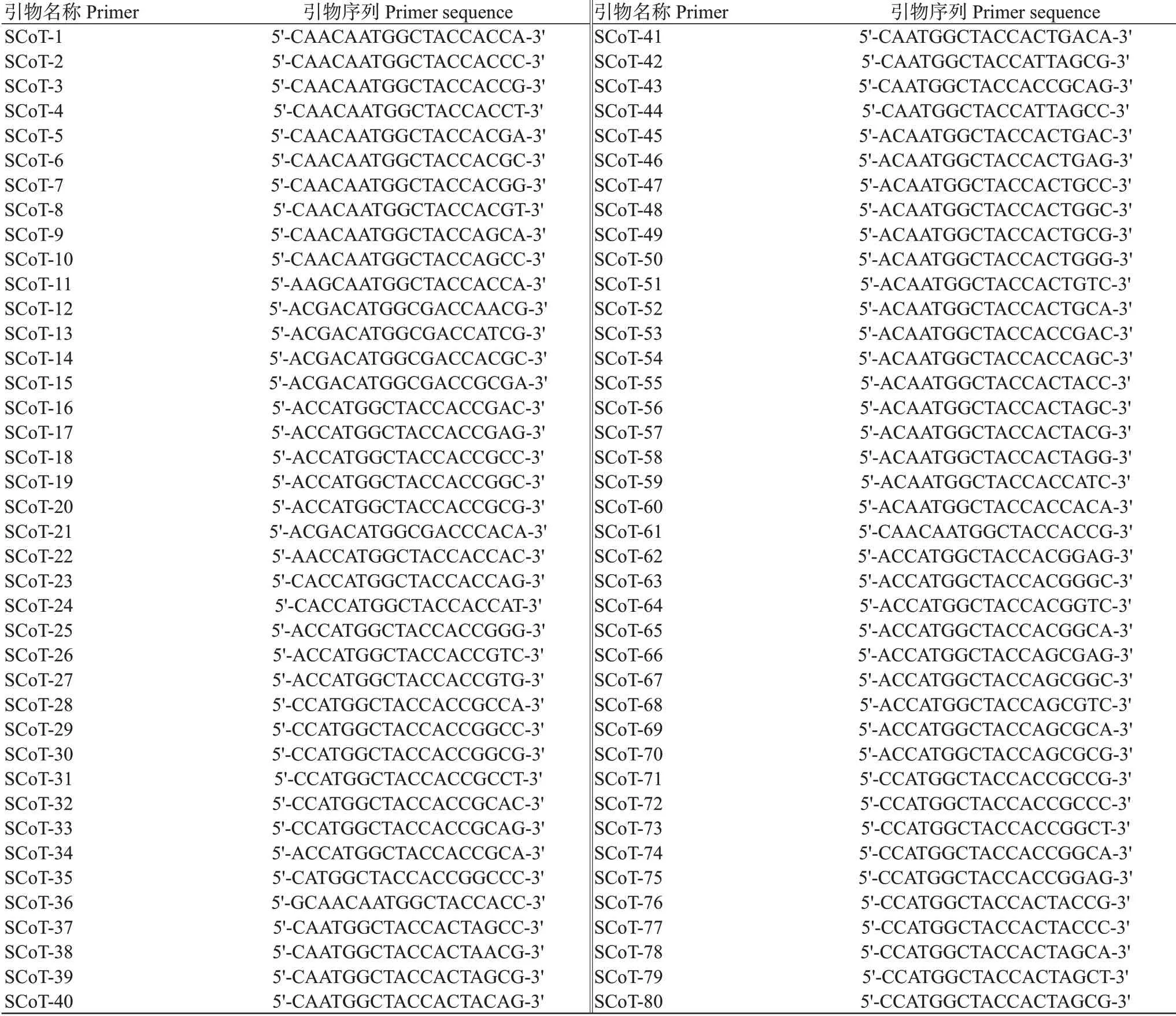
表1 80條SCoT引物的序列信息Table 1 80 SCoT primers and information of their sequences
1.5 統計分析
SCoT-PCR擴增產物按同一遷移水平下有無條帶分別賦值,有條帶記為1,無條帶記為0,人工讀取和統計條帶。使用PopGene32對3個黃河鯉群體的所有個體及群體等位基因數(Na)、有效等位基因數(Ne)、Nei's基因多樣性指數(H)和Shannon's信息指數(I)進行分析,采用Arlequin 3.5對黃河鯉3個群體進行分子方差變異(AMOVA)分析,通過MEGA 7.0中的非加權組平均法(UPGMA)進行聚類分析,并以Structure 2.3進行遺傳結構分析。
2 結果與分析
2.1 不同抗性群體的劃分結果
人工感染嗜水氣單胞菌后24 h即出現黃河鯉死亡現象,隨后黃河鯉死亡率增加,至感染后48 h達峰值,300尾黃河鯉的累積死亡率為40.0%。在人工感染試驗過程中最先死亡的視為高感群體(FP),最后死亡的視為低感群體(LP),而人工感染嗜水氣單胞菌后1周仍存活的視為抗病群體(SP)。感染后死亡的黃河鯉腹部泛紅甚至潰爛,泄殖孔充血,鰓絲出現腐爛現象;解剖發現其腹腔及內臟有出血點,符合黃河鯉感染嗜水氣單胞菌的病理學特征。
2.2 SCoT位點多態性及群體遺傳多樣性分析結果
選取部分DNA模板進行PCR擴增,結果從80條SCoT引物中篩選出18條擴增條帶清晰、多態性好的引物(表2)。圖1為引物SCoT34在3個黃河鯉群體中的PCR擴增電泳結果。篩選出的18條SCoT引物共擴增出103條條帶,范圍為3~11條,其中多態性條帶97條,平均每條SCoT引物擴增出5.4條多態性片段,范圍為2~11條,多態性比率為94.17%。在3個黃河鯉群體中,SP群體的多態性比率最高,為83.50%;其余2個群體的多態性比率分別為79.61%(FP)和81.55%(LP)。3個黃河鯉群體的Na范圍為1.7961~1.8155,Ne范圍為1.3828~1.4029,H范圍為0.2258~0.2467,I范圍為0.3453~0.3804。在FP、LP和SP群體中,Na、Ne、H和I均依次遞增(表3)。群體間的遺傳分化指數(Gst)為0.0972,即90.28%的遺傳多樣性分布在群體內部,表明黃河鯉群體間的遺傳變異小于群體內的遺傳變異。

表3 3個黃河鯉群體的遺傳多樣性水平Table 3 Genetic diversity of 3 C.carpio populations

圖1 引物SCoT34在3個黃河鯉群體中的PCR擴增電泳結果Fig.1 PCR amplification electrophoresis of primer SCoT34 in 3 C.carpio populations
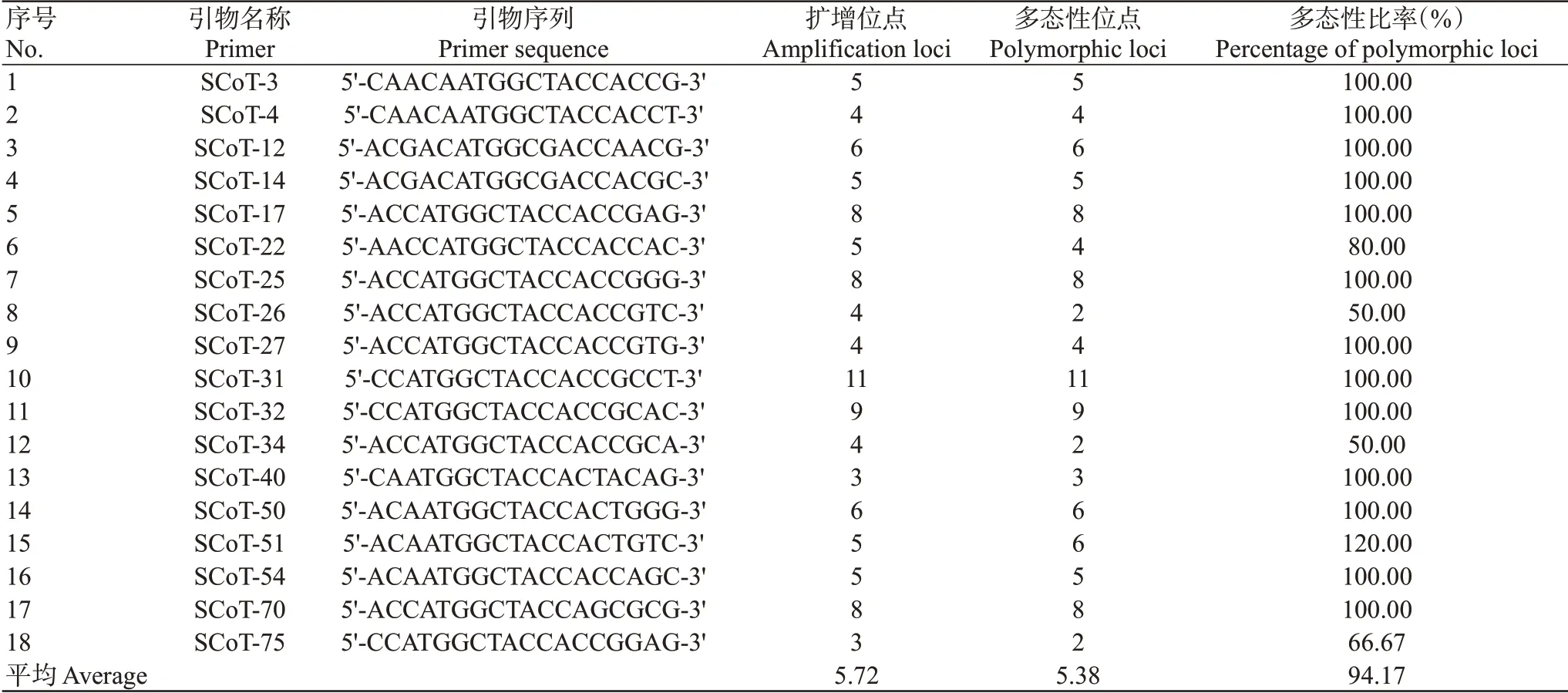
表2 18條SCoT引物的擴增結果Table 2 Amplification results of 18 SCoT primers
2.3 黃河鯉群體遺傳分化分析結果
3個黃河鯉群體的AMOVA分析結果顯示,群體間和群體內的方差貢獻率分別為12.99%和87.01%(表4),表明群體內的遺傳變異大于群體間。遺傳分化指數(Fst)是衡量群體間遺傳分化程度的重要參數(黃小芳等,2020;徐煜等,2021),Fst為0~0.05時表示群體間無遺傳分化,Fst為0.05~0.15時表示群體間存在輕度遺傳分化,Fst為0.15~0.25表示群體間存在中度遺傳分化,Fst大于0.25時表示群體間存在高度遺傳分化。3個黃河鯉群體的Fst為0.1299(表4),屬于輕度遺傳分化;群體間的Nei's遺傳距離(Ds)分布在0.0248~0.0835(表5),其中FP群體與SP群體的遺傳距離最大。
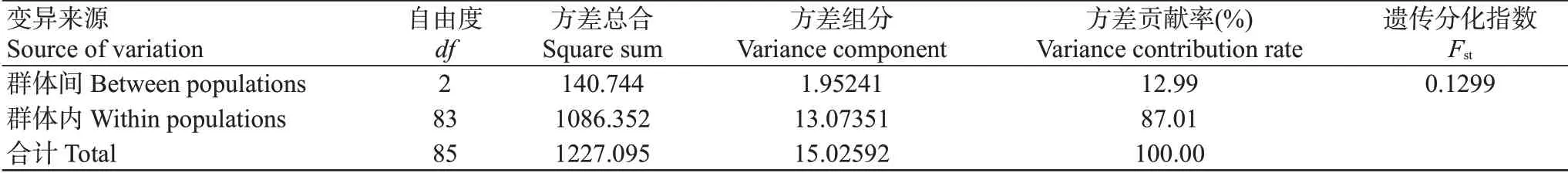
表4 3個黃河鯉群體的AMOVA分析結果Table 4 AMOVA analysis result of 3 C.carpio populations

表5 3個黃河鯉群體的Nei's遺傳距離(對角線下)及遺傳相似性(對角線上)Table 5 Nei’s genetic distance(below diagonal)and genetic similarity(above diagonal)of 3 C.carpio populations
2.4 黃河鯉群體遺傳結構聚類分析結果
基于Ds的UPGMA聚類分析結果(圖2)表明,FP群體和LP群體聚為一支,SP群體單獨聚為一支。黃河鯉群體遺傳結構分析發現,Mean lnP(K)、ΔK隨著亞群數K的增加而變動,K=2.0時,Mean lnP(K)出現最大拐點和ΔK最大值(圖3),因此認為K=2.0是最可能的模型,推測3個黃河鯉群體可分為2個亞群(FP和SP)。其中,LP群體由FP群體和SP群體集合而成(圖3)。
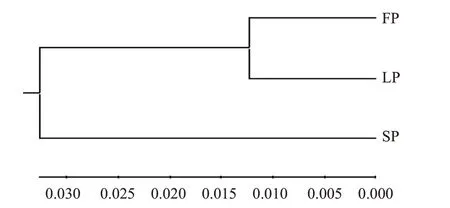
圖2 基于Ds構建的3個黃河鯉群體UPGMA聚類樹Fig.2 UPGMA clustering tree of 3 C.carpio populations based on Ds
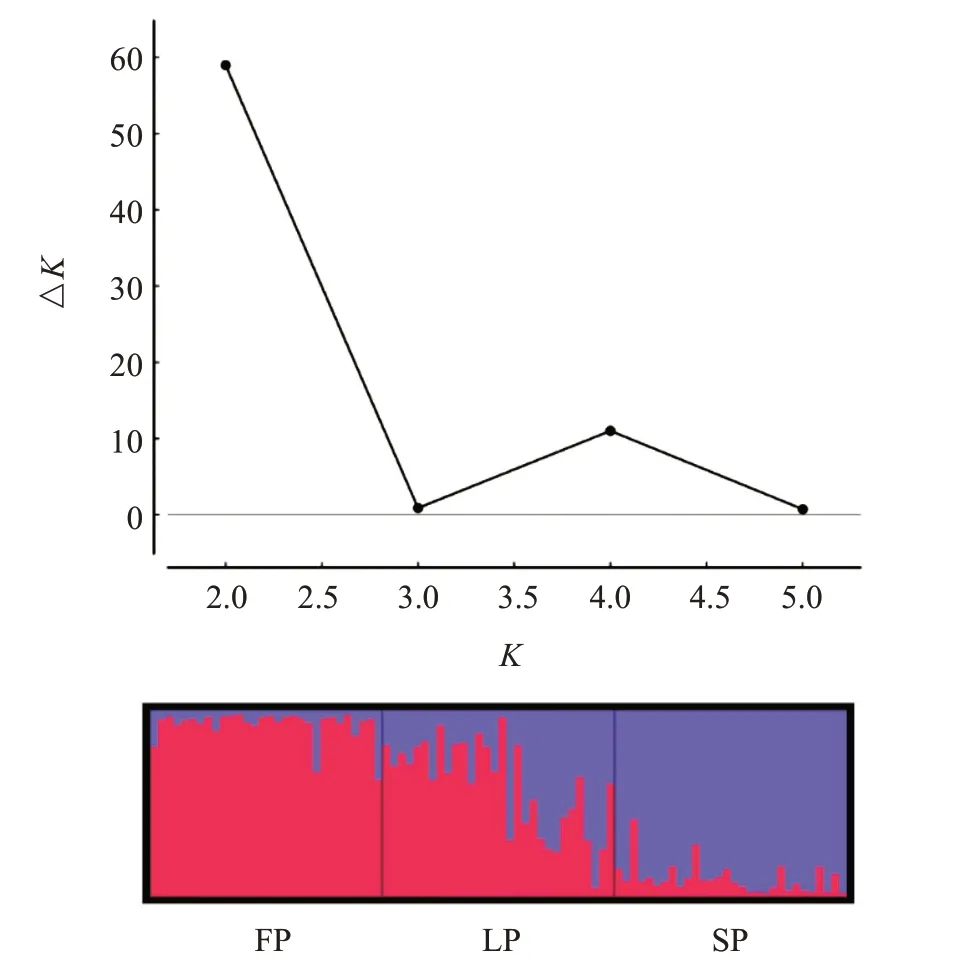
圖3 3個黃河鯉群體的遺傳結構分析結果Fig.3 Genetic component analysis of 3 C.carpio populations
3 討論
物種的進化潛力及抵御不良因素的能力取決于種內遺傳變異程度(Gibson,2021)。雜合度及群體多態性信息含量越高的生物對環境的適應能力越強,在生長、繁殖和抗逆等方面更具優勢。Na和Ne是分析群體遺傳多樣性的重要指標(任建功等,2021)。本研究中,SP群體的Ne均高于FP群體和LP群體,說明相對于存活群體,死亡群體的遺傳多樣性有所下降。多態性比率能直觀反映群體的多樣性程度。3個黃河鯉群體的平均多態性比率為94.17%,具有較高的遺傳多態性,尚未受到高強度的人工選擇。FP群體、LP群體的多態性比率分別為79.61%和81.55%,SP群體的多態性比率為83.50%,表明存活群體較死亡群體具有更高的遺傳多態性。在本研究中,多態性比率、Ne及I等遺傳參數均隨著黃河鯉群體抗病性的提高而增大,故推測黃河鯉抗嗜水氣單胞菌的能力與其遺傳多樣性呈正相關。朱其建等(2013)基于微衛星分子標記對羅氏沼蝦抗病選育群體進行遺傳多樣性分析,結果顯示抗病能力較強的4個群體遺傳多樣性最豐富。有關螞蟻(Formica selysi)(Reber et al.,2008)、小麥(Triticum aestivum)(Zhan et al.,2013)等生物群體遺傳多樣性的研究也表明遺傳多樣性高的群體抗病力更強。還有研究表明,種群遺傳多樣性能增強群體遭受疾病或其他自然災害后的恢復力(Hajjar et al.,2008;Grettenberger and Tooker,2015;Yang et al.,2019)。可見,在面對同樣的疾病脅迫時遺傳多樣性高的群體有望獲得更高的產量和收益。
遺傳距離能有效反映物種間的遺傳變異(梁業松等,2022)。本研究結果表明,FP群體與SP群體間的Ds最大(0.0835),而FP群體與LP群體間的Ds最小(0.0248),說明2個死亡群體間的遺傳分化程度相對較低。AMOVA分析結果與群體間的Gst相一致,均表明黃河鯉的遺傳變異主要存在于群體內,群體間無明顯的遺傳分化。基于Ds的UPGMA聚類分析結果顯示,FP群體和LP群體聚為一支,SP群體單獨聚為一支,也表明2個死亡群體間的親緣關系較近,其抵抗嗜水氣單胞菌的能力相對較弱。利用Structure 2.3對黃河鯉群體的種群遺傳結構進行檢測,認為K=2.0是最可能的模型,即3個黃河鯉群體可分為2個亞群,即抗病群體(SP)和易感群體(FP和LP)。其中,LP群體由SP群體和FP群體集合而成,表明通過黃河鯉死亡時間劃分的群體與通過聚類分析及遺傳結構分析得出的群體基本一致。
目前,因嗜水氣單胞菌感染引起的敗血病在黃河鯉群體中頻繁暴發,已成為黃河鯉養殖產業的主要病害之一(Jiang et al.,2016)。遺傳同質化群體較遺傳多樣化群體更易受到病原體感染,即保持群體遺傳多樣性可減緩疾病對種群造成的危害(King and Lively,2012)。與野生種群相比,養殖魚類的遺傳多樣性通常較低,是由于近交或針對某些重要的經濟性狀進行人工選擇所造成。因此,開展黃河鯉抗病育種時應加強對其抗病基因的研究,提高抗病育種親本選配的目標性,更好地利用抗病基因資源培育抗病新品種(系)。
4 結論
黃河鯉抗嗜水氣單胞菌的能力隨著群體遺傳多樣性的增大而增強。因此,在黃河鯉抗病品種(系)選育過程中應保證足夠的群體數量,在提高生長、營養等經濟性狀的同時保證一定的基因雜合度。

