白藜蘆醇增加甲狀腺癌SW579細胞放射敏感性的機制
艾尼·沙塔爾, 張建慶, 丁 偉, 劉思吟, 蘇鵬程, 波拉提·沙依提*
(1.新疆維吾爾自治區(qū)人民醫(yī)院乳腺甲狀腺科,新疆 烏魯木齊 830000;2.新疆維吾爾自治區(qū)人民醫(yī)院放療科,新疆 烏魯木齊 830000)
甲狀腺癌是人類最主要的內(nèi)分泌腫瘤,其發(fā)病率逐年上升[1],且因甲狀腺瘤細胞對放射線具有抗性,從而導(dǎo)致患者放療效果欠佳[2-3],如何提高甲狀腺瘤細胞對射線的敏感性成為了甲狀腺癌研究的主要方向。白藜蘆醇(resveratrol)[4]是從天然植物提取物中發(fā)現(xiàn)的一種具有廣泛藥理性質(zhì)的天然抗毒素,具有抗氧化效能[5],且能夠阻止低密度脂蛋白的氧化,因而具有潛在的預(yù)防心血管疾病、抗病毒、免疫調(diào)節(jié)以及預(yù)防癌癥的作用。已經(jīng)有研究證實白藜蘆醇在腫瘤的發(fā)生發(fā)展中發(fā)揮重要功能[6],如白藜蘆醇可抑制癌細胞增殖、抑制細胞周期進程、干擾信號轉(zhuǎn)導(dǎo)通路、抑制癌基因表達、誘導(dǎo)細胞凋亡等。近些年來,有研究發(fā)現(xiàn)白藜蘆醇可提高多種腫瘤細胞對放射治療的敏感性,如在人咽鱗癌細胞[7]和食管腺癌細胞[8]中具有放射增敏作用,但關(guān)于白藜蘆醇對甲狀腺癌細胞的增敏性研究仍較少。本研究擬檢測白藜蘆醇對甲狀腺癌SW579細胞增殖、凋亡、放射增敏性的影響,并深入探討其分子機制,為相關(guān)研究提供實驗基礎(chǔ)和理論依據(jù)。
1 材料與方法
1.1 藥物、試劑及儀器 白藜蘆醇(純度≥98%)購于美國Sigma公司。胎牛血清購于美國Gibco公司;L-15培養(yǎng)基購于武漢博士德生物工程有限公司;MTT、DMSO購于美國Ameserco公司;青霉素-鏈霉素溶液購于美國賽默飛公司;SDS-PAGE試劑盒和BCA蛋白定量試劑盒均購于上海碧云天生物技術(shù)有限公司;蛋白免疫印記實驗中所用的一抗和羊抗鼠二抗均購于美國Santa Cruz公司。常用試劑(甲醇、吉姆薩等)均購于廣州豪凱生物科技有限公司。細胞培養(yǎng)板和培養(yǎng)瓶購于美國康寧公司;23EX醫(yī)用直線加速器購于美國Varian公司;ELX800酶標儀購于美國Bio-Tek公司;FACS CantoⅡ流式細胞儀購于美國Bio-Rad公司。
1.2 放射處理條件 室溫照射;源皮距(SSD)100 cm;照射視野面積15 cm×15 cm;劑量率3 Gy/min;板底面覆蓋1.5 cm厚的等效組織填充物。
1.3 細胞培養(yǎng) SW579細胞購于上海紀寧生物科技有限公司,將SW579細胞培養(yǎng)于L-15完全培養(yǎng)基中(含10%胎牛血清、100 U/mL青霉素和鏈霉素),置于37 ℃、5% CO2飽和濕度的細胞培養(yǎng)箱中培養(yǎng)。
1.4 細胞分組 將對數(shù)生長的SW579細胞,用胰蛋白酶消化為單細胞懸液,設(shè)為對照組、加藥組、照射組、聯(lián)合組。加藥組用25 μmol/L白藜蘆醇處理,對照組細胞不做任何處理;照射組用2 Gy X射線照射細胞;聯(lián)合組用25 μmol/L白藜蘆醇和2 Gy X射線照射處理。
1.5 MTT實驗檢測白藜蘆醇對SW579細胞的毒性 取對數(shù)生長期SW579細胞,胰蛋白酶消化處理,用含有10%胎牛血清的完全培養(yǎng)基終止消化,制備細胞懸液,密度為3×104/mL,以每孔100 μL接種至96孔板中,繼續(xù)培養(yǎng),細胞貼壁后,將培養(yǎng)基更換為0、12.5、25、50、100 μmol/L白藜蘆醇,細胞培養(yǎng)24、48、72 h后,每孔加入MTT溶液10 μL,然后每孔加入Formanzan溶解液,37 ℃振蕩15 min,使結(jié)晶紫溶解,在570 nm波長處酶標儀檢測各孔吸光度,并計算細胞存活率。對照組、加藥組、照射組、聯(lián)合組細胞按上述方法檢測細胞存活率。
1.6 克隆形成實驗檢測白藜蘆醇對SW579細胞輻射增敏作用 取對數(shù)生長期的SW579細胞,胰蛋白酶消化處理,用含有10%胎牛血清的完全培養(yǎng)基終止消化,制備細胞懸液,密度為3×104/mL,以每孔100 μL接種至96孔板中,繼續(xù)培養(yǎng),細胞貼壁后,將各孔用濃度為0、25 μmol/L白藜蘆醇處理細胞,每組設(shè)置5個平行孔,24 h后給予0、1、2、4 Gy X射線照射,繼續(xù)培養(yǎng)1 d后,更換新鮮培養(yǎng)基,置于上述培養(yǎng)環(huán)境下繼續(xù)培養(yǎng)10~14 d,每隔3 d更換1次新鮮培養(yǎng)液,直至生成肉眼可見的細胞克隆為止。棄去培養(yǎng)基,PBS清洗3次,2 mL甲醇室溫固定10 min,棄去甲醇,等量吉姆薩染色液染色 30 min,在低倍光學(xué)顯微鏡下計數(shù)>50個細胞的集落。克隆形成率(planting efficiency,PE)=(克隆數(shù)/接種細胞數(shù))×100%,存活分數(shù)(survial fraction,SF)=照射劑量組的集落數(shù)/(該組細胞接種數(shù)×未照射組PE)。采用單擊多靶模型擬合細胞存活曲線,SF=1-[(1-e-D/D0)×N],Dq=D0×lnN。其中D為照射劑量(Gy),D0為平均致死劑量,Dq為準閾劑量(代表存活的寬肩度),N為外推值。放射增敏比(sensitization enhancement ratio,SER)=單純照射組D0/聯(lián)合照射組D0。
1.7 蛋白免疫印記實驗 將對照組、加藥組、照射組、聯(lián)合組細胞離心,取細胞沉淀置于冰上,加適量細胞裂解液(1 mL RIPA裂解液加10 μL蛋白酶抑制劑,現(xiàn)配現(xiàn)用)冰上裂解30 min,4 ℃離心取上清,用BCA蛋白定量試劑盒進行蛋白濃度測定,取20 μg蛋白進行SDS-PAGE的凝膠電泳,將蛋白轉(zhuǎn)至PVDF膜上,用5%脫脂奶粉于4 ℃條件下過夜封閉,PBST洗滌3次,加入相應(yīng)的一抗,4 ℃孵育過夜,PBST洗滌3次,37 ℃孵育二抗1 h,PBST洗滌3次,將配置好的ECL顯色液加至膜上,在化學(xué)發(fā)光凝膠成像系統(tǒng)中顯影,PVDF膜再利用,用一抗、二抗去除液將PVDF膜上的抗體去除,重新封閉、孵育新的一抗、二抗,檢測其他蛋白。
1.8 流式細胞儀檢測細胞周期 對照組、加藥組、照射組、聯(lián)合組細胞培養(yǎng)48 h后收集細胞,并制備單細胞懸液,加入3 mL預(yù)冷的70%乙醇固定,用緩沖液洗滌后加入核糖核酸酶A(RNase A)于37 ℃水浴30 min,加入碘化啶(PI),避光30 min,上機檢測,重復(fù)3次。用流式細胞儀和DNA細胞周期分析軟件對細胞周期進行檢測分析。
1.9 流式細胞術(shù)檢測細胞凋亡 對照組、加藥組、照射組、聯(lián)合組細胞培養(yǎng)48 h后用預(yù)冷的PBS漂洗2次,與500 μL結(jié)合緩沖液混勻。先加入10 μL Annexin V-FITC,再加入5 μL PI,混勻后避光孵育10 min。用流式細胞儀檢測細胞凋亡率。每組設(shè)3個復(fù)孔,實驗重復(fù)3次。
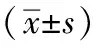
2 結(jié)果
2.1 白藜蘆醇對SW579細胞的細胞毒性檢測 用不同濃度(0、12.5、25、50、100 μmol/L)的白藜蘆醇處理SW579細胞,于24、48、72 h時用MTT法檢測SW579細胞的存活率,結(jié)果見表1。由此可知,25 μmol/L白藜蘆醇在72 h內(nèi)是對SW549細胞沒有細胞毒性的最大濃度,因此后續(xù)實驗均采用該濃度白藜蘆醇作為輻射增敏實驗的最佳藥物濃度。
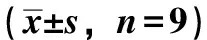
表1 不同濃度白藜蘆醇作用不同時間對SW579細胞存活率的影響
2.2 白藜蘆醇對SW579細胞的輻射增敏作用 用不同劑量(0、1、2、4 Gy)的X射線照射及25 μmol/L白藜蘆醇處理SW579細胞,采用克隆形成實驗研究白藜蘆醇對SW549細胞的輻射增敏作用,見圖1,發(fā)現(xiàn)白藜蘆醇處理SW579細胞后,2、4 Gy劑量射線照射后細胞克隆形成數(shù)降低(P<0.01);與對照組比較,加藥組細胞用0、1、2、4 Gy X射線照射后,2、4 Gy劑量射線照射后細胞存活分數(shù)降低(P<0.01),表明白藜蘆醇對SW579細胞有明顯的輻射增敏作用,見表2。最終,選擇2 Gy劑量射線進行后續(xù)實驗。
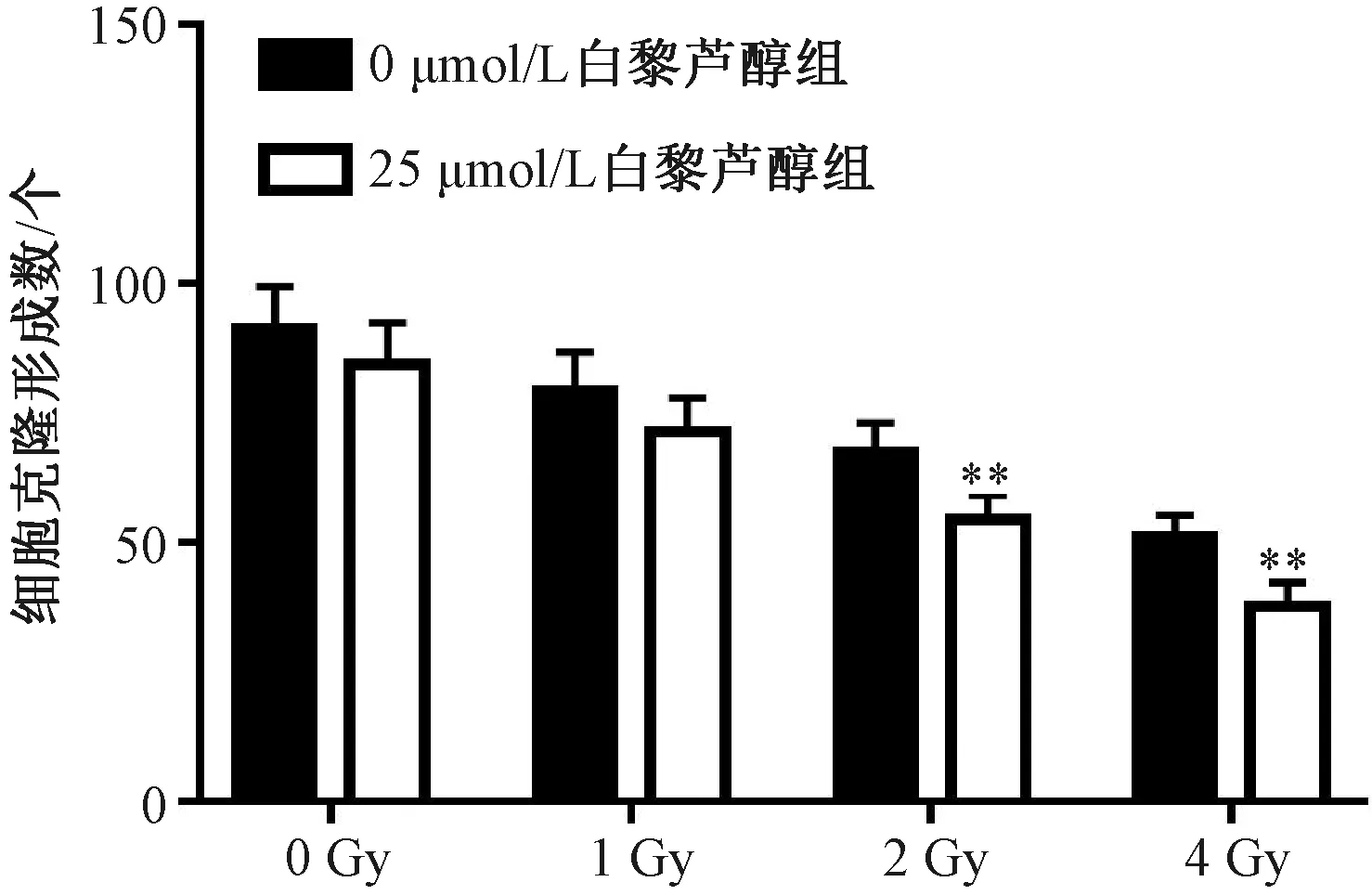
注:與0 μmol/L白藜蘆醇組比較,**P<0.01。圖1 白藜蘆醇對SW579細胞克隆形成的影響
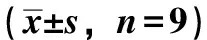
表2 不同劑量射線干預(yù)后各組細胞存活分數(shù)(SF)值
2.3 白藜蘆醇對X射線照射后SW579細胞增殖的影響 將細胞分為對照組、加藥組(25 μmol/L白藜蘆醇)、照射組(2 Gy X射線)、聯(lián)合組(25 μmol/L白藜蘆醇和2 Gy X射線),分別于24、48、72 h用MTT法檢測SW579細胞的活力,見圖2A。結(jié)果顯示,與對照組比較,照射組和加藥組的細胞活力均降低(P<0.05);與照射組比較,聯(lián)合組SW579細胞的存活率降低(P<0.01)。Western blot檢測48 h后對照組、加藥組、照射組和聯(lián)合組細胞中Ki67蛋白表達,分別為1.00±0.05、0.46±0.03、0.51±0.04、0.13±0.01,與對照組比較,照射組和加藥組細胞中Ki67蛋白表達均降低(P<0.01);與照射組比較,聯(lián)合組SW579細胞中Ki67蛋白表達降低(P<0.01),見圖2B。
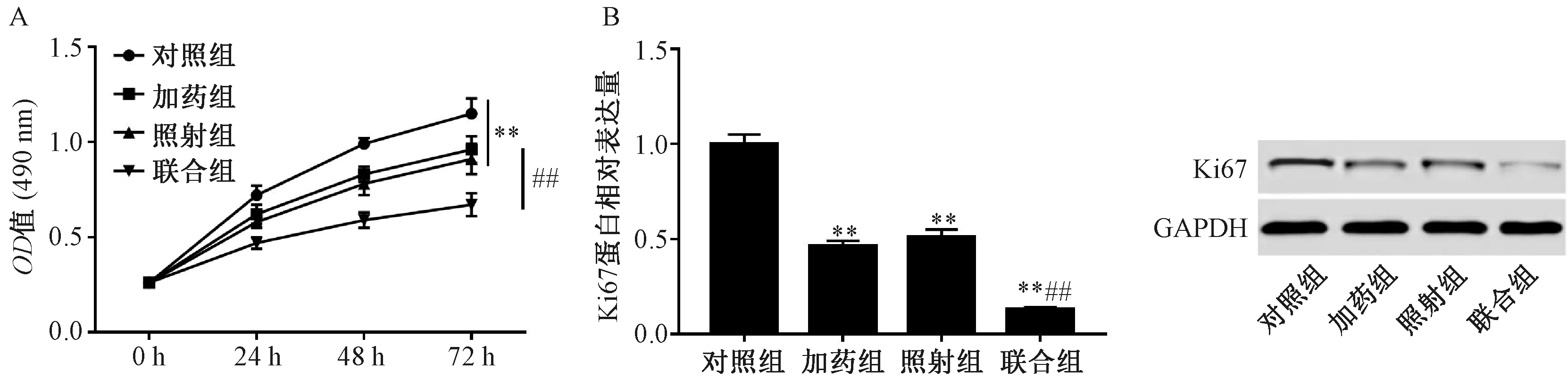
注:與對照組比較,**P<0.01;與照射組比較,##P<0.01。圖2 白藜蘆醇對SW579細胞增殖的影響
2.4 白藜蘆醇對X射線照射后SW579細胞周期的影響 由表3可見,與對照組比較,加藥組和照射組的SW579細胞周期發(fā)生變化,G0/G1期細胞減少(P<0.01),S期細胞增加(P<0.01),G2/M期細胞減少(P<0.01);與照射組比較,聯(lián)合組細胞周期阻滯更顯著,G0/G1期細胞減少(P<0.01),S期細胞增加(P<0.01),G2/M期細胞減少(P<0.01),表明白藜蘆醇和X射線聯(lián)合作用抑制細胞周期行進的作用更為顯著。
2.5 白藜蘆醇對X射線照射后SW579細胞凋亡的影響 由圖3可見,流式細胞術(shù)檢測對照組、加藥組、照射組和聯(lián)合組細胞的細胞凋亡率分別為(8.56±0.72)%、(14.24±1.06)%、(15.37±1.34)%、(20.14±1.85)%,與對照組比較,加藥組和照射組細胞凋亡率均增加(P<0.01);與照射組比較,聯(lián)合組細胞凋亡率增加(P<0.05)。
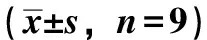
表3 白藜蘆醇聯(lián)合射線對細胞周期的影響
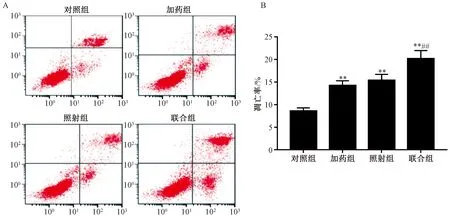
注:與對照組比較,**P<0.01;與照射組比較,##P<0.01。圖3 白藜蘆醇聯(lián)合X射線對SW579細胞凋亡的影響
2.6 白藜蘆醇對X射線照射后SW579細胞中Survivin、ATM和NBS1表達的影響 Western blot檢測48 h對照組、加藥組、照射組、聯(lián)合組細胞中Survivin、ATM和NBS1表達情況,見圖4。Survivin蛋白表達量分別為1.00±0.02、0.67±0.04、0.54±0.02、0.39±0.02,ATM蛋白表達量分別為1.00±0.05、0.63±0.03、0.55±0.05、0.41±0.04,NBS1蛋白表達量分別為1.00±0.03、0.58±0.05、0.56±0.03、0.27±0.02。與對照組比較,加藥組和照射組中Survivin、ATM、NBS1蛋白表達均降低(P<0.01);與照射組比較,聯(lián)合組中Survivin、ATM、NBS1蛋白表達降低(P<0.01),表明白藜蘆醇聯(lián)合X射線抑制SW579細胞Survivin、ATM和NBS1的表達。
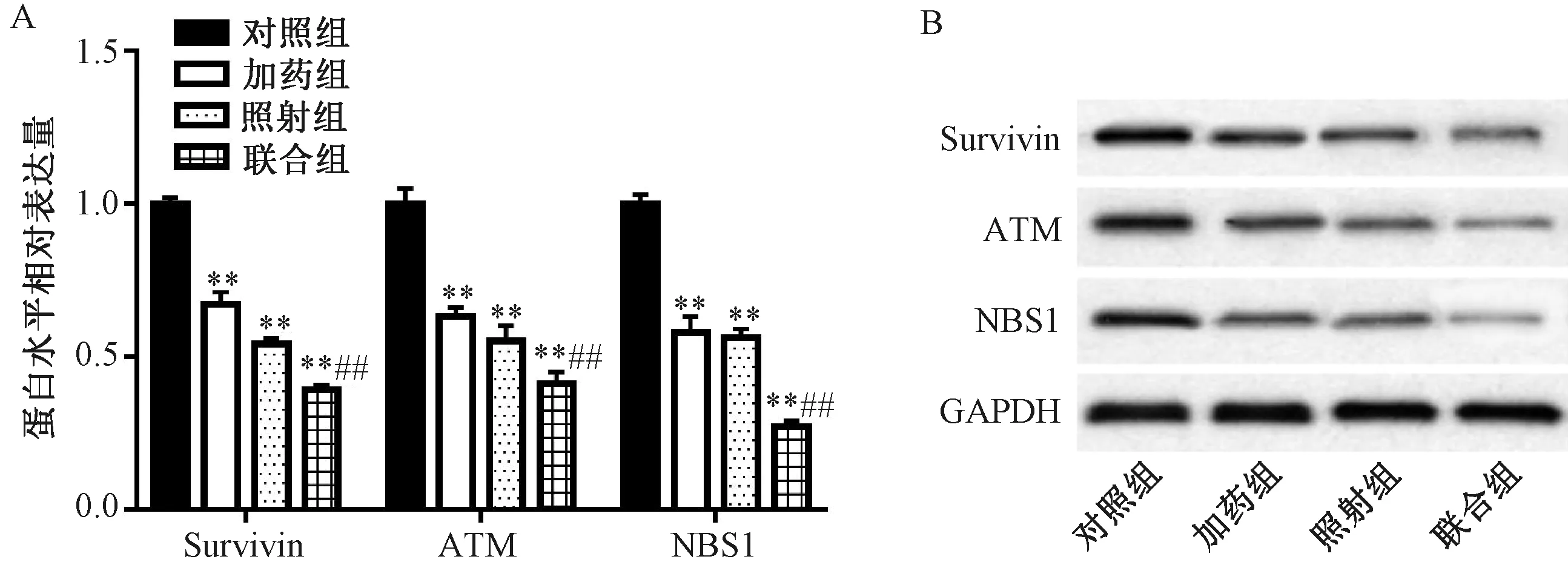
注:對照組比較,**P<0.01;與照射組比較,##P<0.01。圖4 SW579細胞中Survivin、ATM和NBS1表達
3 討論
甲狀腺癌是一種重要的內(nèi)分泌腫瘤,單純使用放射治療方法不僅不能有效殺死癌細胞,還會對正常的組織和細胞造成一定危害。輻射增敏劑[9]可通過增加甲狀腺癌細胞的輻射敏感性進而提高放射治療療效,從而達到殺死癌細胞的目的。但當(dāng)前的輻射增敏劑不僅造價高,且對正常組織細胞的毒副作用也較大,因此,研發(fā)和找到藥效強、造價低的輻射增敏劑對提高甲狀腺癌的放射治療療效具有重要意義。
白藜蘆醇是從葡萄等植物中提取一種小分子化合物,具有防癌和抗癌的作用,可增加化學(xué)治療藥物的敏感性以及可增加輻射誘導(dǎo)的細胞凋亡[10-12],因此白藜蘆醇可能具有輻射增敏作用,臨床研究表明正常使用富含白藜蘆醇的食物不僅能發(fā)揮其生理活性,而且具有一定安全性[13],這也為白藜蘆醇成為潛在的輻射增敏劑提供了科學(xué)依據(jù)。本研究檢測了不同劑量的白藜蘆醇對甲狀腺癌細胞SW579的細胞毒性作用,結(jié)果發(fā)現(xiàn),在72 h內(nèi),白藜蘆醇對甲狀腺癌細胞SW579的無毒性最高劑量為25 μmol/L。為了觀察白藜蘆醇對射線照射后甲狀腺癌細胞SW579增殖的影響,本研究首先用25 μmol/L白藜蘆醇及不同劑量的X射線照射處理SW579細胞,克隆形成實驗結(jié)果顯示,與對照組比較,白藜蘆醇可降低照射組細胞的克隆形成率和細胞存活分數(shù)。接著,采用25 μmol/L白藜蘆醇和2 Gy劑量射線處理SW579細胞,將其分為對照組、照射組、加藥組和聯(lián)合組,檢測細胞增殖狀況,MTT結(jié)果顯示,與放射組比較,白藜蘆醇和X射線聯(lián)合使用可降低細胞存活率。Ki67[14-15]是與細胞增殖密切相關(guān)的蛋白,Western blot檢測結(jié)果發(fā)現(xiàn),與單純放射組比較,Ki67在聯(lián)合組SW579細胞中的表達降低,進一步表明藜蘆醇可通過參與調(diào)控與細胞增殖相關(guān)的分子機制進而抑制SW579細胞的增殖,白藜蘆醇對SW579細胞能夠發(fā)揮明顯的輻射增敏作用,具有成為輻射增敏劑的潛力。
放射增敏機制主要是通過影響細胞周期、促進腫瘤細胞凋亡和增加射線對腫瘤細胞的原發(fā)性損傷等生物學(xué)過程發(fā)揮作用的。細胞在接受射線照射后其細胞周期會發(fā)生改變,還可影響細胞凋亡[16]。為了研究白藜蘆醇的放射增敏機制,用流式細胞術(shù)分析SW579細胞的細胞周期和凋亡情況。結(jié)果發(fā)現(xiàn),與對照組比較,照射組和加藥組SW579細胞周期發(fā)生變化,G0/G1期比例降低,S期比例增加,且細胞凋亡率增加;而與照射組比較,聯(lián)合組中差異更為顯著,表明白藜蘆醇可加強X射線對SW579細胞周期的調(diào)控作用,以及可增加X射線誘導(dǎo)的細胞凋亡,表明白藜蘆醇可通過改變細胞周期和促進細胞凋亡增加放射敏感性。Survivin[17]是一種作用極強的凋亡抑制蛋白,可抑制細胞凋亡,參與細胞周期調(diào)控[18],NBS1[19]是DNA損傷修復(fù)蛋白,ATM[20]是與細胞周期調(diào)控和DNA損傷修復(fù)密切相關(guān)的蛋白,可作為細胞“生存因子”降低細胞對放射線和類射線細胞毒藥物的敏感性。為了進一步探討白藜蘆醇促進細胞凋亡和改變細胞周期的機制。在后續(xù)研究中,通過Western blot檢測Survivin、NBS1和ATM的表達,結(jié)果發(fā)現(xiàn),與對照組比較,放射組和加藥組細胞中Survivin、NBS1和ATM表達均降低;與照射組比較,聯(lián)合組中蛋白表達差異更為顯著,白藜蘆醇加強了X射線對Survivin、NBS1和ATM表達的抑制作用。
綜上所述,本研究初步探討了白藜蘆醇作為甲狀腺瘤放射增敏劑的潛能,并進一步分析了白藜蘆醇放射增敏的分子機制,白藜蘆醇可增加SW579細胞對射線的敏感性,為臨床上開發(fā)白藜蘆醇作為甲狀腺瘤放射增敏劑提供了科學(xué)依據(jù)。

