解表方對寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型的作用
李 爽, 楊居崩, 廖 陳, 晏雪梅, 代 蓉, 肖 純, 李秀芳
(云南中醫藥大學,云南 昆明 650500)
上呼吸道感染是臨床常見病,在全球范圍內,每年的流感疫情會造成25~50萬人死亡,并導致500萬例嚴重疾病[1-2]。上呼吸道感染大多數與鼻病毒、呼吸道合胞病毒和腺病毒等病毒感染有關,亦可由肺炎支原體、溶血性鏈球菌和肺炎鏈球菌等直接引起或繼發感染。目前對上呼吸道感染防治措施主要采取疫苗接種結合非甾體類抗炎藥物對癥治療的方法,由于絕大多數上呼吸道感染由病毒感染引起,而病毒具有變異速度快的特點,要準確預測即將流行的病毒亞型非常困難,因此疫苗接種往往難以取得理想的效果,非甾體抗炎藥物的作用多限于改善臨床癥狀,不能防止疾病進一步發展及并發癥的發生,所以尋找有效防治上呼吸道感染的藥物具有重要的現實意義。
中醫積累了大量治療上呼吸道感染的經驗,上呼吸道感染典型的臨床癥狀與中醫學“表證”的癥狀相似,因此中醫臨床多用解表方劑進行治療。課題組前期研究發現,給予銀翹散可提高小鼠上呼吸道黏膜免疫屏障功能,進而達到降低滴鼻感染肺炎鏈球菌后小鼠的死亡率,延長小鼠生存時間[3-4]。本實驗在前期研究的基礎上,采用冷熱循環刺激復制大鼠鼻黏膜免疫屏障功能低下模型[4-5],給予2種代表性的解表方銀翹散和麻黃湯進行干預,進一步探究解表方提高大鼠鼻黏膜免疫屏障功能的作用機制。
1 材料
1.1 動物 SPF級雄性SD大鼠,體質量180~200 g,由遼寧長生生物技術股份有限公司提供,動物生產許可證號SCXK(遼)2015-0001,合格證號211002300049725。
1.2 試劑 DTT、Tris、過硫酰胺、10%SDS、四甲基乙二胺、甘氨酸、吐溫-20均購自生工生物工程(上海)股份有限公司;30%丙烯酰胺、1 mol/L Tris-HCL緩沖液、1.5 mol/L Tris-HCL緩沖液均購自北京索萊寶科技有限公司;PMSF、RIPA裂解液(強)、BCA蛋白濃度檢測試劑盒均購自上海碧云天生物技術有限公司;大鼠sIgA ELISA試劑盒購自南京建成生物工程研究所;APRIL抗體、TGF-β1抗體均購自英國Abcam公司;TACI抗體、pIgR抗體均購自美國Santa Cruz公司;BAFF抗體、IgA抗體均購自美國Novus Biologicals公司;二抗兔抗山羊、山羊抗兔、山羊抗鼠、β-actin、GAPDH、β-tubulin均購自美國Proteintech公司。
1.3 藥物 按《方劑學》[6]配伍比例受試方劑的藥物組成和劑量如下:銀翹散為連翹30 g、金銀花30 g、苦桔梗18 g、薄荷18 g、竹葉12 g、生甘草15 g、芥穗12 g、淡豆豉15 g、牛蒡子18 g,加6倍水,除薄荷、芥穗外其余藥材浸泡30 min,水沸開始計時15 min,10 min時加入芥穗、薄荷,2 000 W煮沸后改用400 W煎煮,紗布過濾,真空抽濾,45 ℃旋蒸至55.5 mL;麻黃湯為麻黃9 g、桂枝6 g、杏仁6 g、甘草3 g,先加500 mL雙蒸水浸泡麻黃30 min,2 000 W煎煮麻黃水沸后改用800 W煎煮,計時20 min,300 mL雙蒸水浸泡余藥30 min,倒入鍋中,2 000 W共煎至水沸時改用800 W,計時30 min,紗布過濾,真空抽濾,55 ℃旋蒸至111 mL。按人和動物的體表面積計數法根據臨床藥效劑量換算,大鼠銀翹散的給藥劑量是臨床等效量的2倍量(含生藥量33.48 g/kg),麻黃湯的給藥劑量是臨床等效量(含生藥量2.43 g/kg),灌胃劑量均為1 mL/100 g體質量。以上藥材均購自云南慈慧藥業有限公司。
1.4 儀器 分析天平購自瑞士普利賽斯公司;酶標儀購自瑞士Tecan公司;冰箱購自青島海爾股份有限公司;垂直電泳儀、濕轉儀購自美國伯樂公司;轉移脫色搖床、漩渦混懸器購自海門市其林貝爾儀器制造有限公司;UVP凝膠成像分析系統購自美國Spectrum公司;-80 ℃超低溫冰箱購自美國Thermo公司。
2 方法
2.1 建立寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型 參考文獻[4-5]報道,取42只大鼠,隨機分為正常組、模型組,造模前禁食不禁水12 h,正常組不予以任何刺激;將模型組大鼠置于-15 ℃環境中1 h,再轉移至25 ℃環境30 min,循環4次,結束后正常給予水和飼料,在實驗第9天,再次對模型組大鼠進行相同的刺激,各組分別在刺激后1、3、5、7、9、11 d每個時間點取6只,取鼻黏膜組織,采用Western blot法檢測IgA蛋白表達。結果,與正常組比較,模型組鼻黏膜IgA蛋白表達降低,差異具有統計學意義(P<0.05)作為評價模型成功的標志[4,7]。
2.2 解表方對寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型的影響 取24只大鼠,隨機分為正常組、模型組、銀翹散組和麻黃湯組,造模前禁食不禁水12 h,正常組不予以任何刺激,其余各組大鼠置于-15 ℃環境1 h,再轉至25 ℃環境30 min,反復循環4次,造模結束后正常給予水和食物。在造模結束后6 h,正常組和模型組灌胃給予蒸餾水,銀翹散組和麻黃湯組灌胃給予受試藥物,每天1次,連續7 d。在第9天時,正常組不予以任何刺激,其余各組大鼠再次置于-15 ℃環境1 h后轉至25 ℃環境30 min,反復循環4次,刺激結束后正常給予水和飼料。在造模結束后6、22 h,正常組和模型組灌胃給予蒸餾水,銀翹散組和麻黃湯組灌胃給予受試藥物。造模結束后24 h,取大鼠鼻腔灌洗液及鼻黏膜組織,ELISA試劑盒檢測鼻腔灌洗液中sIgA水平,Western blot法檢測鼻黏膜中IgA、BAFF、APRIL、TGF-β1、TACI、pIgR蛋白表達。Western blot檢測方法為取總蛋白40 μg進行SDS-PAGE凝膠電泳,通過濕轉法將蛋白轉移至PVDF膜上,5%脫脂牛奶室溫封閉2 h,一抗(IgA、TGF-β1、pIgR、GAPDH、β-actin、β-tubulin稀釋倍數為1∶1 000,BAFF、APRIL稀釋倍數為1∶500,TACI稀釋倍數為1∶100)4 ℃孵育過夜,TBST洗滌4次,每次5 min,二抗(兔抗山羊、山羊抗兔、山羊抗鼠稀釋倍數為1∶2 000)室溫孵育2 h,TBST洗滌4次,每次5 min,最后滴加ECL發光液顯色。
3 結果
3.1 寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型中IgA蛋白表達 如表1、圖1所示,與正常組比較,寒冷刺激后第1、3天時模型組大鼠鼻黏膜中IgA蛋白表達降低(P<0.05,P<0.01);寒冷刺激第5天后,模型組大鼠鼻黏膜中IgA蛋白表達呈上升趨勢;寒冷刺激后第11天時,模型組大鼠鼻黏膜中IgA蛋白表達仍較低。

表1 各組大鼠鼻黏膜中IgA蛋白表達比較

圖1 各組大鼠鼻黏膜中IgA蛋白表達
3.2 解表方對寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型的影響 如表2、圖2所示,與正常組比較,模型組大鼠鼻黏膜中IgA蛋白表達降低(P<0.01);與模型組比較,銀翹散組和麻黃湯組大鼠鼻黏膜IgA蛋白表達均升高(P<0.05,P<0.01);與銀翹散組比較,麻黃湯組大鼠鼻黏膜IgA蛋白表達升高更為顯著(P<0.05)。與正常組比較,模型組大鼠鼻腔灌洗液中sIgA的水平降低(P<0.01);與模型組比較,銀翹散組和麻黃湯組sIgA水平均升高(P<0.05)。

表2 解表方對寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型的影響

圖2 解表方對寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型的影響
3.3 解表方對寒冷刺激致大鼠鼻黏膜屏障功能低下模型中BAFF、APRIL、TGF-β1和TACI蛋白表達的影響 如表3、圖3所示,與正常組比較,模型組大鼠鼻黏膜中BAFF、APRIL、TGF-β1蛋白表達降低(P<0.01),TACI蛋白表達有降低趨勢;與模型組比較,麻黃湯組大鼠鼻黏膜中BAFF蛋白表達升高(P<0.01),銀翹散組無明顯變化(P>0.05);與銀翹散組比較,麻黃湯組BAFF蛋白表達升高(P<0.01);與模型組比較,麻黃湯組和銀翹散組大鼠鼻黏膜中TACI和TGF-β1蛋白表達均無明顯變化(P>0.05)。

表3 各組大鼠鼻黏膜中BAFF、APRIL、TGF-β1、TACI蛋白表達比較
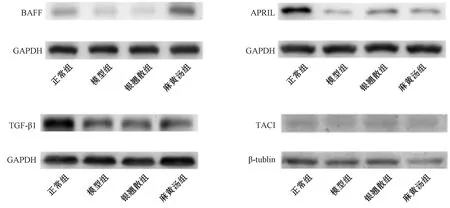
圖3 各組大鼠鼻黏膜中BAFF、APRIL、TGF-β1、TACI蛋白表達
3.4 解表方對寒冷刺激致大鼠鼻黏膜屏障功能低下模型IgA分泌過程中pIgR蛋白表達的影響 如表4、圖4所示,與正常組比較,模型組大鼠鼻黏膜中pIgR蛋白表達降低(P<0.01);與模型組比較,麻黃湯組大鼠pIgR蛋白表達升高(P<0.05),銀翹散組無明顯變化(P>0.05)。

表4 各組大鼠鼻黏膜中pIgR蛋白表達

圖4 各組大鼠鼻黏膜中pIgR蛋白表達
4 討論
目前,上呼吸道感染仍然是威脅人類健康的嚴重傳染性疾病,并伴隨著多種并發癥,其發病通常由細菌或病毒感染引起。作為機體直接與外界相通的門戶之一,位于氣道黏膜表面的先天性和適應性免疫屏障對消除入侵的病原體起著關鍵作用。分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)是呼吸道免于病原體侵犯的重要效應分子,可以阻止細菌在黏膜表面的黏附、溶解細菌、中和毒素,其水平的變化與呼吸系統疾病的發生有著密切關系[8]。維持或提高呼吸道 sIgA水平可提高黏膜免疫功能,有助于降低呼吸道疾病的發生,防止疾病向下呼吸道發展。
為進一步探究中醫臨床常用的解表方對鼻黏膜屏障的影響,本實驗采用反復冷熱循環刺激的方法復制大鼠鼻黏膜免疫屏障功能低下模型,給予麻黃湯和銀翹散進行干預,考察其潛在的作用。結果顯示,麻黃湯和銀翹散均能提高模型組大鼠鼻黏膜中IgA蛋白的表達及鼻腔灌洗液中sIgA的水平,提示兩個解表方均能提高鼻黏膜免疫屏障的功能。IgA在上呼吸道黏膜的合成途徑主要分為T細胞依賴途徑和非T細胞依賴途徑,而大量文獻表明,體內大多數共生細菌都是定向的通過非T細胞依賴的途徑產生IgA[9]。樹突狀細胞(dendtitic cell,DC)是一種廣泛分布于器官和組織的特殊的抗原遞呈細胞,當病原體入侵時,DC會直接攝取病原體,遞呈給B細胞。并表達B細胞活化因子(B cell activating factor,BAFF)、增殖誘導配體(a proliferation inducing ligand,APRIL)激活B細胞[10-11],與跨膜激活劑和鈣調節環素配體(transmembrane activatator and calcium modulator cyclophilin ligand interactor,TACI)共同作用[12],使膜上表達的免疫球蛋白類別轉換成免疫球蛋白A[13]。而轉化生長因子β1(transforming growth factor β1,TGF-β1)直接參與IgA的類別轉換[14]。在這些細胞因子的作用下增殖分化出的IgA與黏膜上皮細胞基底層的多聚免疫球蛋白受體(polymeric immunoglobulin receptor,pIgR)結合,最終以胞吐的方式將sIgA釋放入黏膜腔[15],作為黏膜免疫的效應分子發揮作用。
實驗結果顯示,大鼠在寒冷刺激后,鼻黏膜中BAFF、APRIL和TGF-β1蛋白表達降低,TACI蛋白表達有降低趨勢,同時,鼻黏膜中pIgR蛋白降低,這解釋了大鼠鼻腔灌洗液中sIgA降低的原因。給予麻黃湯后,大鼠鼻黏膜組織中BAFF蛋白表達升高,說明麻黃湯可能是通過促進B淋巴細胞的成熟,促進了IgA的蛋白合成,麻黃湯干預后還促進了pIgR的蛋白表達,提示其可攜帶sIgA進入鼻腔發揮作用;給予銀翹散后,僅對APRIL有升高的趨勢,對BAFF、TACI、TGF-β1和pIgR的蛋白表達均無明顯作用,提示,銀翹散促進鼻黏膜IgA蛋白合成可能是通過其它途徑而達到,具體機制有待進一步研究。
綜上所述,通過本實驗的研究,進一步證實了中醫臨床常用解表方麻黃湯和銀翹散在提高上呼吸道黏膜屏障功能方面的作用,并揭示了麻黃湯的部分作用機制。但目前的研究結果尚無法解釋銀翹散促進IgA的蛋白表達和分泌的原因,并且在本研究中,辛溫解表和辛涼解表代表方劑之間的作用差異還不明顯,兩方作用差異的原因還有待進一步研究。

