歐前胡素雙層滲透泵控釋片處方的優(yōu)化
胡春霞, 嚴(yán) 巍, 范明松
(1.鄭州澍青醫(yī)學(xué)高等專(zhuān)科學(xué)校,河南 鄭州 450064;2.上海雷允上藥業(yè)有限公司技術(shù)中心,上海 201401)
歐前胡素可從歐前胡、獨(dú)活、白芷、當(dāng)歸等植物中提取得到,具有抗抑郁、抗腫瘤、鎮(zhèn)痛等作用[1-2],尤其是鎮(zhèn)痛活性,正受到密切關(guān)注[3-4],但王篤軍等[5]報(bào)道該成分具有一定毒性,因此需注意其安全性。歐前胡素溶解度較差[6],半衰期為2.39 h[7],在各腸段均有吸收[8],為了長(zhǎng)時(shí)間維持鎮(zhèn)痛效果,降低不良反應(yīng),將該成分制成緩釋制劑具有重要意義,有助于其充分吸收。目前,已有關(guān)于歐前胡素骨架緩釋片的報(bào)道[9],但其釋藥易受到胃腸道內(nèi)容物、pH值等因素的影響[10],可能會(huì)造成個(gè)體差異。
推挽式滲透泵控釋片又稱(chēng)雙層滲透泵控釋片[11-13],在助推動(dòng)層的作用下使藥物緩慢、勻速釋放出去,有助于降低不良反應(yīng),提高生物利用度及療效,主要適用于難溶性藥物,其特殊的釋藥機(jī)制可保證在釋藥過(guò)程不受體內(nèi)生理因素的影響,有利于消除個(gè)體差異。本實(shí)驗(yàn)采用Box-Behnken響應(yīng)面法優(yōu)化歐前胡素雙層滲透泵控釋片處方,為今后該制劑藥動(dòng)學(xué)、藥效學(xué)等方面的研究奠定基礎(chǔ)。
1 材料
1.1 儀器 安捷倫1200型高效液相色譜儀(美國(guó)安捷倫公司);BP210D型電子天平(0.01 mg,德國(guó)賽多利斯公司); TDP-6型單沖壓片機(jī)(上海天合制藥機(jī)械有限公司);BPZ-6120-2B型真空干燥箱(上海一恒科學(xué)儀器有限公司);DIS8000型全自動(dòng)溶出儀(香港嘉盛科技公司);GB10型高效包衣機(jī)(南寧宇盼機(jī)械科技有限公司)。
1.2 試劑與藥物 歐前胡素對(duì)照品(批號(hào)110826-201812,純度98.9%,中國(guó)食品藥品檢定研究院);歐前胡素原料藥(批號(hào)P161025,純度97.5%,上海源葉生物科技有限公司)。PEG 4000(批號(hào)WH175624869,廣州尚德化工有限公司);聚氧乙烯(PEO N750,PEO Coagulant,上海卡樂(lè)康包衣技術(shù)有限公司);氯化鈉(批號(hào)20190514TP,西安泰華醫(yī)藥科技有限公司);鄰苯二甲酸二丁酯(DBP,批號(hào)161020,杭州黔陽(yáng)科技有限公司);醋酸纖維素(CA,結(jié)合醋酸含量為54.5%~56.0%,批號(hào)20180225,國(guó)藥集團(tuán)化學(xué)試劑有限公司);硬脂酸鎂(批號(hào)WS171008,河南毅碩生物科技有限公司);微晶纖維素(型號(hào)MCC-102,批號(hào)200203,湖州市菱湖新望化學(xué)有限公司);氧化鐵紅(批號(hào)20181022,西安木成林藥用輔料有限公司)。
2 方法與結(jié)果
2.1 歐前胡素含量測(cè)定
2.1.1 色譜條件 Agilent Extend-C18色譜柱(250 mm×4.6 mm,5 μm);流動(dòng)相甲醇-水(60∶40);體積流量1.0 mL/min;柱溫30 ℃;檢測(cè)波長(zhǎng)300 nm;進(jìn)樣量20 μL。
2.1.2 供試品溶液制備 取15片雙層滲透泵控釋片,研細(xì),精密稱(chēng)取粉末適量(約含歐前胡素10 mg),置于50 mL量瓶中,30 mL甲醇超聲處理5 min,甲醇-水(60∶40)定容,搖勻后微孔濾膜過(guò)濾,取續(xù)濾液0.5 mL至10 mL量瓶中,流動(dòng)相定容,即得(質(zhì)量濃度約為10 μg/mL)。
2.1.3 線(xiàn)性關(guān)系考察 稱(chēng)取10 mg歐前胡素對(duì)照品,溶于50 mL甲醇中,得到貯備液,量取2.5 mL至10 mL容量瓶中,流動(dòng)相定容至50.0 μg/mL,作為對(duì)照品溶液,再用流動(dòng)相依次稀釋至0.05、1.0、5.0、10.0、25.0、50.0 μg/mL,各取20 μL,在“2.1.1”項(xiàng)色譜條件下進(jìn)樣測(cè)定。以歐前胡素質(zhì)量濃度為橫坐標(biāo)(X),峰面積為縱坐標(biāo)(Y)進(jìn)行回歸,得方程為Y=18.245 9X+0.158 4(r=0.999 8),在0.05~50.0 μg/mL范圍內(nèi)線(xiàn)性關(guān)系良好。
2.1.4 方法學(xué)考察 取“2.1.2”項(xiàng)下供試品溶液,于0、4、12、24、48、72 h在“2.1.1”項(xiàng)色譜條件下進(jìn)樣測(cè)定,測(cè)得歐前胡素峰面積RSD為0.96%,表明溶液在72 h內(nèi)穩(wěn)定性良好。取低(0.05 μg/mL)、中(10.0 μg/mL)、高(50.0 μg/mL)質(zhì)量濃度對(duì)照品溶液,在“2.1.1”項(xiàng)色譜條件下進(jìn)樣測(cè)定,測(cè)得日內(nèi)精密度RSD分別為0.10%、0.06%、0.11%;6 d內(nèi)每天進(jìn)樣測(cè)定1次,測(cè)得日間精密度RSD分別為0.27%、0.09%,0.36%,表明儀器精密度良好。按“2.1.2”項(xiàng)下方法制備6份供試品溶液,在“2.1.1”項(xiàng)色譜條件下進(jìn)樣測(cè)定,測(cè)得歐前胡素含量RSD為1.62%,表明該方法重復(fù)性良好。取空白雙層滲透泵控釋片研細(xì),精密稱(chēng)取9份,每3份分別加入歐前胡素對(duì)照品5、10、15 mg,在“2.1.1”項(xiàng)色譜條件下進(jìn)樣測(cè)定,測(cè)得歐前胡素平均加樣回收率分別為100.08%、99.42%、99.19%,RSD分別為0.92%、1.14%、1.56%。
2.2 釋放度測(cè)定 采用轉(zhuǎn)籃法。以900 mL 0.5% SDS溶液為釋放介質(zhì),采用抽濾法脫氣,設(shè)定溶出儀轉(zhuǎn)速為100 r/min,溫度為(37±0.5)℃,于0、1、2、4、6、8、10、12 h各自動(dòng)取樣3 mL,并自動(dòng)補(bǔ)加同體積0.5%SDS溶液,在“2.1.1”項(xiàng)色譜條件下進(jìn)樣測(cè)定,計(jì)算累積釋放度。
2.3 雙層滲透泵控釋片制備 在處方研究過(guò)程中,若主藥和其他賦形劑總量過(guò)少則無(wú)法壓片,也可能導(dǎo)致均一性差等問(wèn)題,故均按200片的量進(jìn)行混勻、制粒、壓片。由于口服片劑在胃及小腸中的平均滯留時(shí)間約為10~12 h,故體外釋放度考察時(shí)間確定為0~12 h。對(duì)滲透泵控釋片而言,12 h累積釋放度、釋藥線(xiàn)性是重要指標(biāo),故選擇兩者來(lái)篩選最佳處方。
2.3.1 含藥層制備 固定歐前胡素用量10 mg/片,稱(chēng)取25 mg/片NaCl、處方量PEO N750,微晶纖維素補(bǔ)充片重至150 mg/片,等量遞加混合,90%乙醇制軟材,過(guò)18目篩制粒,在室溫下自然干燥,過(guò)18目篩整粒,稱(chēng)定質(zhì)量,加入0.6%硬脂酸鎂混勻,即得。
2.3.2 助推層制備 稱(chēng)取80 mg/片PEO Coagulant、處方量NaCl、0.1 mg/片氧化鐵紅,微晶纖維素補(bǔ)片重至100 mg,等量遞加混合,90%乙醇制備軟材,過(guò)18目篩制粒,室溫自然干燥,過(guò)18目篩整粒,稱(chēng)定質(zhì)量,加入0.6%硬脂酸鎂混勻,對(duì)含藥層顆粒預(yù)壓后加入助推層壓顆粒,再次壓片,即得[直徑8 mm圓形片芯,硬度(50±10)N]。
2.3.3 包衣 將184 mL丙酮和16 mL水混勻,超聲處理15 min,得混合溶劑。稱(chēng)取0.6 g DBP、6.0 g CA、0.48 g PEG 4000混勻,加入有機(jī)溶劑攪拌溶解,將片芯置于包衣鍋中,設(shè)定溫度為40 ℃,轉(zhuǎn)速為40 r/min,控制包衣時(shí)間,在達(dá)到預(yù)定增重后取出,在45 ℃下過(guò)夜干燥以除去殘留溶劑并固化包衣膜,用打孔針在含藥層中心位置打約0.7 mm小孔,即得雙層滲透泵控釋片。
2.4 單因素試驗(yàn) 雙層滲透泵控釋片含藥層中助懸劑PEO N750用量對(duì)其體外釋藥有較大的影響,當(dāng)?shù)陀?00 mg/片時(shí)累積釋放度較低,而高于120 mg/片時(shí)會(huì)影響釋藥線(xiàn)性,故確定其范圍為100~120 mg/片。促滲透劑NaCl主要作用是加快含藥層的水化速度,降低混懸液的黏度,其用量對(duì)藥物釋放有一定的調(diào)節(jié)作用,但影響并不顯著[14],結(jié)合課題組前期研究及文獻(xiàn)[12]報(bào)道,固定含藥層中其用量為25 mg/片。
不同型號(hào)PEO分子量不同,吸水速率及膨脹速率也有所差異,對(duì)滲透泵片的影響主要體現(xiàn)在8~12 h時(shí)間段上。由于采用PEO Coagulant作為膨脹劑時(shí)釋藥較勻速,故選擇其進(jìn)行考察,但當(dāng)其用量超過(guò)90 mg/片時(shí)容易導(dǎo)致滲透泵片變形甚至破裂,而低于70 mg/片時(shí)會(huì)影響滲透泵片累積釋放度,故固定為80 mg/片。推動(dòng)層中NaCl作用也可加快水化速度,與PEO Coagulant一起形成滲透壓,由于滲透壓大小與藥物順利釋放相關(guān),故其用量對(duì)滲透泵片體外釋藥影響較大,并將其作為影響因素。前期研究結(jié)果顯示,當(dāng)推動(dòng)層中NaCl用量低于15 mg/片時(shí)會(huì)影響滲透泵片累積釋放度,但其用量高于25 mg/片時(shí)會(huì)影響滲透泵片釋藥線(xiàn)性,故確定其范圍為15~25 mg/片。
當(dāng)包衣增重低于5%時(shí),釋藥線(xiàn)性較差,而高于9%時(shí)會(huì)影響累積釋放度,故確定其范圍為5%~9%。釋藥孔徑在一定范圍內(nèi)對(duì)釋藥無(wú)顯著影響[15],但大于0.8 mm時(shí)控釋過(guò)程不再是單純的滲透控制,機(jī)制較為復(fù)雜[14],而小于0.3 mm時(shí)容易堵塞釋藥孔,故最終采用0.7 mm。
2.5 Box-Behnken響應(yīng)面法 預(yù)實(shí)驗(yàn)發(fā)現(xiàn),雙層滲透泵控釋片含藥層中PEO N750用量(X1)、推動(dòng)層NaCl用量(X2)、包衣增重(X3)是影響其體外釋藥的主要因素,故本實(shí)驗(yàn)也將三者納入研究,并選擇累積釋放度(Y1)、釋藥線(xiàn)性(Y2)作為評(píng)價(jià)指標(biāo),采用Box-Behnken響應(yīng)面法優(yōu)化處方,因素水平見(jiàn)表1,結(jié)果見(jiàn)表2。
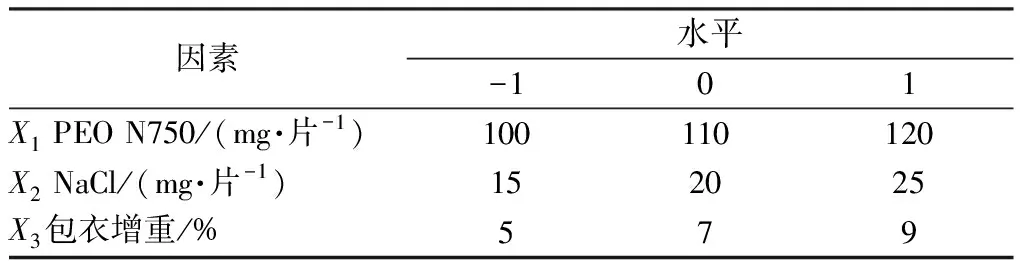
表1 因素水平
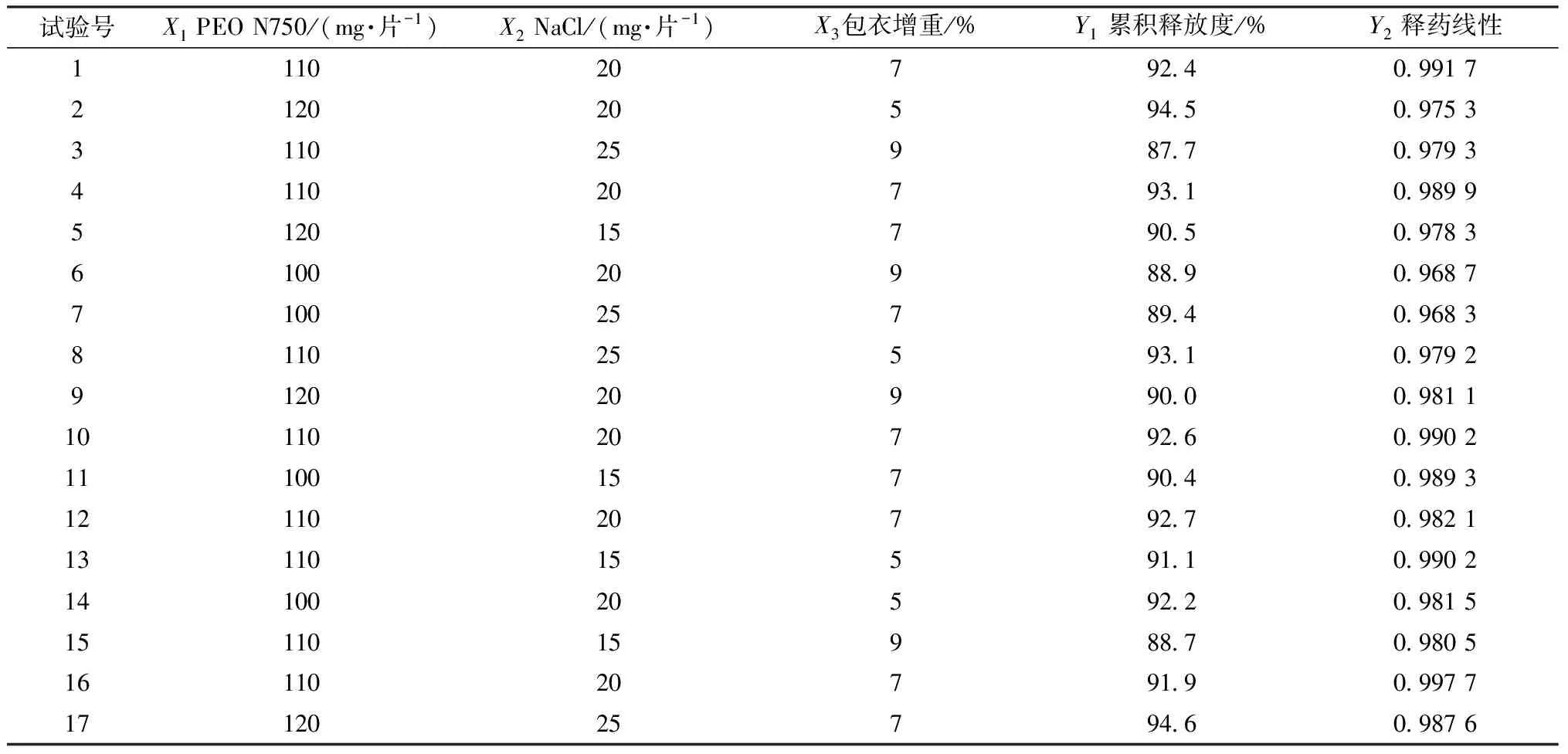
表2 試驗(yàn)設(shè)計(jì)與結(jié)果
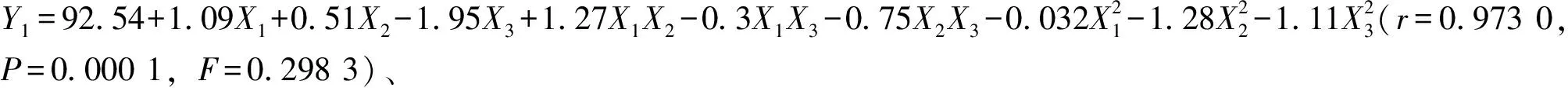
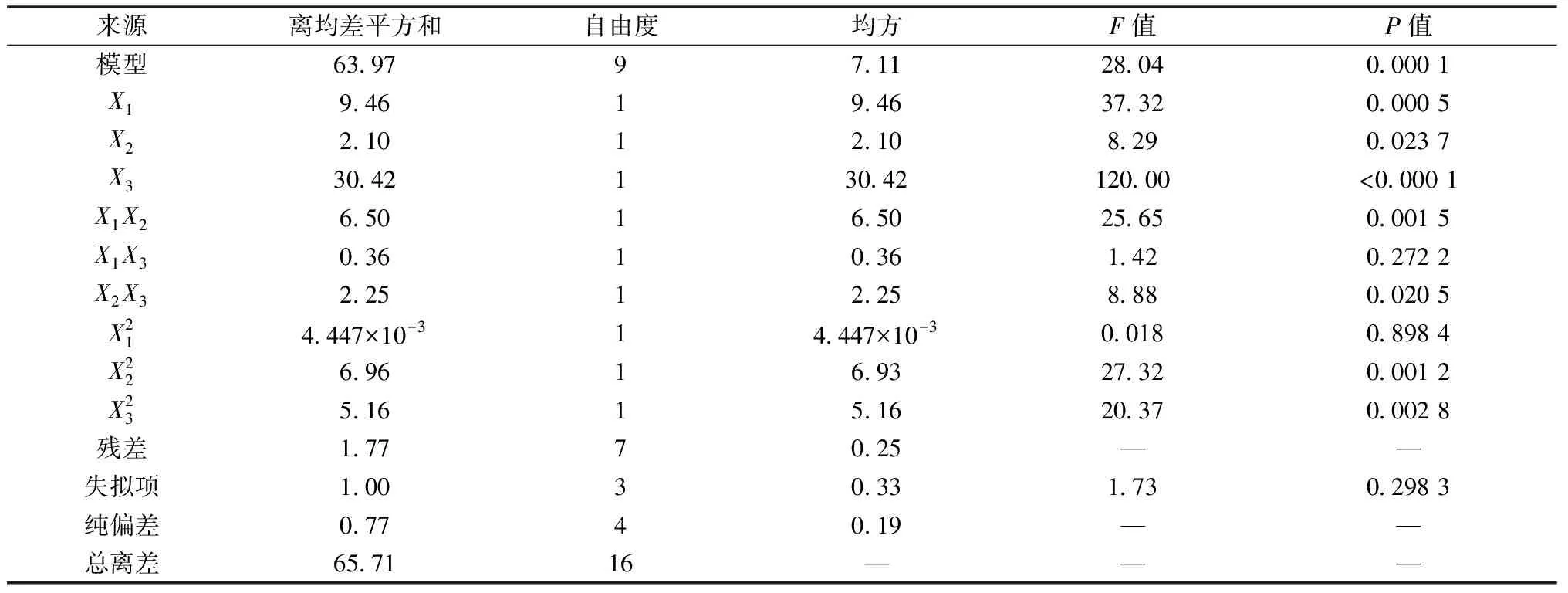
表3 Y1方差分析

表4 Y2方差分析
采用Design Expert V8.0.6軟件進(jìn)行響應(yīng)面分析,結(jié)果見(jiàn)圖1~2。由圖1可知,固定包衣增重為7%時(shí),累積釋放度隨著NaCl用量、PEO N750用量增加而升高;固定NaCl用量為20 mg/片時(shí),累積釋放度隨著包衣增重增加而逐漸降低,但隨著PEO N750用量增加而迅速升高;固定PEO N750用量為110 mg/片時(shí),累積釋放度隨著NaCl用量增加而升高,而包衣增重對(duì)其影響較小。由圖2可知,固定包衣增重為7%時(shí),釋藥線(xiàn)性隨著NaCl用量增加而降低;隨著PEO N750用量增加,釋藥線(xiàn)性先升后降;固定NaCl用量為20 mg/片時(shí),釋藥線(xiàn)性隨著包衣增重、PEO N750用量增加先升后降;固定PEO N750用量為110 mg/片時(shí),釋藥線(xiàn)性隨著NaCl用量增加逐漸降低,而隨著包衣增重的增加先升后降。另外,由于表2中X2對(duì)Y2影響的P值為0.025 9<0.05,故需要控制NaCl用量在合適范圍內(nèi)才能使?jié)B透泵片零級(jí)釋放更明顯。
調(diào)整累積釋放度最大值為100%,釋藥線(xiàn)性最大值為1.000 0,得最優(yōu)處方為X1=116.3 mg/片,X2=22.5 mg/片,X3=6.4%,累積釋放度為94.18%,釋藥線(xiàn)性為0.987 8。
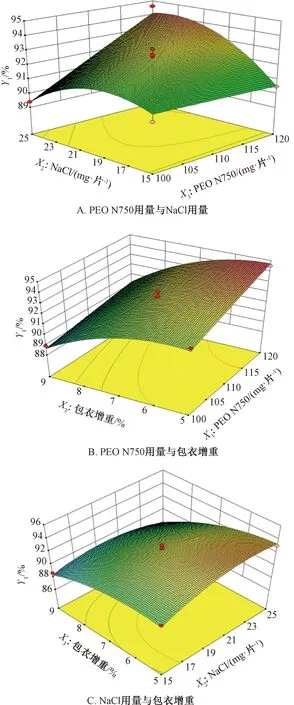
圖1 各因素響應(yīng)面圖(Y1)Fig.1 Response surface plots for various factors (Y1)
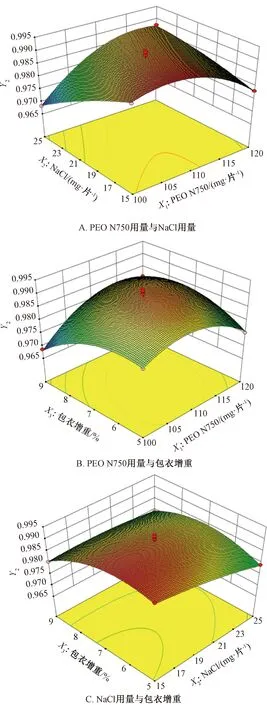
圖2 各因素響應(yīng)面圖(Y2)Fig.2 Response surface plots for various factors (Y2)
2.6 驗(yàn)證試驗(yàn) 按“2.5”項(xiàng)下優(yōu)化處方制備3批雙層滲透泵控釋片,測(cè)得累積釋放度分別為93.84%、94.73%、92.81%,基本釋放完全,釋藥曲線(xiàn)見(jiàn)圖3;釋藥線(xiàn)性分別為0.986 6、0.984 2、0.9819,釋藥過(guò)程為恒速,符合零級(jí)釋藥模型,同時(shí)也表明該方法重復(fù)性良好,模型穩(wěn)定可靠。
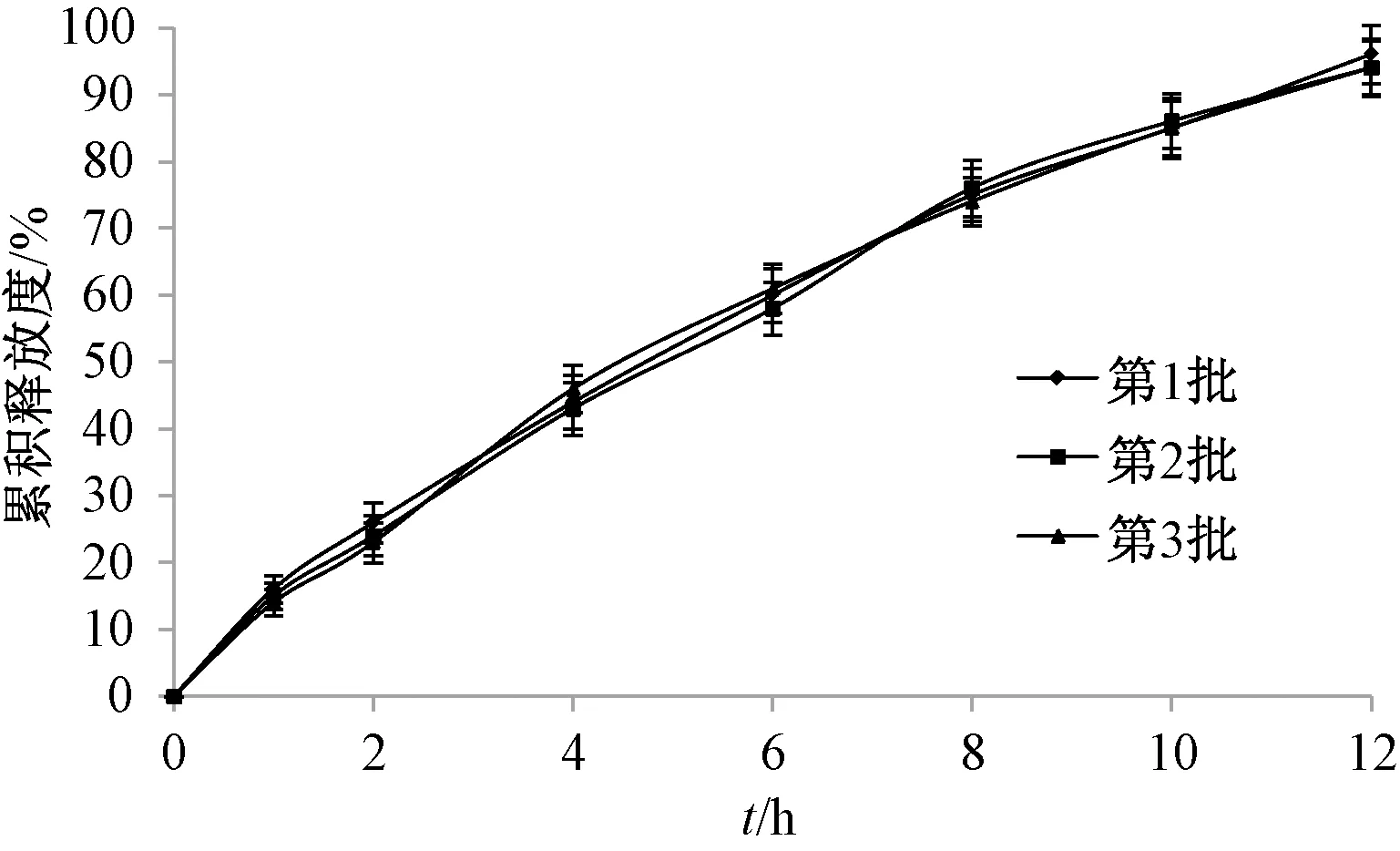
圖3 3批雙層滲透泵控釋片體外釋藥曲線(xiàn)(n=6)Fig.3 In vitro drug release curves for three batches of controlled release push-pull osmotic pump tablets (n=6)
2.7 pH值對(duì)雙層滲透泵控釋片體外釋藥的影響 考察雙層滲透泵控釋片在pH6.8磷酸緩沖液、pH4.5醋酸鹽緩沖液、pH1.2鹽酸、水(均含0.5%SDS)中的體外釋藥,結(jié)果見(jiàn)圖4,并計(jì)算兩兩釋藥曲線(xiàn)的相似因子[13]。由此可知,相似因子在68.4~80.6之間,均大于50,表明釋藥相似性較高;釋藥線(xiàn)性均大于0.961 7,表明pH值對(duì)雙層滲透泵控釋片體外釋藥無(wú)明顯影響。
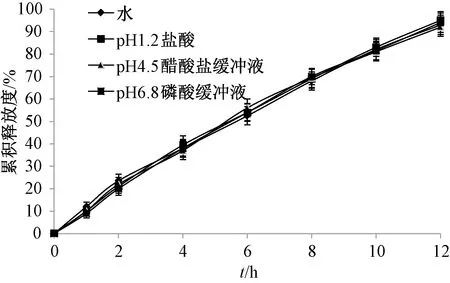
圖4 pH值對(duì)雙層滲透泵控釋片體外釋藥的影響(n=6)Fig.4 Effect of pH value on the in vitro drug release of controlled release push-pull osmotic pump tablets (n=6)
3 討論
單層滲透泵片雖然制備工藝簡(jiǎn)單,但其累積釋放度低于雙層滲透泵控釋片,這是因?yàn)楹笳吣芴峁└叩尼屗巹?dòng)力[11]。另外,溶解度差的藥物制成單層滲透泵片時(shí),一般需要引入增溶技術(shù)(包合物、固體分散體等)來(lái)提高其溶解度及滲透壓,但制備工藝反而復(fù)雜化。雙層滲透泵控釋片依靠推動(dòng)層中高分子材料遇水溶脹產(chǎn)生推動(dòng)力,在包衣膜的控釋作用下(包衣膜厚度等)使藥物緩慢釋放,并在一定時(shí)間內(nèi)基本釋放完全(本實(shí)驗(yàn)中制劑釋放時(shí)間為12 h),由于該制劑控制了藥物釋放速度,對(duì)其體內(nèi)吸收產(chǎn)生影響,故可為抑制血藥濃度波動(dòng)、提高生物利用度、增強(qiáng)藥效奠定基礎(chǔ),同時(shí)體外釋藥不受pH值影響,有助于消除個(gè)體差異。
本實(shí)驗(yàn)采用飽和溶劑法,測(cè)得歐前胡素在水中的溶解度為18.92 mg/L,而在0.5%SDS溶液中達(dá)47.58 mg/L,為了達(dá)到漏槽條件,選擇后者作為溶出介質(zhì)。然后,采用Box-Behnken響應(yīng)面法優(yōu)化歐前胡素雙層滲透泵控釋片,解決了正交試驗(yàn)精密度差、無(wú)法找到處方工藝最佳點(diǎn)的實(shí)際問(wèn)題;與中心復(fù)合設(shè)計(jì)法比較,也可減少試驗(yàn)次數(shù),節(jié)約成本。據(jù)統(tǒng)計(jì),歐前胡素相關(guān)制劑每天口服劑量在3.8~11.7 mg之間[16-17],故本實(shí)驗(yàn)設(shè)定歐前胡素雙層滲透泵控釋片口服劑量為10 mg。今后,將繼續(xù)對(duì)歐前胡素雙層滲透泵控釋片的體內(nèi)藥動(dòng)學(xué)、藥效學(xué)等方面進(jìn)行評(píng)價(jià),并結(jié)合毒理學(xué)來(lái)進(jìn)一步確定其每天服用次數(shù),考察其口服劑量是否合理。

