SLC及其受體CCR7與Ⅰ期非小細胞肺癌淋巴結(jié)微轉(zhuǎn)移的相關(guān)性*
裴艷志 聶美楠 姜騰蛟 王曉強 李春磊 路通 朱曉峰 鄒志田
(佳木斯大學(xué)附屬第一醫(yī)院 1.胸外科; 2.病理科,黑龍江 佳木斯 154007)
早期非小細胞肺癌(Non-small cell lung cancer,NSCLC)是肺癌中預(yù)后較好的一類,但其切除后復(fù)發(fā)率高達30%左右,對患者遠期生存造成了不利影響[1-2]。目前臨床上對于NSCLC行根治術(shù)后的淋巴結(jié)檢測發(fā)現(xiàn)部分患者淋巴結(jié)中存在有單個或直徑小于0.2 mm的癌細胞簇,而此類患者術(shù)后復(fù)發(fā)的幾率顯著較大,說明微轉(zhuǎn)移對于患者預(yù)后具有顯著的相關(guān)性[3]。由于微轉(zhuǎn)移是較少的癌細胞轉(zhuǎn)移后造成,故極易被正常組織細胞覆蓋,通過影像學(xué)及實驗室檢查很難對其進行診斷,故目前臨床上通過PCR及免疫組化法對相關(guān)標記物的檢測成為NSCLC的主要診斷方式[4-5]。溶質(zhì)載體(Solute carrier,SLC)家族是負責(zé)人體細胞膜內(nèi)外氨基酸、核苷酸、糖及無機離子轉(zhuǎn)運的重要載體,對于細胞分裂及正常生理活動具有顯著的影響,以往研究提示,SLC家族中的SLC7A11與部分惡性腫瘤的轉(zhuǎn)移、耐藥及凋亡等活動過程顯著相關(guān)[6]。而趨化因子受體7(Chemokine receptor 7,CCR7)作為激活細胞免疫的重要介質(zhì),在NSCLC發(fā)生和發(fā)展過程中具有至關(guān)重要的作用,同時作為SLC家族的高親和度受體,CCR7與SLC之間存在互相影響的情況[7]。目前國內(nèi)外將上述兩個因素用于預(yù)測Ⅰ期NSCLC淋巴結(jié)微轉(zhuǎn)移的相關(guān)研究較少,故開展本研究,旨在進一步完善早期NSCLC病情的評估,為制定臨床治療方案打下良好基礎(chǔ)。
1 資料與方法
1.1 一般資料 選取2019年1月~2020年3月于我院就診的I期NSCLC患者。納入標準:①符合《中華醫(yī)學(xué)會肺癌臨床診療指南(2018版)》中對于Ⅰ期NSCLC診斷的相關(guān)標準[8]。②患者均達到手術(shù)切除指征并耐受手術(shù)。③患者依從性較好且知情同意并接受完整的療程。排除標準:①伴有除NSCLC外的其他惡性腫瘤疾病。②既往NSCLC手術(shù)或治療史。③嚴重的器官功能障礙。④近期肺部炎癥或全身性感染性疾病。⑤1月內(nèi)抗生素使用史。⑥營養(yǎng)狀態(tài)正常。符合上述標準并與患者簽訂知情同意書后共計納入患者127例。其中,患者平均(53.47±11.29)歲;男性89例,女性38例;ⅠA1期33例,ⅠA2期42例,ⅠA3期24例,ⅠB期28例。按照淋巴結(jié)微轉(zhuǎn)移情況分為對照組(n=92)與轉(zhuǎn)移組(n=35)兩組。
1.2 方法
1.2.1 手術(shù)治療方案 所有患者入院后均行常規(guī)檢查,并通過影像學(xué)檢查資料確定手術(shù)方案,擇期行NSCLC根治術(shù)并按照《中華醫(yī)學(xué)會肺癌臨床診療指南(2018版)》[8]中相關(guān)標準進行淋巴結(jié)清掃,術(shù)后切除肺組織及淋巴結(jié)送活檢。
1.2.2 病灶組織免疫組化分析 收集的組織標本均經(jīng) 10% 中性福爾馬林固定,石蠟包埋,4 μm 厚切片,HE染色。免疫組化染色采用EnVision兩步法,一抗選用SLC7A11及CCR7,二抗選用HRP標記聚合物。具體操作步驟嚴格按試劑盒說明書進行,每張切片均設(shè)陽、陰性對照,見圖1。
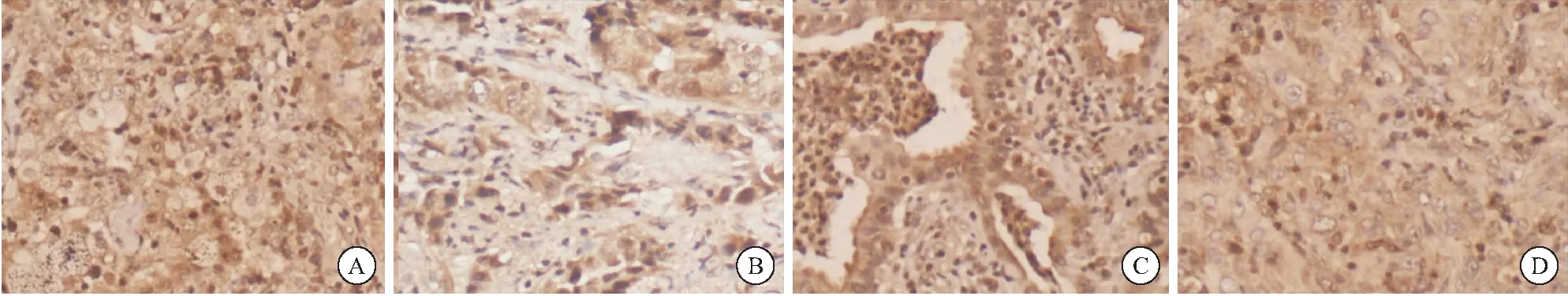
圖1 典型免疫組化圖片
1.2.3 蛋白表達評分 由兩名有經(jīng)驗的病理醫(yī)師采用雙盲法閱片,以腫瘤細胞有定位準確、染色清晰的黃色顆粒為陽性。按照陽性細胞所占百分數(shù)與染色強度分別評分,兩項分數(shù)相乘得到抗體表達水平評分,以此作為陽性判定標準[9]。陽性細胞百分數(shù):<10%為0分,10%~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分。染色強度:無陽性染色為0分,淺黃色為1分,黃色為2分,棕黃色為3分。抗體表達水平評分0~1分為(-),2~4分為(+),6~8分為(++),9~12分為(+++)。
1.3 觀察指標及評判標準
1.3.1 微淋巴結(jié)轉(zhuǎn)移評價標準 根據(jù)患者術(shù)中淋巴結(jié)清掃送檢后細胞檢查結(jié)果,參照美國癌癥聯(lián)合委員會(American Joint Committee on Cancer,AJCC)的診斷標準:在常規(guī)病理檢查陰性的淋巴結(jié)中檢測到單個腫瘤細胞或腫瘤細胞團的最大直徑<0.2 mm[10]。
1.3.2 臨床資料收集 收集患者年齡、性別構(gòu)成、吸煙史及基礎(chǔ)疾病。
1.3.3 實驗室檢查資料收集 病灶內(nèi)SLC7A11及CCR7的免疫組化結(jié)果、病理分型、分化程度。
1.3.4 影像學(xué)檢查資料收集 病灶直徑、病灶位置、腫瘤類型、受累部位、磨玻璃樣影及PET/CT檢查結(jié)果(SUVmax及TLG)。
1.4 統(tǒng)計學(xué)分析 數(shù)據(jù)采用SPSS 25.0軟件進行統(tǒng)計學(xué)分析,計數(shù)資料采用n(%)表示,采用2檢驗比較組間差異,等級資料采用等級資料比較采用Wilcoxon符號秩和檢驗,理論頻數(shù)<1采用Fisher確切概率檢驗;計量資料以均數(shù)±標準差表示,采用獨立樣本t檢驗;采用二元Logistic回歸分析 SLC及CCR7與I期非小細胞肺癌淋巴結(jié)微轉(zhuǎn)移之間的相關(guān)性;采用ROC曲線分析SLC及CCR7對I期非小細胞肺癌淋巴結(jié)微轉(zhuǎn)移的預(yù)測性,并計算曲線下面積(Area under the curve,AUC),P<0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的單因素分析 兩組患者SLC7A11及CCR7表達水平存在顯著差異(P<0.05),見表1。

表1 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的單因素分析[n(×10-2)]
2.2 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的單因素分析 轉(zhuǎn)移組患者病灶直徑、支氣管受累及TLG顯著高于對照組(P<0.05),見表2。

表2 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的單因素分析[n(×10-2)]
2.3 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的Logistic回歸分析 根據(jù)單因素分析結(jié)果,將淋巴結(jié)微轉(zhuǎn)移情況作為因變量(1=是,0=否);將單因素分析存在差異的項目作為自變量(表3)進行二元Logistic回歸分析,結(jié)果顯示:病灶直徑(OR=49.254,95%CI=11.062~507.604)是影響NSCLC淋巴結(jié)微轉(zhuǎn)移的獨立危險因素(P<0.05);SLC7A11(OR=8.622)及CCR7(OR=8.709)表達水平是影響NSCLC淋巴結(jié)微轉(zhuǎn)移的獨立因素,其中相較于SLC7A11表達“+++”,表達“-”

表3 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的Logistic回歸分析賦值
(OR=0.053,95%CI=0.006~0.494)、是影響NSCLC淋巴結(jié)微轉(zhuǎn)移的保護因素;而相較于CCR7表達“+++”,表達“-”(OR=0.051,95%CI=0.007~0.404)是影響NSCLC淋巴結(jié)微轉(zhuǎn)移的保護因素(P<0.05),見表4。

表4 影響NSCLC微淋巴結(jié)轉(zhuǎn)移的Logistic回歸分析
2.4 SLC7A11及CCR7表達水平對NSCLC患者淋巴結(jié)微轉(zhuǎn)移的預(yù)測性分析 通過ROC曲線分析SLC7A11、CCR7及聯(lián)合診斷對NSCLC微淋巴結(jié)轉(zhuǎn)移診斷效能之間的差異,結(jié)果顯示SLC7A11、CCR7及聯(lián)合診斷NSCLC淋巴結(jié)微轉(zhuǎn)移具有較好的檢測價值(均P<0.05),見表5、圖2。分析3種檢測方式對于NSCLC患者淋巴結(jié)微轉(zhuǎn)移的預(yù)測效能結(jié)果顯示,聯(lián)合檢測特異度顯著高于 SLC7A11及CCR7單獨檢測(2=7.292,15.125;均P<0.01),見表6。

表5 SLC7A11及CCR7表達水平對NSCLC患者淋巴結(jié)微轉(zhuǎn)移的預(yù)測性分析

表6 SLC7A11及CCR7表達水平及聯(lián)合檢測對NSCLC患者淋巴結(jié)微轉(zhuǎn)移的診斷的效能(×10-2)

圖2 SLC7A11及CCR7表達水平對NSCLC患者淋巴結(jié)微轉(zhuǎn)移的ROC曲線
3 討論
早期NSCLC患者通過手術(shù)及有效的放化療可以顯著提升5年內(nèi)生存率,但是相關(guān)研究顯示,判斷患者淋巴結(jié)微轉(zhuǎn)移情況對于患者手術(shù)方案及術(shù)后放化療方案具有至關(guān)重要的作用[11-12]。對于NSCLC發(fā)生微小淋巴結(jié)轉(zhuǎn)移進行病理診斷是目前臨床中的金標準,但是尋找被癌細胞侵犯的微小淋巴結(jié)難度較大,通過影像學(xué)、穿刺活檢等檢出率相對較低,這給目前NSCLC微小淋巴結(jié)轉(zhuǎn)移的診斷帶來了極大的困難。既往對于患者淋巴結(jié)微轉(zhuǎn)移通常采用癌灶部位免疫組化標記物進行了大量研究,提出角細胞蛋白及其抗體在NSCLC細胞中表達異常且可以作為淋巴結(jié)微轉(zhuǎn)移的預(yù)測指標[13]。但也有研究提出免疫組化檢測方式的敏感度高,但特異度相對較低,其主要原因與標記物的特異度有顯著關(guān)系,故需要尋找新的免疫組化標記物,提升預(yù)測的可靠程度[14]。
本研究中,共計35例患者發(fā)生了微小淋巴結(jié)轉(zhuǎn)移,發(fā)生率為27.5%,這一結(jié)果與黃斌等[15]研究中的26.7%相近,說明微小淋巴結(jié)轉(zhuǎn)移在NSCLC患者中屬于較為常見的轉(zhuǎn)移方式。SLC是體內(nèi)重要的基因家族,其包含大約 60 多個亞型,主要參與體內(nèi)轉(zhuǎn)運蛋白的編碼,而其中的SLC7是參與氨基酸轉(zhuǎn)運的重要介質(zhì)。SLC7A11基因作為SLC7中重要成員,在人體腦、肝等重要組織及巨噬細胞、淋巴細胞等免疫系統(tǒng)重要細胞中均有表達[16-17]。而其編碼的SLC7A11蛋白與 SLC3A2組成胱氨酸/谷氨酸反轉(zhuǎn)運體,是細胞活動的重要參與因素[18]。本研究結(jié)果顯示,SLC7A11與NSCLC淋巴結(jié)微轉(zhuǎn)移有顯著的關(guān)系。通過動物實驗結(jié)果顯示,通過抑制SLC7A11表達可調(diào)節(jié)caveolin-1/β-catenin通路,進而增強腫瘤細胞間的黏附,削弱細胞-細胞外基質(zhì)的黏附,促使NSCLC腫瘤細胞局限于原發(fā)灶,降低其擴散或侵襲力[19-20]。同時當(dāng)癌細胞出現(xiàn)葡萄糖耗竭時可通過 ATF4 和 NRF2 轉(zhuǎn)錄因子誘導(dǎo) SLC7A11 表達來促使NSCLC細胞葡萄糖缺乏條件下的癌細胞存活,進而滿足NSCLC細胞在缺乏營養(yǎng)條件下的分裂復(fù)制,故抑制SLC7A11表達的基因可以進一步阻斷癌細胞分裂復(fù)制能力,降低其侵襲度[21]。通過以上研究能看出,SLC7A11高表達可以增強NSCLC細胞的侵襲轉(zhuǎn)移能力,故其與NSLCLC細胞微淋巴結(jié)轉(zhuǎn)移顯著相關(guān)。而Zhang等[22]的研究提出,作為SLC受體的CCR7其主要作用在激活局部的免疫反應(yīng),促進巨噬細胞、淋巴細胞等異常表達,在SLC7A11異常表達激活CCR7后會導(dǎo)致局部炎性反應(yīng)加重,從而導(dǎo)致血管及淋巴管通透性增加,達到促進癌細胞轉(zhuǎn)移的可能性,而本研究中也得出了CCR7表達量與NSCLC淋巴結(jié)微轉(zhuǎn)移顯著相關(guān)的結(jié)論。同時Pu等[23]研究中提出,作為CCR7配體的CCL21在人體的淋巴管內(nèi)皮細胞內(nèi)高表達,故推測NSCLC細胞中CCR7高表達時受到淋巴管內(nèi)CCL21吸引可能是特異性介導(dǎo)NSCLC淋巴結(jié)轉(zhuǎn)移的重要因素。本研究中還指出,腫瘤直徑、支氣管受累及TLG與NSCLC患者微淋巴結(jié)轉(zhuǎn)移有關(guān),其中腫瘤直徑與疾病分期顯著相關(guān),瘤體較大患者其病程時間及癌細胞分裂情況相對較重,故發(fā)生微轉(zhuǎn)移的可能性也相對較大;其次支氣管上具有淋巴管及淋巴結(jié)等系統(tǒng),當(dāng)癌細胞侵犯支氣管時可能通過侵犯淋巴結(jié)及淋巴管從而導(dǎo)致淋巴結(jié)微轉(zhuǎn)移;而TLG是反應(yīng)病灶糖酵解的重要指標,在Hensley等[24]研究中顯示,糖酵解是NSCLC細胞分裂的能量主要提供途徑,TLG高意味著患者局部NSCLC細胞分裂活躍,故發(fā)生淋巴結(jié)微轉(zhuǎn)移的可能性也顯著上升。
通過多因素分析結(jié)果卻將支氣管受累及TLG排除NSCLC微淋巴結(jié)轉(zhuǎn)移的獨立影響因素,可能有以下原因:①由于本次納入為Ⅰ期NSCLC患者,發(fā)生淋巴結(jié)轉(zhuǎn)移的可能性相對較小,同時局部糖酵情況解受到機體調(diào)節(jié)影響因素較多,故削弱了上述兩個指標與NSCLC微淋巴結(jié)轉(zhuǎn)移的相關(guān)性。②本次納入樣本量相對較少,結(jié)果出現(xiàn)偏倚的可能性較大。而結(jié)果中作為NSCLC微淋巴結(jié)轉(zhuǎn)移的獨立影響因素的SLC7A11及CCR7表達水再次證實了上述兩組指標與NSCLC微淋巴結(jié)轉(zhuǎn)移的相關(guān)度較高,可以作為預(yù)測微淋巴結(jié)轉(zhuǎn)移的指標。但在之后建立ROC曲線后發(fā)現(xiàn),兩者特異度均低于80%,結(jié)合之前研究中提出目前臨床上需要提升檢測特異性的要求,對兩者進行并聯(lián)后再次對NSCLC患者淋巴結(jié)微轉(zhuǎn)移進行預(yù)測,結(jié)果將檢測特異度提升至91.25%,達到了預(yù)期的實驗?zāi)繕恕5?lián)合檢測并未進一步提升檢測的敏感度,故在今后的研究中可以結(jié)合以往常用的PCR及免疫組化指標進行預(yù)測,進一步完善對NSCLC患者微淋巴結(jié)轉(zhuǎn)移的預(yù)測效能。
4 結(jié)論
SLC家族的中SLC7A11及其受體CCR7與NSCLC患者微淋巴結(jié)轉(zhuǎn)移顯著相關(guān),通過兩者聯(lián)合檢測還能有效提升NSCLC患者微淋巴結(jié)轉(zhuǎn)移預(yù)測特異度,但將其應(yīng)用于NSCLC臨床診斷尚需要更多研究予以充分驗證。
至謝:佳木斯大學(xué)公共衛(wèi)生學(xué)院張紫萱老師在統(tǒng)計學(xué)方面給予的幫助和指導(dǎo)。

