miR-16-5p靶向PTEN/PI3K/AKT信號通路對非小細胞肺癌細胞活性和遷移能力的影響*
陳民彪 蔡仁中 黃明芳 黃修明 廖緒強
(海南省人民醫院·海南醫學院附屬海南醫院胸外科,海南 海口 570311)
肺癌是常見的惡性腫瘤之一,以非小細胞肺癌(Non-samll cell lung cancer,NSCLC)發病率最高,占肺癌發病率的80%以上[1-3]。目前,NSCLC的臨床治療主要以手術切除、化療、放療為主,但預后不理想[4-6]。MicroRNA(miRNA)是一類內源性表達的非編碼小分子RNA,長度約為22個核苷酸,能通過與靶基因相互作用調節基因表達,其失調涉及癌細胞的各個方面,包括細胞的生長、凋亡、增殖、遷移和侵襲等過程[7-8]。蛋白酪氨酸磷酸酶基因(PTEN)是近年被發現的包括NSCLC在內的各種癌癥類型中眾所周知的腫瘤抑制因子,通過介導磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-kinase, PI3K)/絲氨酸-蘇氨酸激酶(Protein kinase B, AKT)信號通路的活化,與癌癥進展密切相關[9]。miR-16-5p在NSCLC中低表達,其被認為是NSCLC的抑癌基因。因此,本研究旨在探討NSCLC中低表達的miR-16-5p對A549細胞活性、遷移和PTEN/PI3K/AKT信號通路的影響。
1 材料與方法
1.1 細胞株和主要材料 人源性NSCLC A549細胞株購自中科院上海細胞庫;TRIzol和LipofectamineTM2000轉染試劑購自Invitrogen公司(美國);AS-miR-16-5p及miR-NC序列的設計合成委托上海康成生物工程有限公司(中國);含雙抗的RPMI 1640培養基購自Invitrogen公司(美國);胎牛血清購自Hyclone公司(美國);MTT試劑購自Sigma公司(美國);Transwell小室購自Millipore公司(美國);PTEN抗體、p-AKT抗體PI3K抗體購自Invitrogen公司(美國)。
1.2 細胞培養 A549細胞培養于含10%胎牛血清RPMI 1640培養基中,置于37 ℃、5% CO2的培養箱內培養并進行傳代。取傳代后對數期細胞用于后續實驗。
1.3 細胞轉染 收集A549細胞接種于6孔板中,分為Blank組、miR-NC組和AS-miR-16-5p組。根據LipofectamineTM2000說明書,在無血清RPMI 1640培養基中轉染miR-NC和AS-miR-16-5p質粒。在轉染6 h后,培養基替換為含10%胎牛血清的RPMI 1640培養基培養48 h。收獲細胞用于qRT-PCR分析。
1.4 qRT-PCR檢測 TRIzol試劑提取細胞mRNA,根據反轉錄試劑盒步驟合成cDNA,然后擴增目的基因,檢測miR-16-5p表達水平。
1.5 MTT檢測 將每組A549細胞以每孔2×104個細胞接種在96孔板,置于37 ℃培養箱中分別培養至24、48、72、96 h,然后小心棄掉上清液。每孔中加入20 μL MTT溶液,并在培養箱中孵育4~6 h,然后小心棄掉上清液。每孔中加入150 μL DMSO溶液,避光震蕩10 min,通過酶標儀測定A549細胞在570 nm波長時的吸光度(OD值)。
1.6 細胞劃痕實驗 將每組A549細胞接種于6孔板,待細胞融合度達到90%時,使用無菌移液器在細胞上進行垂直刮擦,然后將培養板用PBS洗滌2次,然后加入含10%胎牛血清的RPMI 1640培養基培養24 h后拍照。
1.7 Transwell實驗 將每組A549細胞接種于24孔板中Transwell上室中,將500 μL含10%胎牛血清的RPMI 1640培養基加入下室中,37℃培養箱中培養細胞24 h。4%多聚甲醛固定后去除上室細胞,用0.1%結晶紫染色,通過酶標儀測定A549細胞在570 nm波長時的吸光度(OD值)。
1.8 蛋白質印跡法 收集每組A549細胞并用PBS洗滌3次。RIPA裂解緩沖液提取細胞的總蛋白,并通過BCA法進行蛋白定量。對總蛋白(25 μg蛋白/泳道)進行SDS-PAGE凝膠電泳,然后將蛋白轉移到PVDF膜上,5%脫脂牛奶封閉2 h。將膜與一抗在4℃孵育過夜,然后與二抗在室溫孵育1 h。使用ECL發光劑顯影并通過軟件進行定量。

2 結果
2.1 AS-miR-16-5p對NSCLC A549細胞miR-16-5p表達水平的影響 與Blank組、miR-NC組相比,AS-miR-16-5p組miR-16-5p表達水平下降(P<0.05);Blank組與miR-NC組相比,差異無統計學意義(P>0.05);表明AS-miR-16-5p抑制miR-16-5p在NSCLC A549細胞的表達,見圖1。

圖1 AS-miR-16-5p對NSCLC A549細胞miR-16-5p表達水平的影響
2.2 AS-miR-16-5p對NSCLC A549細胞活性的影響 與Blank組、miR-NC組比較,AS-miR-16-5p組細胞活性降低(P<0.05);Blank組與miR-NC組比較,差異無統計學意義(P>0.05);表明AS-miR-16-5p顯著抑制NSCLC A549細胞的活性,見圖2。

圖2 AS-miR-16-5p對NSCLC A549細胞活性的影響
2.3 AS-miR-16-5p對NSCLC A549細胞遷移能力的影響 細胞劃痕實驗結果顯示,經處理24 h后,AS-miR-16-5p組較同期Blank組和miR-NC組細胞愈合率降低(P<0.05),見圖3。此外,Transwell實驗結果顯示,AS-miR-16-5p組較同期Blank組和miR-NC組細胞遷移能力降低(P<0.05),表明AS-miR-16-5p對NSCLC A549細胞的遷移能力具有明顯的抑制作用,見圖4。
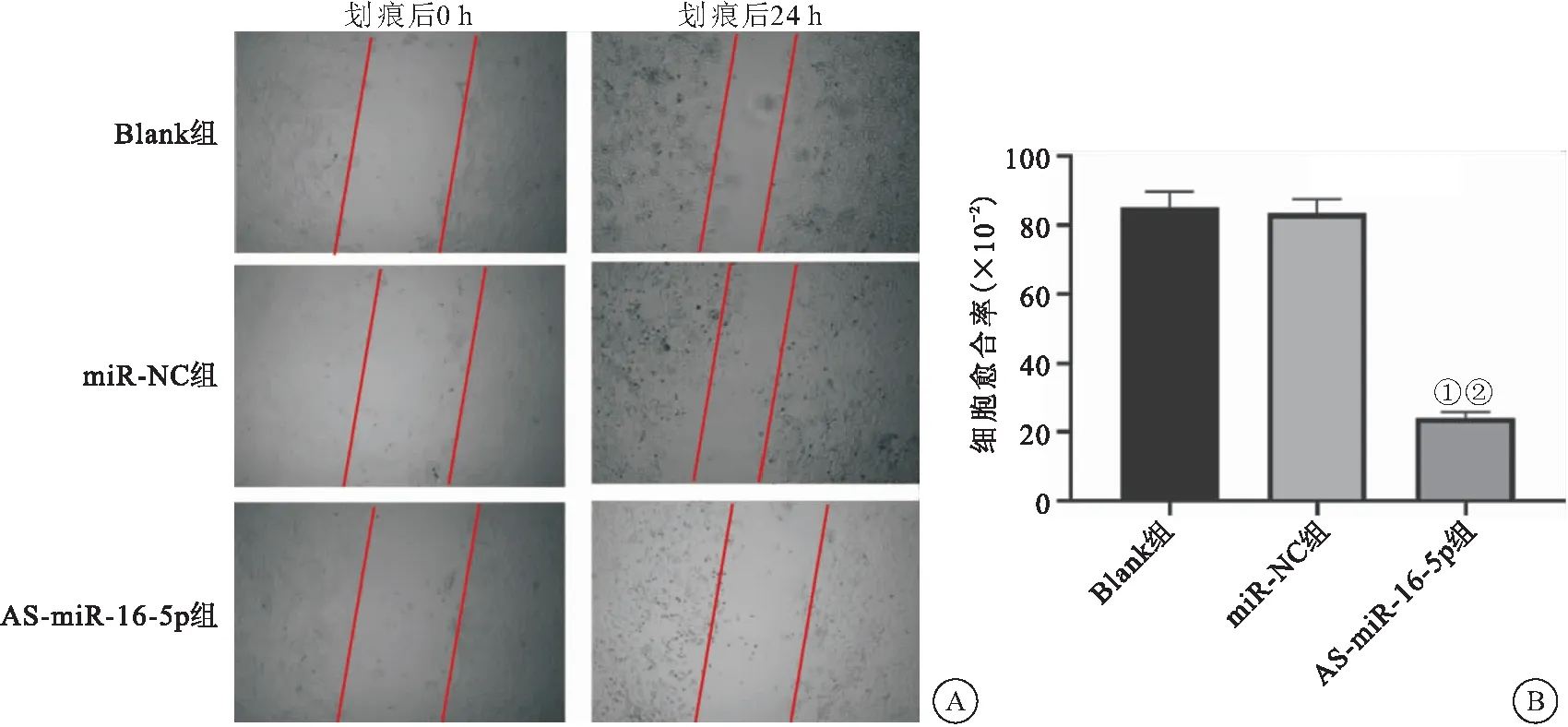
圖3 AS-miR-16-5p對NSCLC A549細胞愈合率的影響

圖4 AS-miR-16-5p對NSCLC A549細胞遷移能力的影響(×200)
2.4 AS-miR-16-5p對PTEN/PI3K/AKT通路蛋白表達的影響 與miR-NC組和Blank組相比,AS-miR-16-5p組PTEN蛋白表達顯著升高(P<0.05);相反,PI3K和p-AKT蛋白表達顯著下降(P<0.05);表明AS-miR-16-5p調節PTEN/PI3K/AKT通路蛋白表達,見圖5。
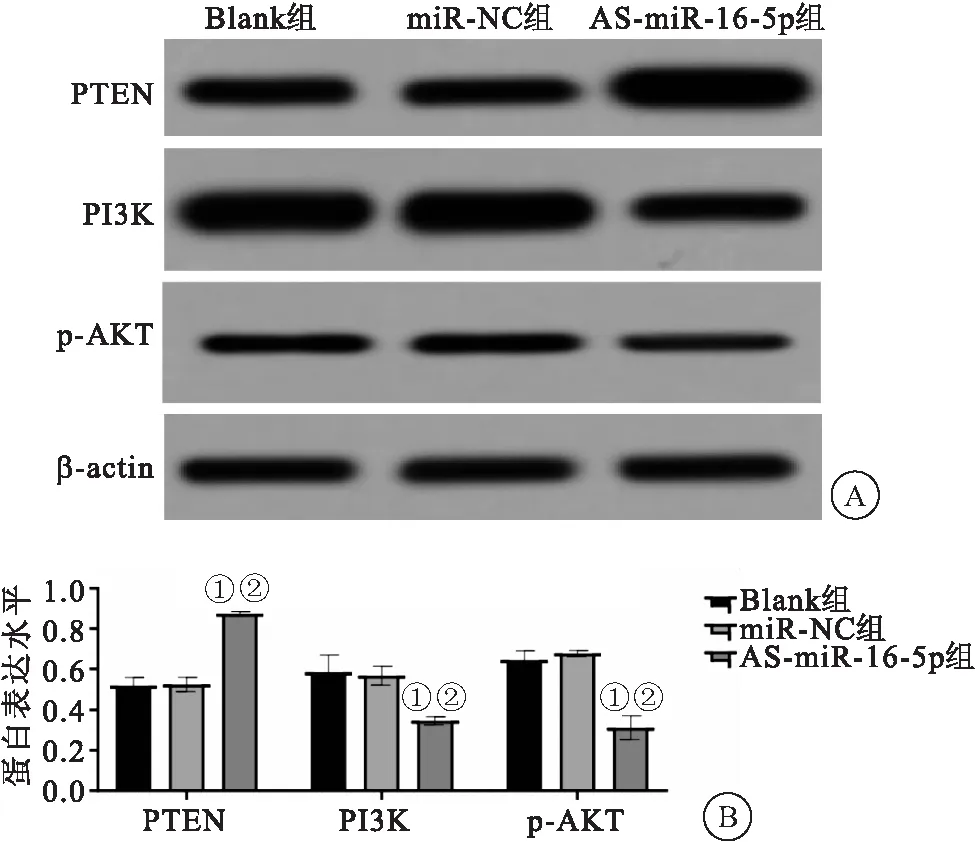
圖5 AS-miR-16-5p對PTEN/PI3K/AKT通路蛋白表達的影響
3 討論
NSCLC是一種常見的呼吸系統惡性腫瘤,其發病率和死亡率逐年增加,占肺癌的總發病率80%左右[10-11]。miRNA是由19-24個核苷酸組成的內源性非編碼RNA,與靶標mRNA的5′-URT或3′-UTR互補位點結合以調節靶標基因的表達,并進一步抑制翻譯和降解靶標基因。目前發現的miRNAs達1000余種,在癌癥的疾病進程中呈現高表達或低表達,發揮癌基因或抑癌基因的作用。miR-16-5p是miRNA-16家族中的一個亞型,現已明確miR-16-5p是一種抑癌基因,在腫瘤的發生、發展過程中具有調節細胞增殖、遷移和侵襲的能力[12-14]。在這項研究中,發現轉染細胞中AS-miR-16-5p表達降低。靶向PTEN/PI3K/AKT信號通路的AS-miR-16-5p通過調節細胞活性和遷移對NSCLC具有抗癌作用,這可能為NSCLC的精確治療提供理論參考。
PTEN/PI3K/AKT通路參與細胞增殖、凋亡等多種生命活動[15-18]。PTEN為人第10號染色體缺失的磷酸酶及張力蛋白同源的基因,是NSCLC中已知的預后標志物和腫瘤抑制因子,同時具有脂質磷酸酶和蛋白磷酸酶活性[19]。PTEN的低表達或者失活能夠增強PI3K/AKT信號通路活化。PI3Ks家族包含在PI3K/AKT信號通路中,通過調節抗腫瘤藥物研究中的各種細胞過程,成為重要的腫瘤靶標[20-21]。有研究證實,在許多腫瘤中減少或不存在的抑癌基因PTEN具有雙重特異性磷酸酶活性,其脂質磷酸酶活性通過滅活PI3K/AKT信號通路來阻止生物過程,從而抑制腫瘤的發展[22]。也有文獻記載,PTEN的失活通過激活PI3K/AKT信號通路增強了NSCLC細胞的侵襲能力,PTEN表達的上調可以抑制NSCLC細胞增殖并促進細胞凋亡,說明在NSCLC細胞中PTEN通過負調節PI3K / Akt通路來發揮其抑癌作用,而PI3K/Akt通路在生長發育、增殖、凋亡、遷移、浸潤過程中發揮重要作用[23-25]。miR-16-5p已經被證實參與腫瘤細胞的遷移、侵襲和血管生成[26-28]。隨后也被證實通過靶向PTEN靶標來調節細胞周期蛋白和PI3K/AKT信號通路來促進惡性黑色素瘤進展。本研究通過轉染AS-miR-16-5p 48 h后A549細胞內miR-16-5p表達下調,又分別通過MTT實驗、劃痕實驗和Transwell實驗,證實AS-miR-16-5p能明顯抑制A549細胞的活性和遷移。并且發現,應用AS-miR-16-5p抑制miR-16-5p后,PTEN蛋白表達增高,證明miR-16-5p調控PTEN表達,進而影響其下游PI3K和AKT蛋白表達。
4 結論
AS-miR-16-5p能夠抑制NSCLC A549細胞活性和遷移。此外,AS-miR-16-5p通過負調控PTEN/PI3K/AKT信號通路有可能成為NSCLC新靶點之一。本研究為NSCLC的生物靶向治療提供了新的思路和依據。

