酶法制備酸棗仁ACE抑制肽理化性質研究
譚力銘,曹 妍,裴海生,郝建雄, ,李慧穎
(1.河北科技大學食品與生物學院,河北石家莊 050000;2.河北省功能食品技術創新中心,河北石家莊 050000;3.衡水市衛生健康委員會綜合監督執法局,河北衡水 053000;4.農業農村部規劃設計研究院,北京 100121)
酸棗仁是將酸棗(Ziziphus jujubaMill. var.spinosa)分離出果核,從果核中分離得到的種子[1],在華北地區、陜西、內蒙古等地產量豐富。酸棗仁被認定為藥食同源食品,其中蛋白質含量約為36%,并含有三萜類、甾醇、酸棗仁皂甙等多種功能性物質[2],營養價值較高。酸棗仁有鎮靜、催眠、鎮痛、斂汗、降壓作用[3]。目前相關研究僅局限于藥理作用下的酸棗仁黃酮、酸棗仁皂苷等成分研究[4],其蛋白相關的功能特性和理化性質卻鮮有報道。
血管緊張素轉化酶抑制肽,又稱ACE(Angiotensin-I Converting Enzyme)抑制肽是一類可以抑制血管緊張素轉化酶的小分子肽段,ACE抑制肽具有安全、高效、易吸收等優點[5?6]。世界上第一種ACE抑制劑是從南美蝮蛇的毒液中得到[7],而目前常見的降壓藥物如:卡托普利、賴諾普利等同樣是從蛇的毒液中獲取[8]。而目前從蛇的毒液中獲取以外的天然ACE抑制肽來源主要有動物來源和植物來源,已發現的具有ACE抑制作用的植物源如:大豆、豌豆、玉米、小麥、魔芋、核桃、大蒜、苦瓜種子等[9?16];動物源如:蛋清、鰱魚、豬血紅等[17?19]。
近年來,從植物源ACE抑制肽的相關研究一直是研究熱點。ACE抑制肽在實際生產應用時,其理化性質方面的研究極為重要。賀磊[20]通過酶解法制備魔芋ACE抑制肽,經分離純化后,測定其理化性質,為指導工業生產提供理論依據。目前對于ACE抑制肽的相關研究較為普遍,但關于酸棗仁ACE抑制肽的理化性質研究尚且還是空白。本文分析了脫脂酸棗仁粉的基本營養成分和酸棗仁ACE抑制肽的氨基酸成分,通過分子量分布、粒度分布、微觀結構觀察等實驗立體論證酸棗仁蛋白的酶解效果。最后針對酸棗仁蛋白酶解前后理化性質以及酸棗仁ACE抑制肽的實際生產應用進行了溶解度、熱穩定性、持水性和持油性、起泡性和起泡穩定性、乳化性和乳化穩定性、感官特性等實驗分析。本文主要從工藝的角度對酸棗仁粗多肽開展初步的研究與分析,以期為后續的分離純化及活性研究提供理論依據。
1 材料與方法
1.1 材料與儀器
酸棗仁 河北省邢臺市潤玉食品有限公司提供;牛血清蛋白、考馬斯亮藍G-250 生化純,北京奧博星生物技術有限公司;鹽酸、氫氧化鈉、氫氧化鉀、硫酸銅、硫酸鉀、十二烷基硫酸鈉、葡萄糖 分析純,天津市永大化學試劑有限公司;硼酸、硫酸、磷酸、苯酚 分析純,天津歐博凱化工股份有限公司;石油醚 分析純,國藥集團化學試劑有限公司;甲基紅指示劑、溴甲酚綠指示劑、亞甲基紅指示劑 分析純,上海遠慕生物科技有限公司;金龍魚大豆油 食用級,嘉里糧油有限公司。
DF-101集熱式恒溫加熱磁力攪拌器 鞏義市予華儀器有限責任公司;HC-3018高速離心機 安徽中科中佳科學儀器有限公司;RT-25型氣流式超微粉碎機 榮聰精密科技有限公司;LGJ-10D型冷凍干燥機 北京四環科學儀器廠有限公司;SPECTRO star Nano酶標儀 德國BMG LABTECH公司;MDSCQ200差式量熱掃描儀 美國TA公司;L-8800氨基酸自動分析儀、Hitachi S-4800掃描電子顯微鏡 日本日立公司;RE52-AAA粒度分析儀上海嘉鵬科技有限公司;UPT-K1800全自動凱氏定氮儀 北京優譜通用科技有限公司;MB90水分測定儀 美國奧豪斯公司;SXT-06索氏抽提器 上海本昂科學儀器有限公司;V-1600B分光光度計 上海美譜達儀器有限公司;KS-800KDE高功率超聲波清洗器 寶雞新宇光機電有限責任公司;JRA-35S均質儀 無錫杰瑞安儀器設備有限公司;ST2100實驗室pH計 奧豪斯儀器(常州)有限公司。
1.2 實驗方法
1.2.1 酸棗仁蛋白的制備 取200 g酸棗仁以液氮為冷源通入粉碎機,打粉1 min,過80目篩。將粗粉碎的酸棗仁粉放入氣流式超微粉碎機,以液氮為冷源通入超微粉碎機,電流設置5 A,粉碎1 min,過150目篩,收集密封放入4 ℃冰箱備用[21]。
將粉碎好的酸棗仁粉與石油醚按料液比1:3(g/mL),50 ℃水浴浸提30 min,離心(4000 r/min、10 min)去除上清液,重復多次,直到上清液完全澄清透明,室溫通風12 h,40 ℃干燥12 h,得到脫脂酸棗仁粉,收集密封放入?20 ℃冰箱備用。
稱取1 g脫脂酸棗仁粉,按液料比32:1(mL/g)溶解于蒸餾水中,調節溶液pH11.4,51 ℃下水浴攪拌浸提58 min,離心(5000 r/min、20 min)得上清液,調節溶液pH至酸棗仁蛋白等電點即pH4.6,4 ℃靜置2 h,離心(5000 r/min、15 min)得到酸棗仁蛋白沉淀,?70 ℃冷凍干燥24 h得到酸棗仁蛋白粉,置于?20 ℃冰箱備用。
1.2.2 酸棗仁ACE抑制肽的制備 稱取1 g凍干后酸棗仁蛋白粉,按底物濃度為3.1%溶解于蒸餾水中,按酶添加量為6000 U/g加入中性蛋白酶和堿性蛋白酶,中性蛋白酶與堿性蛋白酶比例為2.1:1,調節溶液pH至7.5,于54 ℃下水浴攪拌浸提62 min,酶解過程中保持酶解液pH、溫度不變。酶解結束后滅酶活,沸水浴10 min,待酶解液冷卻至室溫后,調節溶液pH至酸棗仁蛋白等電點即pH4.6,4 ℃靜置2 h,離心(5000 r/min、15 min)得到酸棗仁ACE抑制肽沉淀,?70 ℃冷凍干燥24 h,置于?20 ℃冰箱備用。
1.2.3 脫脂酸棗仁基本成分測定 以脫脂酸棗仁粉為原料,測定基本成分。蛋白質測定:參照GB 5009.5-2016《食品中蛋白質的測定》[22],凱氏定氮法;水分測定:參照GB 5009.3-2016《食品中水分的測定》[23],直接干燥法;灰分測定:參照GB 5009.4-2016《食品中灰分的測定》[24],干法灰化法;粗脂肪測定:參照GB 5009.6-2016《食品中脂肪的測定》[25],索氏抽提法;粗纖維測定:參照GB/T 5009.10-2003《植物類食品中粗纖維的測定》[26];總糖測定:參照SN/T 4260-2015《出口植物源食品中粗多糖含量的測定》[27],苯酚-硫酸法。
1.2.4 氨基酸分析 稱取過80目篩的酸棗仁ACE抑制肽凍干粉80 mg于反應釜中,加入10 mL,濃度為6 mol/L的HCl,密封于110 ℃烘箱水解24 h。取1 mL稀釋50倍,用0.22 μm濾膜過濾至液相小瓶,于氨基酸自動分析儀測定。
1.2.5 分子量分布測定 以酸棗仁ACE抑制肽凍干粉為原料,采用凝膠滲透色譜法,測定酸棗仁ACE抑制肽分子量分布。凝膠滲透色譜測定條件:色譜柱:SB-806HQ;流動相:0.02%硝酸鈉水溶液;流速:1 mL/min;柱溫:40 ℃;進樣體積:500 μL。
樣品制備:樣品溶解于質量分數為0.02%硝酸鈉水溶液,配制質量濃度為3 mg/mL樣品溶液,過0.45 μm濾膜。
1.2.6 粒度分布測定 以酸棗仁ACE抑制肽凍干粉和酸棗仁蛋白為原料,樣品按1:10(W/W)用去離子水稀釋,激光粒度分析儀的操作參數:分散模式為通用;顆粒折射率1.520;顆粒吸收率0.1;分散劑水;分散劑折射率:1.333;泵的轉速2200 r/min。
1.2.7 微觀結構觀察 使用掃描電子顯微鏡觀察酸棗仁ACE抑制肽和酸棗仁蛋白的微觀結構。噴金處理,加速電壓 30 kV。
1.2.8 熱穩定性 以酸棗仁ACE抑制肽凍干粉和酸棗仁蛋白為原料,采用差示掃描量熱法測定酸棗仁ACE抑制肽熱穩定性,量取適量樣品放入差示掃描量熱儀分析儀專用鋁盒中,將制備好的鋁盒放入差示掃描量熱儀分析儀中,檢測條件為:采用氮氣;氣壓為0.2 MPa;氣體流量為20 mL/min;升溫速率為10 ℃/min,從60 ℃上升到200 ℃。記錄升溫過程中樣品的DSC曲線。采用專業軟件記錄和分析吸熱曲線上的起始溫度、終止溫度、變性溫度、和熱焓值(ΔH)。
1.2.9 溶解度測定 以酸棗仁ACE抑制肽凍干粉和酸棗仁蛋白為原料,稱取一定量樣品溶解于蒸餾水中,配制2 mg/mL樣品溶液,用1 mol/L氫氧化鈉或鹽酸溶液將溶液pH調節為2.0~10.0,攪拌混勻,離心(4000 r/min,20 min),上清液采用考馬斯亮藍法測定蛋白含量,用牛血清蛋白作標準曲線,樣品溶解性的計算公式為:

1.2.10 持水性和持油性的測定 以酸棗仁ACE抑制肽凍干粉和酸棗仁蛋白為原料,稱取0.1 g樣品與5 mL蒸餾水(大豆油)于離心管混溶,使用均質機混合,靜置30 min,離心(4000 r/min,20 min),測量上清液體積,體積減少量即為持水量與持油量。
1.2.11 起泡性和起泡穩定性的測定 以酸棗仁ACE抑制肽凍干粉和酸棗仁蛋白為原料,稱取一定量樣品溶解于蒸餾水中,配制成5 mg/mL樣品溶液,用1 mol/L的氫氧化鈉或鹽酸溶液將溶液pH分別調節為2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,記錄初始體積為V0/mL,10000 r/min均質2 min,記錄體積為V1/mL,靜置30 min,記錄體積為V2/mL。起泡性和泡沫穩定性計算公式為:

1.2.12 乳化性和乳化穩定性 以酸棗仁ACE抑制肽凍干粉和酸棗仁蛋白為原料,稱取一定量樣品,配制成10 mg/mL樣品溶液,用1 mol/L氫氧化鈉或鹽酸溶液調節溶液pH為2.0~10.0,取10 mL樣品溶液加入3.0 mL大豆油,10000 r/min均質2 min,吸取底部50 μL乳狀液,加入5 mL、0.1%十二烷基硫酸鈉(SDS)溶液混勻,在500 nm波長處測定吸光度,記為A0。靜置10 min后,再次用上述方法測定吸光度,記為A1。乳化性和乳化穩定性計算公式為:

式中:N表示稀釋倍數;Φ表示油相的體積分數,%;L表示光程,cm;C表示調節pH后樣品溶液中的蛋白質量濃度,g/mL;t表示時間,min。
1.2.13 感官特性 對制備出的酸棗仁ACE抑制肽和酸棗仁蛋白進行感官評定[20]。主要從色澤、性狀、形態、氣味等方面評定。
1.3 數據處理
所有試驗均重復 3次,試驗結果用平均值±標準差表示,使用OriginPro 8.0、SPSS Statistics 22.0對試驗數據進行處理和分析。
2 結果與分析
2.1 脫脂酸棗仁基本成分測定結果
由表1可知,脫脂酸棗仁蛋白質含量為(73.40±0.23)g/100 g,相關研究脫脂酸棗仁蛋白質含量為(68.93±0.30)g/100 g[28],說明該酸棗仁原料蛋白質含量高,經脫脂過程,蛋白質保存較好,利于開展后續研究。

表1 脫脂酸棗仁主要成分(g/100 g)Table 1 Main ingredients of defatted jujube seed main ingredients (g/100 g)
2.2 酸棗仁ACE抑制肽氨基酸分析結果
由表2可知,酸棗仁ACE抑制肽有較好的氨基酸組成,谷氨酸含量最高,其次是脯氨酸和亮氨酸,半胱氨酸含量最低。必需氨基酸含量占36.48%,含量較高,且纈氨酸、異亮氨酸、亮氨酸含量均達到聯合國糧農組織和世界衛生組織(FAO/WHO)的兒童推薦標準[29],蘇氨酸、纈氨酸、異亮氨酸、亮氨酸含量均達到成人推薦標準。其中必需氨基酸與非必需氨基酸的比值為0.5743,高于大豆蛋白(0.4804),屬于優質蛋白。疏水性氨基酸含量占51.14%,且相關研究表明ACE抑制活性與疏水性氨基酸有關[30],側面證明酸棗仁ACE抑制肽的ACE抑制活性。

表2 酸棗仁ACE抑制肽氨基酸成分分析Table 2 Analysis of amino acid composition of ACE inhibitor peptide in jujube seed
2.3 酸棗仁ACE抑制肽的分子量分布測定結果
由圖1、圖2和表3可知,酸棗仁ACE抑制肽分子量主要集中在1000~3000 Da,占97.50%,符合相關研究表明具備降壓效果的多肽分子量主要集中在1000~3000 Da[31?33]。由表4可知,數均分子量(Mn)表示分子量在1517 Da時,兩側分布的分子數量相同。重均分子量(Mw)表示分子量在1652 Da時,兩側有同等重量的分子分布。由于該聚合物分子量分布極窄,其峰值分子量(Mp)為1343 Da。而多分散性指數(Mw/Mn)為1.088,表明酶解后的酸棗仁ACE抑制肽分散聚合物鏈長相近,分子量分布極窄,也符合分子量分布結果。
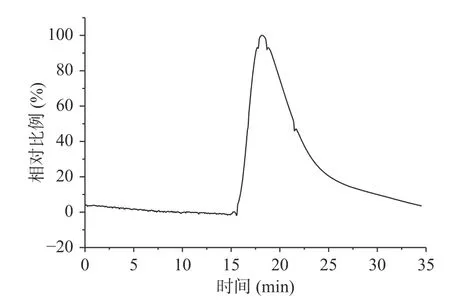
圖1 酸棗仁ACE抑制肽凝膠色譜圖Fig.1 Ace inhibiting peptide gel chromatogram of jujube seed
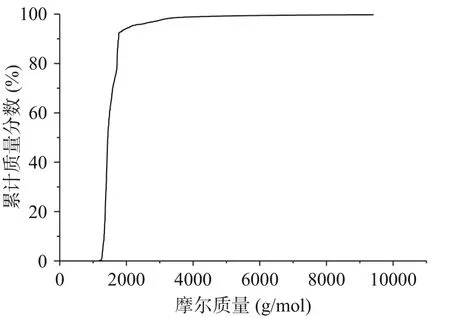
圖2 酸棗仁ACE抑制肽的GPC譜圖Fig.2 GPC spectrum of ACE inhibitory peptides from jujube seed

表3 酸棗仁ACE抑制肽分子量分布Table 3 Molecular weight distribution of ACE inhibitory peptides from jujube seed
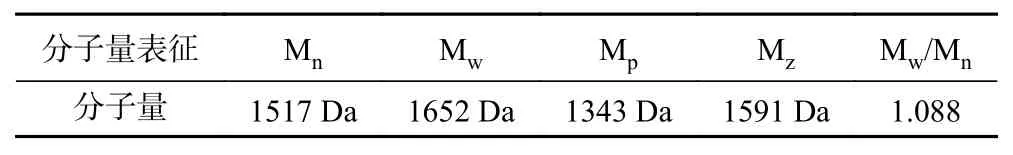
表4 分子量表征結果Table 4 Molecular weight characterization results
2.4 酸棗仁蛋白與酸棗仁ACE抑制肽的粒度分布測定結果
由圖3、圖4可知,酸棗仁蛋白粒徑積累曲線在(50~60)μm處出現單峰,符合正態分布。而酸棗仁ACE抑制肽出現2個峰,分別在(0.6~0.7)μm和(6~7)μm,說明在酶解過程中,這兩種粒徑的酶解物較多,且酶解物粒徑較酶解前減小。由表5可知,酸棗仁蛋白粒徑特征值都明顯高于酸棗仁ACE抑制肽,說明酶解充分。
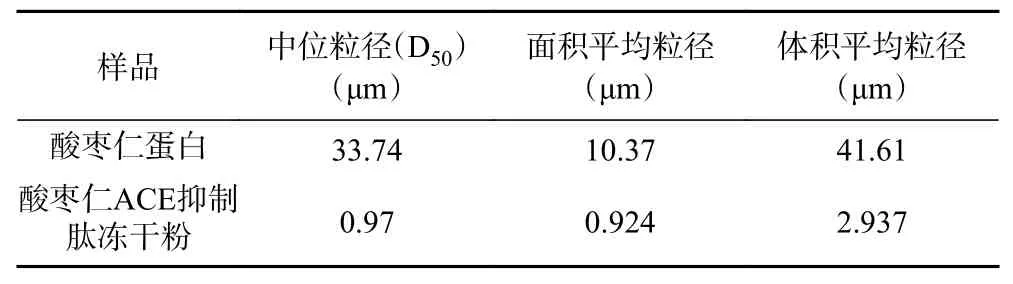
表5 酸棗仁蛋白與酸棗仁ACE抑制肽粒徑特征值Table 5 Particle size characteristic values of jujube kernel protein and ACE inhibitory peptides in jujube kernel
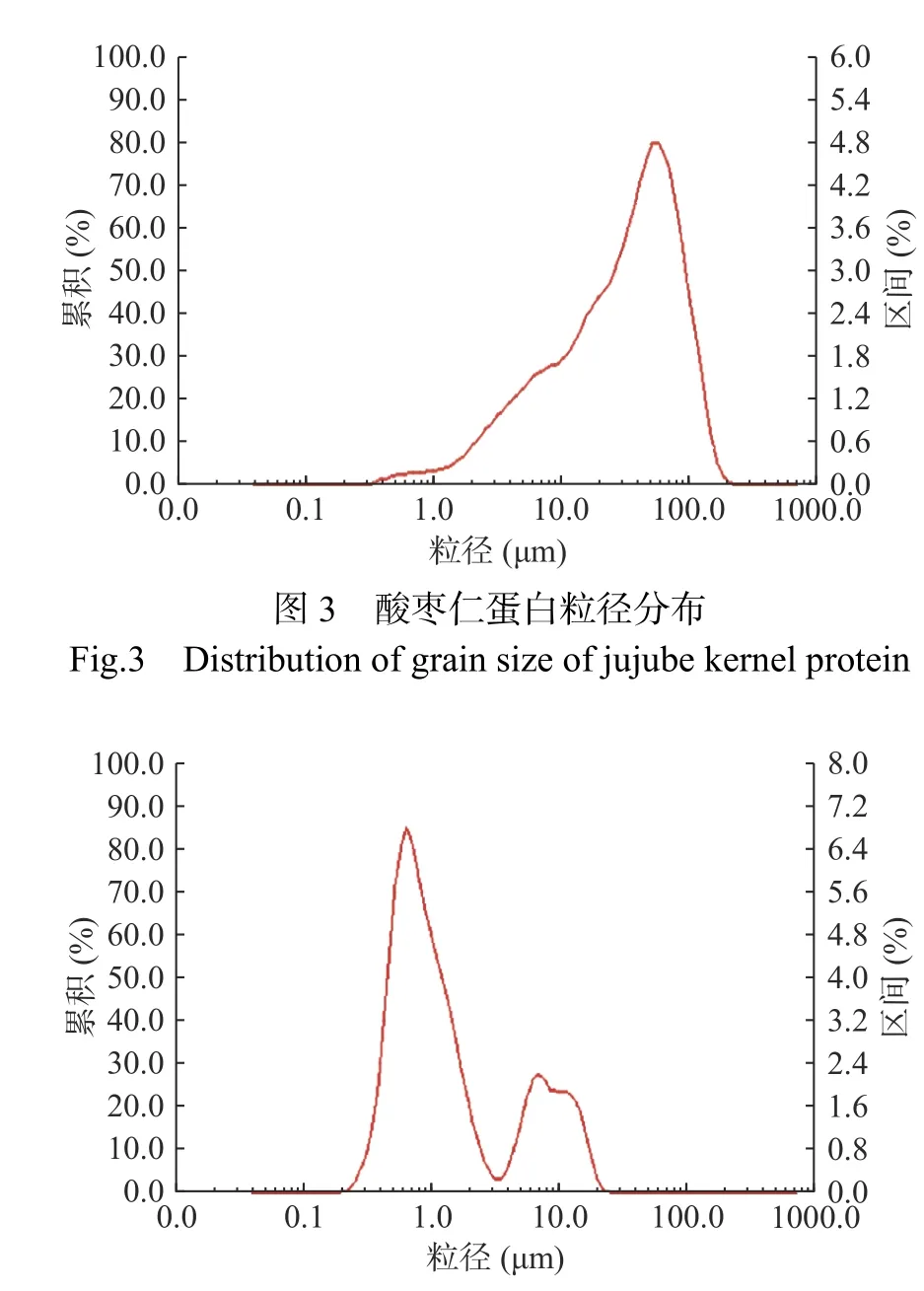
圖4 酸棗仁ACE抑制肽粒徑分布Fig.4 Particle size distribution of ACE inhibitory peptides in jujube seed
2.5 酸棗仁蛋白與酸棗仁ACE抑制肽的微觀結構觀察結果
掃描電鏡在0.5、1、5、10 k倍視野下觀察到酸棗仁蛋白和酸棗仁ACE抑制肽的表面微觀結構如圖5所示,酸棗仁蛋白在固體狀態下是不規則的,表面有凸起,多孔性,呈鉸鏈狀聚合在一起,分子結構較大,酸棗仁蛋白分子之間交聯程度低,未形成致密的網絡狀結構。酸棗仁ACE抑制肽通過酶解,蛋白結構被打破,片狀結構消失,小顆粒的物質開始聚合,形成表面光滑、致密、略帶褶皺,與粒徑分析結果吻合,且與相關研究結果一致[34?35]。

圖5 掃描電鏡圖Fig.5 Scanning electron microscopy
2.6 酸棗仁蛋白與酸棗仁ACE抑制肽的熱穩定性結果
由圖6和表6可知,酸棗仁蛋白和酸棗仁ACE抑制肽隨著溫度的升高,分子間鏈被打開,需要吸收熱量,DSC逐漸曲線上升。酸棗仁ACE抑制肽的熱變性溫度為109.6 ℃,明顯高于酸棗仁蛋白熱變性溫度95.8 ℃,說明酸棗仁ACE抑制肽熱穩定性較好。熱焓值(ΔH)反映蛋白質的變性狀態,即蛋白質結構的維持能力、蛋白質有序結構、蛋白質的熱穩定性[36]。酸棗仁ACE抑制肽的熱焓值為19.6 J/g,明顯高于酸棗仁ACE抑制肽的熱焓值3.3 J/g ,由此得出酸棗仁ACE抑制肽比酸棗仁蛋白更穩定,對熱敏感度相對較低,這可能與酶解過程中肽鏈的斷開有關。

表6 酸棗仁蛋白與酸棗仁ACE抑制肽熱力學特征值Table 6 Thermodynamic characteristic values of jujube kernel protein and ACE inhibitory peptide in jujube kernel
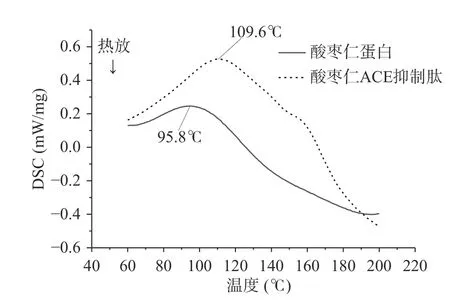
圖6 酸棗仁蛋白和酸棗仁ACE抑制肽的DSC曲線Fig.6 DSC curves of jujube seed protein and ACE inhibitory peptide
2.7 酸棗仁蛋白與酸棗仁ACE抑制肽的溶解度測定結果
由圖7可知,在接近等電點(pH5)處,酸棗仁蛋白和酸棗仁ACE抑制肽的溶解度最低,當遠離等電點時,溶解度逐漸升高,與Jain[37]等研究得出溶解度曲線類似。因為在等電點時,蛋白質分子的凈電荷為零,不存在相互作用力,顆粒易相互作用形成沉淀,此時溶解度最低,當溶液的pH逐漸遠離等電點時,由于電荷作用,蛋白質產生相互作用力,且極易與水分子相互作用,從而改善并提高蛋白質的溶解度[38]。

圖7 酸棗仁蛋白與酸棗仁ACE抑制肽的溶解度Fig.7 Solubility of jujube kernel protein and ACE inhibitory peptides from jujube kernel
而酸棗仁ACE抑制肽在不同pH下溶解度均高于酸棗仁蛋白,由于酶解過程使酸棗仁蛋白空間發生改變,肽鏈斷裂,導致親水性基團暴露,極性基團數量增加,從而使得蛋白質之間的疏水作用減弱,從而蛋白質與水的相互作用加強,利于蛋白質的溶解[39]。
2.8 酸棗仁蛋白與酸棗仁ACE抑制肽的持水性和持油性的測定結果
如表7所示,酸棗仁ACE抑制肽的持水性顯著高于酸棗仁蛋白,是因為酸棗仁蛋白水解后,肽鏈被打開,暴漏出更多的親水性基團[37]。酸棗仁ACE抑制肽的持油性明顯高于酸棗仁蛋白,是因為酸棗仁ACE抑制肽比酸棗仁蛋白具有更多的非共軛鏈和疏水性物質[40?41]。

表7 酸棗仁蛋白與酸棗仁ACE抑制肽的持水性和持油性Table 7 Water retention and oil retention of jujube kernel protein and ACE inhibitory peptides
2.9 酸棗仁蛋白與酸棗仁ACE抑制肽的起泡性和起泡穩定性測定結果
由圖8、圖9可知,酸棗仁ACE抑制肽起泡性和起泡穩定性在不同pH下均顯著(P<0.05)小于酶解前的酸棗仁蛋白,這是因為蛋白質極性基團的數量和蛋白質相對分子質量是決定起泡能力的關鍵因素[41?42],酶解過程導致酸棗仁蛋白肽鏈斷裂,相對分子質量減小,分子量降低,從而不利于泡沫的形成[43]。
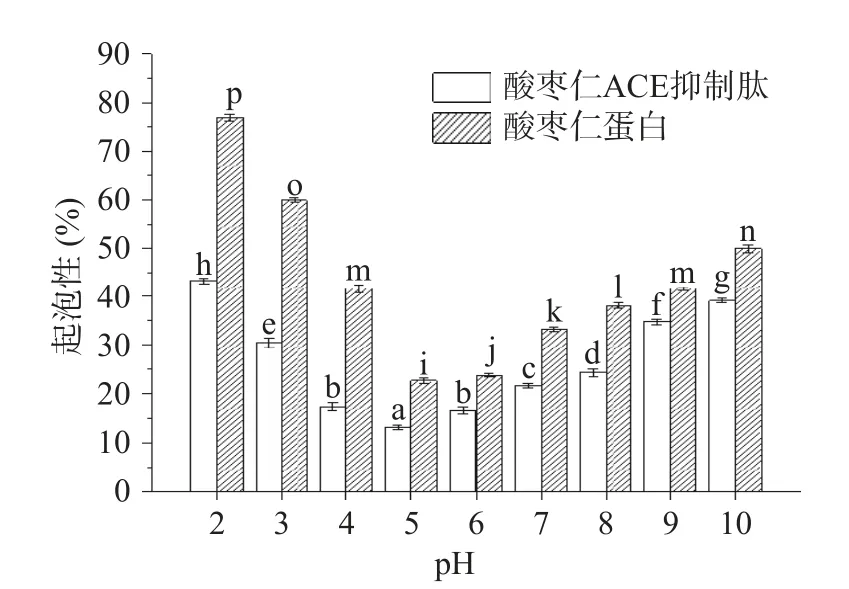
圖8 酸棗仁蛋白與酸棗仁ACE抑制肽的起泡性Fig.8 Foaming property of jujube kernel protein and ACE inhibitory peptides from jujube kernel
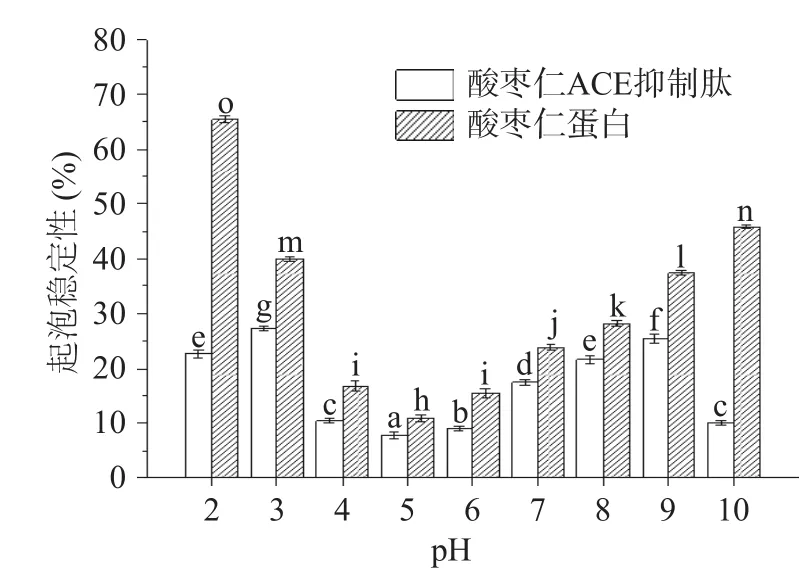
圖9 酸棗仁蛋白與酸棗仁ACE抑制肽的起泡穩定性Fig.9 Foaming stability of jujube kernel protein and ACE inhibitory peptides
2.10 酸棗仁蛋白與酸棗仁ACE抑制肽的乳化性和乳化穩定性測定結果
如圖10、圖11所示,不同pH下酸棗仁蛋白與酸棗仁ACE抑制肽的乳化能力和乳化穩定性變化。酸棗仁ACE抑制肽乳化能力顯著(P<0.05)低于酸棗仁蛋白,而乳化穩定性卻顯著高于酸棗仁蛋白(P<0.05)。相關研究表明,肽鏈上至少要有20個以上的氨基酸殘基才能有良好的乳化作用[44],酶解使酸棗仁蛋白空間結構改變,肽鍵斷裂,蛋白相對分子質量減小,分子量降低,部分氨基酸殘基缺失,不能降低界面張力,導致乳化性降低。酶解使蛋白質空間結構發生改變的同時暴露出疏水性基團和親水性基團,不同基團與油相、水相相互作用,乳化穩定性得到提高[45]。
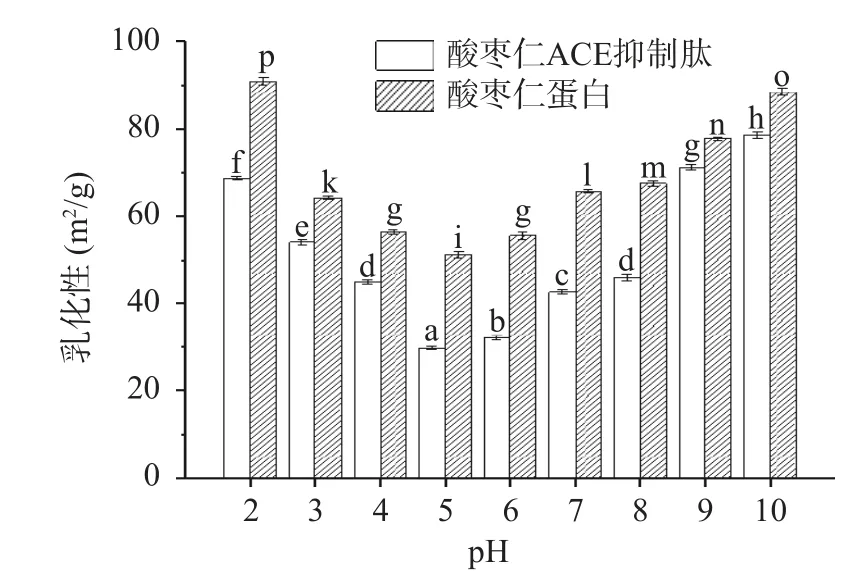
圖10 酸棗仁蛋白與酸棗仁ACE抑制肽的乳化性Fig.10 Emulsification between jujube kernel protein and ACE inhibitory peptides
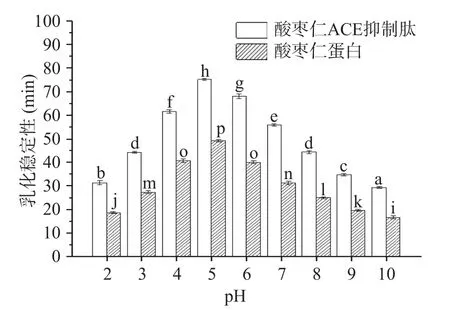
圖11 酸棗仁蛋白與酸棗仁ACE抑制肽的乳化穩定性Fig.11 Emulsification stability of jujube kernel protein and ACE inhibitory peptides
2.11 酸棗仁蛋白與酸棗仁ACE抑制肽的感官特性測定結果
酸棗仁蛋白與酸棗仁ACE抑制肽的感官特性測定結果如表8所示。酸棗仁ACE抑制肽凍干粉形態為結晶狀粉末,相較于酸棗仁蛋白的片狀粉末,顆粒更為細小,表明酶解充分。酸棗仁蛋白和酸棗仁ACE抑制肽在氣味方面都為無味,有利于實際生產應用。

表8 酸棗仁蛋白與酸棗仁ACE抑制肽感官特性結果Table 8 Sensory characteristics of jujube kernel protein and ACE inhibitory peptides from jujube kernel
3 結論
本文對脫脂酸棗仁的基本營養成分進行測定,蛋白質含量較高,脫脂過程蛋白質保存效果較好,有利于后續實驗進行。酸棗仁ACE抑制肽的氨基酸組成中必需氨基酸含量較高,占36.48%,有利于人體營養需要,疏水性氨基酸含量占51.14%,側面論證酸棗仁ACE抑制肽的有效降壓效果。酸棗仁ACE抑制肽的分子量分布主要集中在1000~3000 Da,占97.50%;粒徑分析表明酸棗仁蛋白酶解后,酸棗仁ACE抑制肽的中位粒徑(D50)明顯小于酸棗仁蛋白,且微觀結構觀察發現酶解后,酸棗仁ACE抑制肽表面呈現光滑、致密、略帶褶皺,與粒徑分析結果吻合。對比酸棗仁蛋白酶解前后理化性質,酸棗仁蛋白呈現乳白色、無味、片狀粉末,而酸棗仁ACE抑制肽呈現淺褐色、無味、結晶狀粉末。酸棗仁ACE抑制肽的溶解度、熱穩定性、持水性和持油性均有顯著提高(P<0.05);起泡性、起泡穩定性和乳化性得到改善,顯著性降低(P<0.05);乳化穩定性提高。本文從基本理化指標對酸棗仁ACE抑制肽的酶解前后進行對比分析,以期為后續的實際應用提供參考依據,同時更為廣泛的理化性質測定也有待后續試驗展開。

