LOX-1和OX-LDL水平與中重度創傷性顱腦損傷患者病情及神經功能預后的相關性*
曹清清,葛建彬
江蘇省南通市第二人民醫院藥劑科,江蘇南通 226001
創傷性顱腦損傷(TBI)是臨床上的急危重癥,病死率、致殘率高。調查顯示,美國每年約有30萬人因TBI住院治療,約43%的患者出院后遺留不同程度的神經軀體功能障礙,極大影響患者的生活質量和生命安全[1]。目前TBI嚴重程度與最終功能障礙結果之間存在較大差異,無法做到準確性預測。近年的研究結果表明,患者因血管內皮損傷所致的腦血管痙攣而加重神經功能障礙在TBI病情進展及功能預后方面起著重要作用[2-3]。導致血管內皮損傷的因素眾多,其中氧化低密度脂蛋白(OX-LDL)對血管內皮的損傷是目前業內研究的熱點。研究表明,OX-LDL通過其特異性受體氧化型低密度脂蛋白受體-1(LOX-1)誘導血管內皮細胞表達一些相關因子,介導血管內皮損傷[4]。有研究顯示,OX-LDL和LOX-1可作為蛛網膜下腔出血后的遲發性出血的生物學標志物,二者在腦血管痙攣中也發揮著重要作用[5]。本研究旨在探討OX-LDL和LOX-1與TBI患者病情嚴重程度及神經功能預后的相關性,現報道如下。
1 資料與方法
1.1一般資料 納入本院2018年9月至2020年4月收治的90例中重度TBI患者作為研究對象。納入標準:(1)符合《重型顱腦損傷救治指南第四版》[6]中的診斷標準;(2)格拉斯哥昏迷評分(GCS)為4~12分;(3)均經顱腦MRI或CT檢查證實,并行開顱去骨瓣減壓術;(4)年齡18~65歲;(5)臨床資料完整。排除標準:(1)GCS≤3分或GCS≥13分者;(2)臨床資料不完整者;(3)住院期間死亡無法獲得本研究需要的結果者。收集中重度TBI患者的性別、年齡、受傷至入院時間、基礎疾病(高血壓、糖尿病、冠心病、腦卒中)、顱腦損傷部位、入院時GCS、創傷嚴重度評分(ISS)等一般臨床資料。患者入院后完善血常規、肝腎功能、頭部MRI或CT等相關檢查,并予以糾正電解質紊亂、甘露醇降低顱內壓、急診開顱去骨瓣減壓術等處理措施。本研究獲得患者及家屬知情同意并上報本院醫學倫理委員會獲批。
1.2方法
1.2.1OX-LDL和LOX-1檢測 于入院第3天清晨空腹抽取患者靜脈血5 mL,離心后取上層血清,采用抗體酶聯免疫法檢測LOX-1和OX-LDL水平。試劑盒購自上海科瑞生物科技有限公司,嚴格按照說明書進行操作。
1.2.2神經功能評估 采用功能性獨立評定量表(FIM)[7]對患者出院后3個月時的神經功能進行評價,該量表共18項(13個運動任務和5個認知任務),每項評分1~7分,總評分18~126分,得分越高說明神經功能越好。評判標準:126分為完全獨立,80~125分為基本上獨立(或極輕度依賴或有條件的獨立),72~79分為輕度依賴,54~71分為中度依賴,36~53分為重度依賴,19~35分為極重度依賴,18分為完全依賴。并根據FIM評分的中位數將患者分為功能良好組和功能不良組。
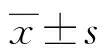
2 結 果
2.1中重度TBI患者FIM評分情況及分組后一般資料比較 90例患者均完成隨訪,出院后3個月時FIM評分為31~87分,中位數為49分,據此將患者分為功能良好組(45例)和功能不良組(45例)。2組患者一般臨床資料比較,功能良好組GCS高于功能不良組,年齡、ISS低于功能不良組,差異均有統計學意義(P<0.05),見表1。

表1 不同神經功能預后患者一般臨床資料比較

組別n合并基礎疾病(n)高血壓糖尿病冠心病腦卒中腦損傷部位(n)硬膜外出血腦實質出血硬膜下血腫單純腦裂傷ISS(x±s,分)功能良好組451197392211316.22±3.91功能不良組45101082102112218.33±2.46χ2/t0.0620.0670.0800.0001.2543.064P0.8030.7960.7771.0000.2710.003
2.2不同神經功能預后患者OX-LDL、LOX-1水平比較 功能良好組OX-LDL、LOX-1水平低于功能不良組,差異均有統計學意義(P<0.05),見表2。

表2 不同神經功能預后患者OX-LDL、LOX-1水平比較
2.3OX-LDL、LOX-1水平與ISS及FIM評分的相關性 Pearson線性相關性分析顯示,OX-LDL、LOX-1水平與ISS呈正相關(r=0.469、0.524,P<0.05),與FIM評分呈負相關(r=-0.729、-0.755,P<0.05),見圖1。

注:A、B、C、D分別表示OX-LDL、LOX-1水平與ISS,OX-LDL、LOX-1水平與FIM評分的相關性。圖1 OX-LDL、LOX-1水平與ISS及FIM評分的相關性
2.4TBI患者神經功能預后不良的多因素線性回歸分析 以FIM評分為因變量,將有統計學意義的指標作為自變量,進行多因素線性回歸分析,結果顯示,GCS低與血清OX-LDL、LXO-1水平高是TBI患者神經功能預后不良的獨立危險因素(P<0.05),見表3。

表3 影響TBI患者神經功能預后不良的多因素線性回歸分析
3 討 論
TBI后會引起腦血管痙攣,而腦血管痙攣則會延長腦缺血時間,最終導致神經功能出現嚴重的障礙。多項研究證據表明,微血管、纖溶以及凝血系統參與了腦血管痙攣后腦缺血的病理生理過程[8-9]。OX-LDL通過與LOX-1結合,增加細胞內活性氧的數量及種類,導致一氧化氮的利用率降低,并下調內皮型一氧化氮合酶起到抑制血管舒張作用,進而引起腦血管痙攣。已有研究證實,OX-LDL和LOX-1通過介導各種反應參與了動脈粥樣硬化的發病機制[10]。動物實驗表明,蛛網膜下腔出血的兔模型的腦基底動脈壁中OX-LDL和LOX-1水平升高[11]。但關于OX-LDL和LOX-1水平與TBI患者神經功能預后的關系國內鮮有報道。腦血管痙攣所致的腦缺血時間延長對于患者創傷急性期嚴重程度及神經功能預后均會產生嚴重的影響,早期識別腦血管痙攣對于指導臨床干預是有益的。
本研究結果顯示,功能良好組的患者GCS高于功能不良組(P<0.05),年齡、ISS評分、OX-LDL、LOX-1水平低于功能不良組(P<0.05);進一步對存在統計學意義的指標進行線性回歸分析顯示,GCS低與血清OX-LDL、LXO-1水平高是TBI患者神經功能預后不良的獨立危險因素(P<0.05)。GCS在臨床上常用于評估患者顱腦損傷嚴重程度,GCS越低,表示患者顱腦損傷越嚴重,患者長期存活的可能性更低;另外,許多研究表明,ISS越高以及年齡越大也是TBI患者神經功能預后不良的危險因素[12-13],但本研究并未得出此結論,考慮可能與樣本量較小有關。關于OX-LDL和LOX-1對TBI患者神經功能預后的關系方面,LOX-1可以與OX-LDL特異性結合在內皮細胞中,并在血管功能障礙中發揮關鍵作用,包括凋亡和抑制血管舒張。OX-LDL能夠引起細胞損傷,導致內皮功能障礙,引起血管內皮舒張功能減弱,收縮增強,特別是在顱腦創傷的患者中會加劇腦血管痙攣并延長痙攣時間[14]。其可能作用機制:(1)OX-LDL可增加細胞內活性氧的產生,激活細胞凋亡系統引起細胞凋亡;(2)其還可以通過上調LOX-1在血管內皮的表達來增強其自身的細胞損傷的作用[15];(3)血管內皮經過OX-LDL刺激后可以釋放出多種黏附因子、趨化因子,致使白細胞滾動、黏附,觸發炎性反應而損傷血管內皮[16]。
進一步分析血清OX-LDL、LOX-1水平與ISS及FIM評分的相關性得出,OX-LDL、LOX-1水平與ISS呈正相關,與FIM評分呈負相關,說明了二者在早期就能夠反映TBI患者病情嚴重程度,并可用于評估神經功能損傷情況;目前關于TBI腦出血后所致的血清LOX-1水平升高原因難以確定,筆者分析認為可能是由于LOX-1作為一種“清道夫”受體,主要存在于血管內皮上,顱腦損傷后所引發的機體一系列氧化應激反應導致體內活性氧增加,而由活性氧所進一步導致的OX-LDL通過與LOX-1結合而發揮作用[17],在發揮作用的過程中還會進一步介導一系列反應導致LOX-1表達增加,由此達到使自身發揮更大作用的目的。有研究表明,蛛網膜下腔出血患者中OX-LDL和LOX-1水平與患者后期遲發性出血有關[18]。
綜上所述,TBI患者病情越嚴重,其血清LOX-1、OX-LDL水平越高,且2種指標的水平變化與患者神經功能預后高度相關。但限于本研究樣本量較小,后期還需要增大樣本量,進行多中心研究來進一步論證。

