DHM抑制海馬內質網應激改善T2DM大鼠認知功能障礙
李夢偉,呂慧婕,2,王紫涵,羅金定,丁星星,何劍琴,楊絲絲,奉水東,凌宏艷
(1. 南華大學衡陽醫學院生理學教研室,湖南 衡陽 421001;2.吉首大學體育科學學院,湖南 湘西 416000; 3. 南華大學船山學院,4. 南華大學公共衛生學院社會醫學與衛生事業管理學教研室,湖南 衡陽 421001)
隨著當代經濟快速發展,糖尿病患者逐漸增長。糖尿病會累及中樞神經系統、導致認知功能損害,表現為學習記憶能力下降,從而影響人們的正常生活。研究發現,糖尿病認知功能障礙的機制可能是由于腦血管病變以及線粒體功能障礙,氧化應激等因素損害神經元[1],也有研究表明,內質網應激(endoplasmic reticulum stress,ERS)可導致海馬損傷,從而導致認知功能障礙的發生[2]。
DHM(dihydromyricetin,DHM)是一種多酚羥基二氫黃酮類化合物,研究表明DHM具有抗炎、抗氧化及對神經系統疾病保護作用[3]。又有研究發現,格列齊特聯合二氫楊梅素可使葡萄糖穩態、血脂狀況和炎癥狀態正常化,用于治療二型糖尿病[4]。Liu等[5]研究顯示,斛堿和二甲雙胍通過抑制ERS來改善衰老期小鼠的認知功能障礙。Takano等[6]發現,甲氧基黃酮(一種黃酮類化合物)具有抗氧化作用,通過抑制ERS來緩解MIN6細胞的死亡。也有研究發現,二氫楊梅素通過抑制ERS來保護肝細胞氧化損傷[7]。但DHM是否可通過抑制ERS改善2型糖尿病認知功能障礙,未見報道。因此,本研究采用高糖高脂飲食聯合低劑量STZ(30 mg·kg-1)建立2型糖尿病大鼠模型,用DHM處理,觀察DHM對T2DM大鼠認知功能障礙的影響,并探討其機制是否與抑制海馬ERS有關。
1 材料與方法
1.1 實驗動物7~8周雄性Sprague Dawley大鼠(體質量為260~280 g)由長沙市天勤生物技術有限公司提供,動物許可證號為SCXK(湘)2014-0011。動物房內12 h明暗交替,將溫度設為23 ℃~24 ℃,濕度為40%~60%,保證充足的水和鼠糧。實驗操作遵照《國家實驗動物健康與管理條例》進行。
1.2 實驗試劑牛磺熊去氧膽酸(HY-19696)和衣霉素(HY-A0098)購于MCE公司,鏈脲佐菌素(S0130)購于Sigma公司,二氫楊梅素(27200-12-0)由張家界志誠生物科技有限公司提供,GRP78抗體(GB12098)購于賽維爾公司,p-PERK(SC4332)抗體購于碧云天公司。
1.3 儀器奧林巴斯生物公司的-80 ℃超低溫冰箱(MDF-86V838),其林貝爾生物公司的高速低溫離心機(H4-20KR)、搖擺型脫色搖床(TS-1型),美國Bio-Rad公司的電泳槽/轉印槽(1703930)。
1.4 T2DM大鼠模型的建立及實驗分組116只雄性SD大鼠分籠適應性喂養1周,隨機選出56只作為正常對照組:普通飼料喂養,其余大鼠為2型糖尿病模型組(T2DM組,共60只):高糖高脂飼料喂養。4周后,空腹過夜,稱重后用三諾血糖儀測定空腹血糖。隨后分別一次性腹腔注射無菌檸檬酸鹽緩沖液(30 mg·kg-1)或低劑量STZ(30 mg·kg-1),接著普通飼料或高糖高脂飼料喂養,4周后,大鼠進行空腹血糖和血清胰島素(Elisa方法)檢測,當空腹血糖>16.7 mmol·L-1時則2型糖尿病大鼠模型建立成功(造模過程中死亡2只,失敗2只)。隨后2組大鼠分別用雙蒸水(1次/天,灌胃)或用DHM處理(250 mg·kg-1·d-1,灌胃)12周。12周后,每組隨機選取8只進行水迷宮和Y迷宮檢測。各組剩余大鼠進行側腦室置管給藥,實驗分組如下:
1.4.1觀察ERS是否參與T2DM大鼠認知功能障礙 Control組和T2DM組大鼠分別在行為學檢測前3 d側腦室置管注射與ERS拮抗劑牛磺熊去氧膽酸(tauroursodeoxycholic acid,TUDCA,10 μg·d-1)等體積的生理鹽水或TUDCA,每天1次,連續3 d,因此實驗分為4組:Control組、T2DM組、Control+TUDCA組和T2DM+TUDCA組(n=8)。
1.4.2觀察DHM對T2DM認知功能改善作用是否與ERS有關 Control組、T2DM+DHM組大鼠分別在行為學檢測前1天通過側腦室置管注射與ERS激活劑衣霉素(tunicamycin,TUN,10 μL)等體積的生理鹽水或TUN,T2DM組于同一時間注射與TUN等體積的生理鹽水,Control+DHM組注射TUN(10 μL)。因此實驗分為6組:Control組、T2DM組、T2DM+DHM組、Control+TUN組、Control+DHM+TUN組、T2DM+DHM+TUN組(n=8)。
1.5 血糖測量大鼠禁食過夜,12 h后采血針刺破大鼠尾部流出靜脈血,用三諾血糖測試儀測量空腹血糖。
1.6 血清胰島素測量取大鼠尾巴靜脈血,在 13 000 r·min-1離心30 min后取血清,用大鼠胰島素Elise試劑盒進行血清胰島素水平的檢測。
1.7 行為學實驗Y迷宮實驗:Y迷宮有三個等長互為120°的臂,將大鼠放入一個臂末端,在3個臂中自由活動5 min,錄像記錄5 min內每只大鼠的入臂穿梭總次數。交替數為進入Y迷宮3個臂為1次,Y迷宮的統計值是自發交替率,其計算公式為:交替率/%=[(交替數)/(入臂總次數-2)]×100。
水迷宮實驗:本實驗將一個圓形水池等分為4個扇形象限,水溫控制在22 ℃左右,水中加入二氧化鈦,攪拌使水不透明呈乳白色,將一個平臺放在第一象限中央,其頂部距離水面1 cm。d 1~5是獲得性訓練期,每天同一時間將大鼠放入水中,記錄大鼠到達平臺的時間,即為潛伏期。若大鼠潛伏期超過120 s,則人為引導大鼠找到平臺并在平臺滯留20 s。連續訓練5 d,每次訓練結束后用干毛巾將大鼠擦干,放回原飼養鼠盒內。D 6是空間探索實驗:撤離平臺,讓每只大鼠放入后自由游泳120 s,攝像記錄大鼠經過平臺的次數以及運動軌跡。
1.8 側腦室置管給藥大鼠用水合氯醛腹腔注射麻醉后,固定在腦立體定位儀,在左側腦室(以正中線與兩耳連線的交點為起點,向后移動0.8 mm,向左移動1.5 mm)插入注射管(插入深度為2.5 mm)并固定在大鼠顱骨上,把藥物從注射管中注射到左側腦室。
1.9 Western blot檢測大鼠海馬內質網應激相關蛋白GRP78、p-PERK的表達取各組大鼠海馬組織30 μg蛋白進行電泳、轉膜、封閉后加入抗GRP78、p-PERK抗體,4 ℃搖床過夜后洗滌再加入二抗,接著加入ECL化學發光試劑(1 ∶1)進行反應。曝光后進行掃描,用圖像分析軟件進行分析。
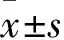
2 結果
2.1 成功建立T2DM大鼠模型如Fig 1:T2DM組大鼠血糖>16.7 mmol·L-1,Elisa結果顯示:T2DM組血清胰島素明顯高于Control組大鼠,說明T2DM大鼠模型成功。

Fig 1 Blood glucose and insulin levels in control and T2DM rats n=56)
2.2 DHM改善T2DM大鼠認知功能障礙Y迷宮實驗結果顯示:與對照組相比,T2DM組大鼠自發交替率明顯減少;而DHM明顯增加了大鼠的自發交替率(Fig 2A);各組大鼠自發運動無明顯差異(Fig 2B),提示:DHM可改善T2DM大鼠學習記憶障礙。Fig 3A顯示d 1和d 5各組大鼠的游泳軌跡。與T2DM組相比,T2DM+DHM組大鼠逃避潛伏期減少,停留的時間百分比以及穿過目標象限的次數明顯增加(Fig 3B-D);提示二氫楊梅素可改善T2DM大鼠空間記憶能力。此外,各組大鼠逃避潛伏期和游泳速度沒有差異(Fig 3E,F)。綜上所述,DHM可改善T2DM大鼠認知功能障礙。
2.3 ERS參與了T2DM大鼠認知功能障礙Y迷宮實驗:與Control組相比,T2DM大鼠自發交替率減少,而T2DM+TUDCA組自發交替率明顯增加(Fig 4A);各組大鼠入臂總次數不變(Fig 4B)。表明:TUDCA能夠改善T2DM大鼠學習記憶障礙。Fig 5A顯示d 1和d 5尋各組大鼠游泳軌跡。與T2DM組相比,T2DM+TUDCA組大鼠逃避潛伏期明顯減少,停留時間的百分比和穿過目標象限的次數顯著增加(Fig 5B-D);提示TUDCA可改善T2DM大鼠空間記憶能力。各組大鼠逃避潛伏期和游泳速度無差異(Fig 5E,F)。Western blot結果顯示:T2DM+TUDCA組大鼠海馬GRP78和p-PERK蛋白的表達明顯低于T2DM組(Fig 6),提示TUDCA能夠抑制ERS蛋白的表達。綜上證實:TUDCA可改善T2DM大鼠認知功能障礙,即抑制海馬ERS能夠改善T2DM大鼠認知功能障礙。

Fig 2 Comparison of behavioral indexes of Y maze in each group of rats n=8)

Fig 3 Comparison of behavioral indexes of Morris water maze in each group of n=8)

Fig 4 Comparison of behavioral indexes of Y maze in each group of rats n=8)
2.4 DHM改善T2DM大鼠認知功能障礙的機制:抑制海馬ERS為進一步探討DHM改善T2DM大鼠認知功能障礙的機制,我們使用ERS激動劑(TUN)處理,Y迷宮結果顯示:與T2DM組相比,T2DM+DHM組大鼠自發交替率明顯增加,而與T2DM+DHM組相比,T2DM+DHM+TUN組大鼠自發交替率明顯減少(Fig 7A);各組入臂總次數相同(Fig 7B),提示:激活海馬ERS降低DHM對T2DM大鼠學習記憶障礙的改善作用。Fig 8A顯示d 1和d 5各組大鼠游泳軌跡。與T2DM+DHM組相比,T2DM+DHM+TUN組大鼠潛伏期明顯增加, 停留時間的百分比和穿過目標象限的次數減少(Figure8B-D);提示:激活海馬ERS可降低DHM改善T2DM大鼠的空間記憶能力。此外各組大鼠逃避潛伏期和游泳速度均沒有差異(Fig 8E、F)。Western blot結果顯示:T2DM+DHM+TUN組大鼠海馬GRP78和p-PERK蛋白表達增加更高于T2DM+DHM組(Fig 9),說明TUN能夠增強T2DM海馬內質網應激相關蛋白的表達,即TUN可以促進ERS的發生。上述結果證實:激活ERS能夠逆轉DHM對T2DM大鼠認知功能障礙的改善作用。
3 討論
糖尿病是一種常見疾病,目前,糖尿病患病率和發病率急劇增加,糖尿病患者中90%以上是2型糖尿病(Type 2 Diabetes,T2DM),T2DM會導致多種并發癥,如心臟病、腦血管等疾病,糖尿病中后期常伴有周圍神經病變、大血管病變等嚴重并發癥。有研究表明,糖尿病患認知功能障礙的風險相對正常人增加超過20%[8],糖尿病并發認知功能障礙(diabetic cognitive impairment,DCI)引起人們廣泛關注,雖然DCI的發病機制尚不清楚,但已證實海馬神經元活動異常、氧化應激和星形膠質細胞損傷是DIC的潛在原因[9],但目前臨床上對于DCI的治療還沒有特定的藥物。
二氫楊梅素(DHM)是從香葉安眠草莖和葉中提取的類黃酮化合物的主要活性成分,具有抗腫瘤、抗氧化和清除自由基的能力[10]。我們前期研究證實DHM能夠改善高糖誘導的PC12細胞凋亡[11],表明DHM對神經元的損傷具有有效的保護作用。本實驗利用STZ聯合高糖高脂誘導2型糖尿病(T2DM)大鼠模型,接著用DHM處理,結果發現:DHM可改善T2DM大鼠認知功能障礙,隨后我們進一步探討其機制。

Fig 5 Comparison of behavioral indexes of Morris water maze in each group of rats n=8)

Fig 6 The protein expression of Bip and p-PERK in each group of rats n=5)

Fig 7 Comparison of behavioral indexes of Y maze in each group of rats n=8)

Fig 8 Comparison of behavioral indexes of Morris water maze in each group of rats n=8)

Fig 9 The protein expression of Bip and p-PERK in each group of rats n=5)
內質網應激(ERS)是細胞為應對內質網腔內錯誤折疊與未折疊蛋白聚集等狀況,從而激活未折疊蛋白反應、內質網超負荷反應等信號途徑的反應過程。ERS被認為是多種慢性神經疾病的致病因素,在神經退行性疾病、腦缺血和糖尿病神經病變等神經疾病中有著重要的作用[12]。研究表明,ERS途徑參與糖尿病誘導的神經元凋亡,并促進認知功能損傷[13],并且ERS通路的持續激活會導致神經變性和認知功能障礙[14];相關研究發現,抑制ERS誘導的炎癥反應,可保護高糖誘導的海馬神經元損傷,進而提高大鼠的學習記憶能力[15]。Ye等[16]實驗研究發現,天麻素通過抑制ERS和NLRP3炎癥小體激活改善糖尿病大鼠認知功能障礙;又有研究發現,楊梅素對Caco-2細胞具有保護作用,其保護作用可能與減少ERS,降低caspase-3的裂解有關[17]。我們前期研究發現,二氫楊梅素可能通過抑制氧化應激和增強腦源性神經營養因子的表達,改善2型糖尿病小鼠認知功能障礙[18]。 因此,我們猜測DHM是否可通過抑制海馬ERS來改善T2DM大鼠認知功能障礙?本實驗結果首先觀察到抑制ERS可改善2型糖尿病認知功能障礙,然后使用ERS激動劑作用于DHM處理的T2DM大鼠,結果發現激活ERS可降低DHM對2型糖尿病認知功能障礙的保護作用,提示:DHM可能通過抑制ERS改善T2DM大鼠認知功能障礙。
綜上所述,本實驗結果表明DHM改善T2DM大鼠認知功能障礙,其機制可能與抑制ERS有關,該研究為糖尿病認知功能障礙的發病機制及防治提供有價值的思路及實驗基礎。

