川西北高原牦牛和藏豬源大腸桿菌生物被膜表型、耐藥基因、整合酶基因和毒力基因檢測
陳朝喜,李宇涵,譚敏,汪露,黃志宏
西南民族大學畜牧獸醫學院,成都 610041
0 引言
1 材料與方法
1.1 材料
1.1.1 樣本采集和標準菌株 417份牦牛和藏豬新鮮糞便和胃內容物樣本于2017年10月至2018年8月間無菌采自四川省川西北高原地區阿壩州和甘孜州部分養殖場或屠宰場(其中牦牛糞便和胃腸道內容物樣本263份,藏豬糞便樣本154份);大腸桿菌標準株 ATCC25922由西南民族大學獸醫藥理學實驗室保存并提供。
1.1.2 培養基、抗菌藥物和分子生物學試劑 麥康凱瓊脂(MacConkey agar)、胰蛋白胨大豆肉湯(TSB,Trypticase soy broth)、LB肉湯(Luria-Bertani broth)購自青島海博生物技術有限責任公司;MH肉湯(Mueller-Hinton broth)購自北京奧博星生物技術有限公司;15e腸桿菌科細菌生化編碼鑒定管購自杭州天和微生物試劑有限公司;阿米卡星(AMK)、慶大霉素(GEN)、卡那霉素(KAN)、大觀霉素(SPT)、鏈霉素(STR)、妥布霉素(TOB)、氨芐西林(AMP)、氯霉素(CHL)、氟苯尼考(FLR)、環丙沙星(CIP)、沙拉沙星(SAR)、達氟沙星(DAN)、恩諾沙星(ENR)、左氧氟沙星 (LVX)、萘啶酸(NAL)、土霉素(OXY)、多西環素(DOX)、多黏菌素 B(POL)、利福平(RIF)、磺胺甲噁唑 (SMX)、磺胺二甲嘧啶(SM2)、頭孢曲松(CRO)、頭孢唑啉(CZO)和頭孢噻呋(TIO)等抗菌藥物購自上海源葉生物科技有限公司和阿拉丁試劑(上海)有限公司;2×Taq Master Mix購自南京諾唯贊生物科技有限公司;DL2000 DNA marker購自天根生化科技(北京)有限公司;PCR擴增引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 牦牛和藏豬源大腸桿菌分離和鑒定 將無菌采集的新鮮糞便和胃腸道內容物樣本置于提前準備好的LB肉湯中,37℃培養12—18 h,劃線接種于麥康凱瓊脂平板,37℃培養12—16 h,選取粉紅色、表面光滑、大小適中的疑似菌落進行連續傳代培養;對純化三代的疑似大腸桿菌菌落進行革蘭氏染色,并按照15e腸桿菌科細菌生化編碼鑒定管說明書操作步驟進行生化鑒定。
1.2.2 藥物敏感性試驗 以大腸桿菌標準株ATCC25922作為質控菌株,抗菌藥物配制、藥物敏感性試驗操作步驟及其結果判定均參考CLSI(美國臨床實驗室標準化協會,Clinical and Laboratory Standards Institute)標準進行(2013版)。采用微量肉湯稀釋法對分離鑒定的大腸桿菌進行 24種抗菌藥物敏感性試驗,以抑制細菌生長的最低藥物濃度作為測試藥物的最小抑菌濃度(MIC,minimum inhibitory concentration),每種抗菌藥物重復3次。
1.2.3 生物被膜形成能力試驗 參照STEPANOVI?的改良半定量結晶紫染色法并略作改進[17],對分離鑒定的大腸桿菌進行生物被膜形成能力鑒定。生物被膜形成能力判定標準如下:OD570>4 ODc為強成膜能力,2 ODc<OD570≤ 4 ODc為中等成膜能力,ODc<OD570≤ 2 ODc為弱成膜能力,OD570≤ODc為無成膜能力。
1.2.4 耐藥基因、整合酶基因和毒力基因檢測 根據參考文獻和NCBI數據庫基因序列設計耐藥基因、整合酶基因和毒力基因擴增引物序列(表1和表2),采用水煮法提取大腸桿菌總DNA。耐藥基因、整合酶基因和毒力基因 PCR擴增體系均為 10 μL:2×Taq Master Mix 5 μL,上游引物(F)、下游引物(R)各0.5 μL,DNA 模板 1 μL,ddH2O 3 μL。PCR 擴增程序為:94℃預變性5 min,94℃變性30 s,以相應退火溫度退火30—50 s,72℃延伸30 s至1 min,共35個循環,后72℃再延伸10 min,最后4℃保存。各基因擴增過程中對引物用量和雙蒸水用量進行調整,體系總體積不變,退火時間和延伸時間根據目的基因預期片段大小稍作調整。
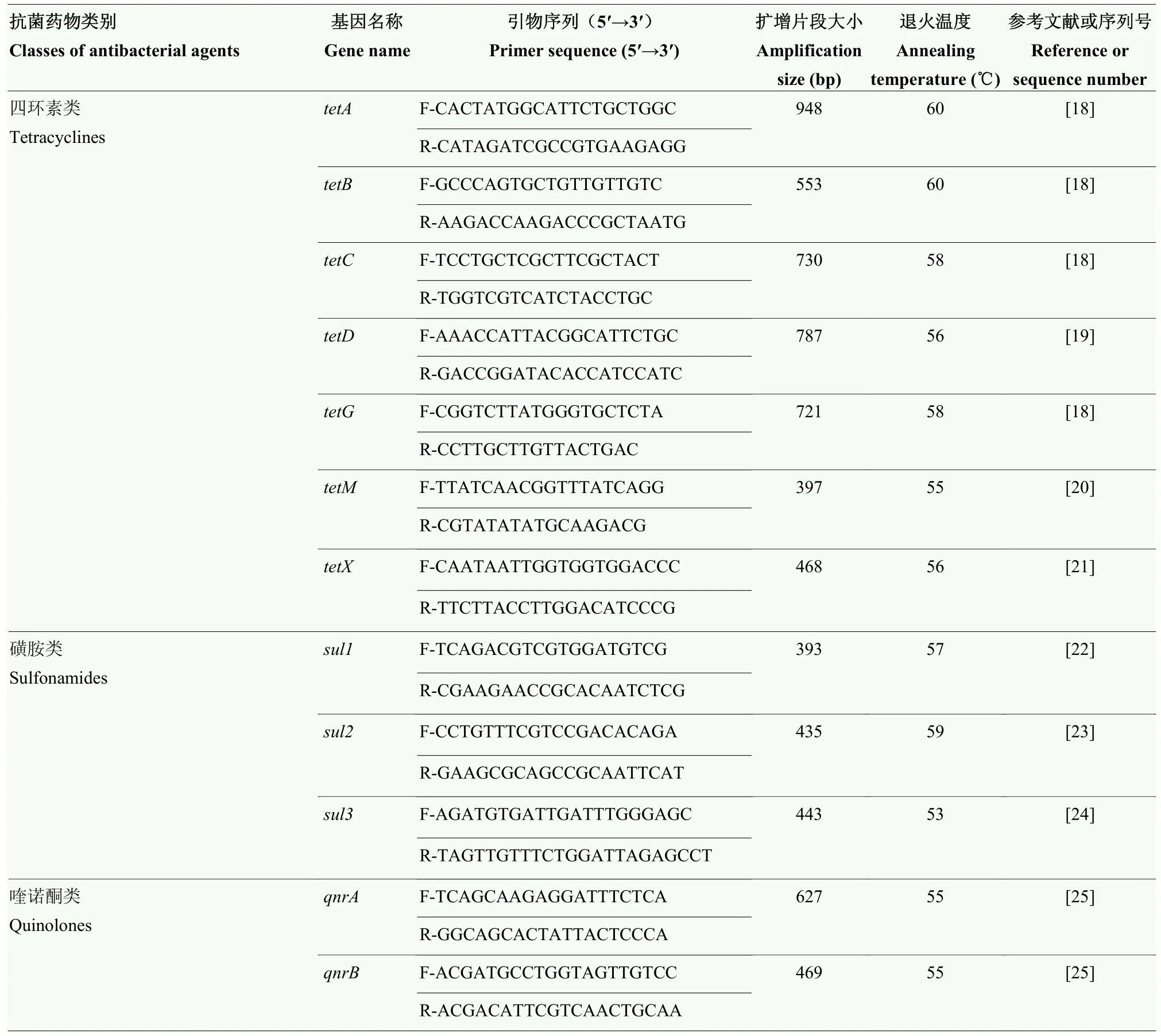
表1 耐藥基因和整合酶基因擴增引物信息Table 1 Information of PCR primers for ARGs and integrase genes amplification

表2 毒力基因擴增引物信息Table 2 Information of PCR primers for virluence genes amplification
1.2.5 遺傳譜系分型 參照 CLERMONT等[30]采用多重PCR方法進行chuA、yjaA和TspE4.C2擴增,以chuA、yjaA和TspE4.C2的不同組合作為大腸桿菌遺傳譜系分型的判定依據。
3) 如果港口貨運收益是投資收益的一部分,則根據式(2)和式(3)可知:投資主體的收益函數既是自身投資額的函數,又是其競爭者投資的函數。各投資者會對其競爭者的投資做出反應,即針對競爭者的每次投資都制定對應的投資優化策略。
1.2.6 數據處理 藥物敏感性試驗數據利用WHONET 5.6處理分析,相關性分析等利用SPSS 18.0處理分析。
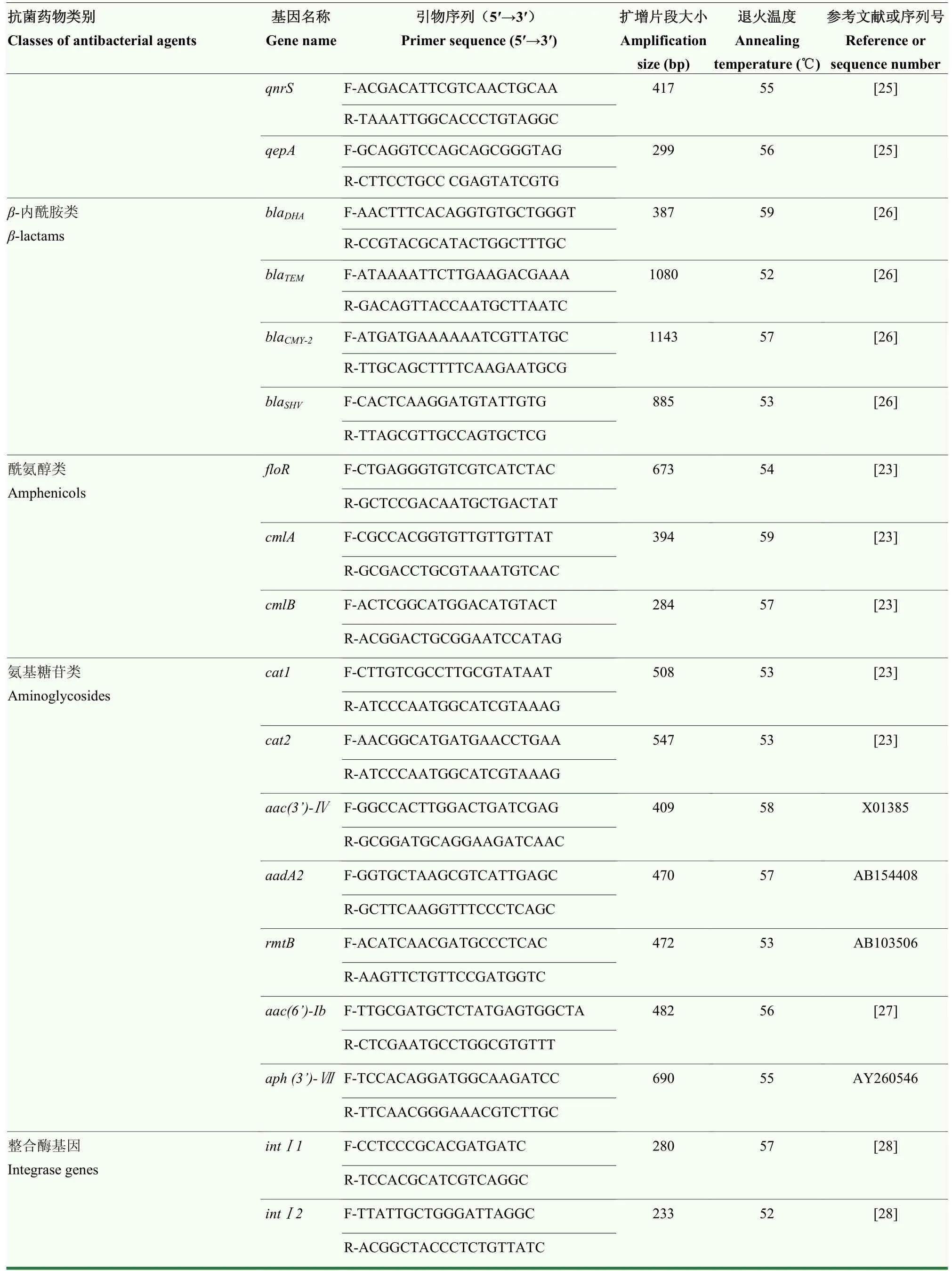
續表1 Continued table 1
2 結果
2.1 大腸桿菌分離鑒定
對417份樣本中分離的疑似大腸桿菌進行革蘭氏染色和生化鑒定,共分離鑒定大腸桿菌329株,分離率為78.9%(329/417),其中牦牛源和藏豬源大腸桿菌的分離率分別為 78.33%(206/263)和 79.87%(123/ 154)。
2.2 生物被膜表型分析
329株大腸桿菌生物被膜形成能力表型分析結果如圖1所示。大多數菌株表現出弱或無生物被膜形成能力表型,強、中、弱、無成膜能力大腸桿菌分別占0.61%(2/329)、4.56%(15/329)、54.7%(180/329)和 40.12%(132/329),牦牛和藏豬源大腸桿菌各 1株為強生物被膜表型。206株牦牛源大腸桿菌中,強、中、弱、無成膜能力菌株分別占0.49%(1/206)、5.34%(11/206)、56.31%(116/206)和37.86%(78/206);123株藏豬源大腸桿菌中,強、中、弱、無成膜能力菌株分別占0.81%(1/123)、3.25%(4/123)、52.03%(64/123)和43.9%(54/123)。
2.3 耐藥基因、整合酶基因和毒力基因檢測與分析
329株大腸桿菌對卡那霉素、阿米卡星、壯觀霉素以外的抗菌藥物均表現出不同程度地耐藥性,其中磺胺二甲嘧啶、磺胺甲噁唑 、鏈霉素、氯霉素、土霉素、利福平和氨芐西林等耐藥較為嚴重,其耐藥率分別為100.0%、100.0%、100.0%、97.0%、57.1%、56.5%和35.9%(表3);牦牛和藏豬源大腸桿菌對24種抗菌藥物的耐藥趨勢基本一致,藏豬源大腸桿菌耐藥水平略高于牦牛源大腸桿菌的原因可能與菌株數量有關。
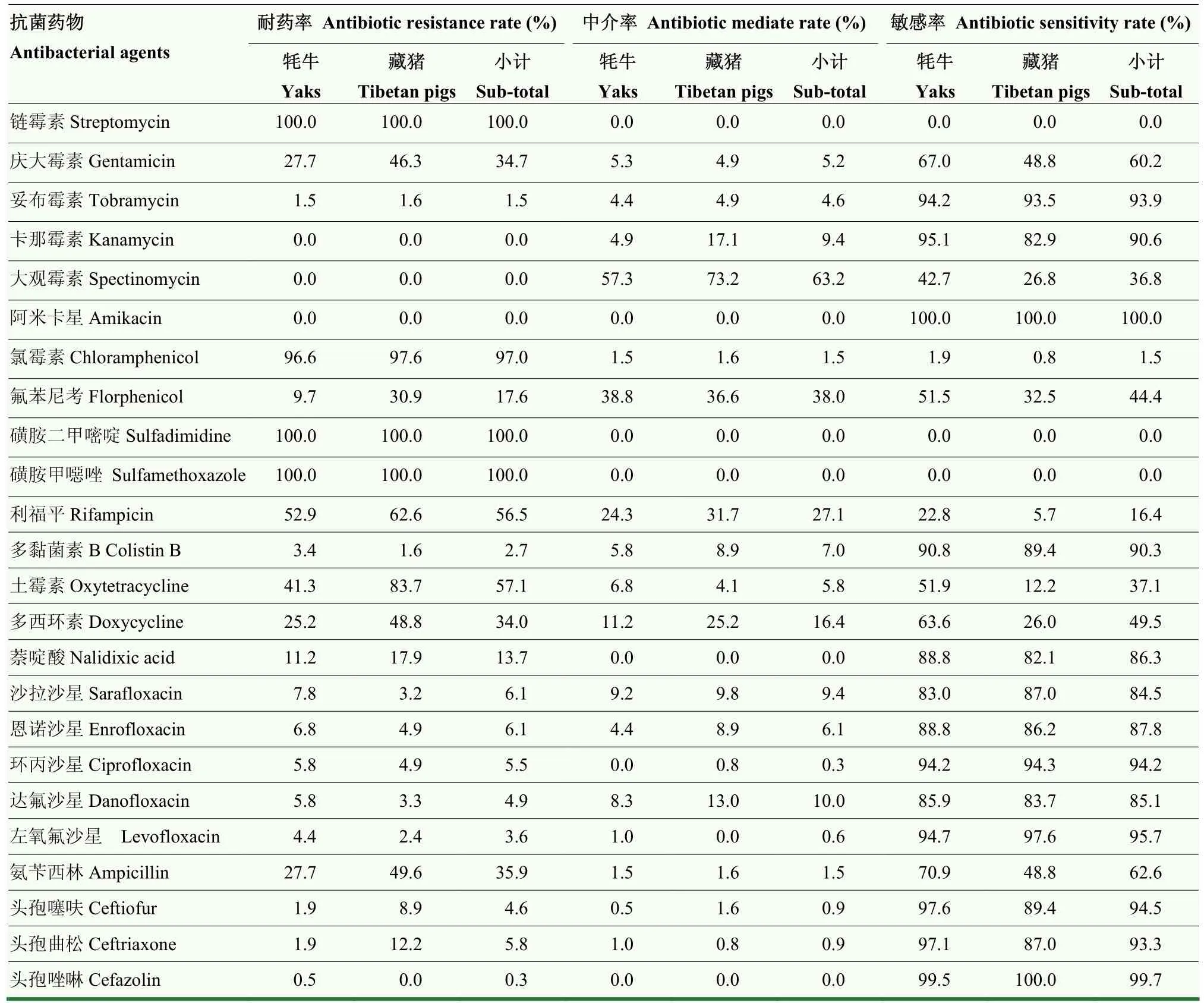
表3 329株大腸桿菌對24種抗菌藥物的藥物敏感性試驗Table 3 Antibacterial sensitivity testing of 329 E.coli to 24 antibacterial agents
耐藥譜型分析結果表明,329株大腸桿菌共存在117種不同的耐藥譜型,且耐藥譜型分布較為分散,58.97%(194/329)的菌株表現為多重耐藥,最多對18種抗菌藥物耐藥(表4)。其中,耐7種以上抗菌藥物的菌株占80.55%(265/329),優勢耐藥譜型為 CHL/DOX/OXY/RIF/SMX/SM2/STR,占 3.34%(11/329);耐8種以上抗菌藥物的菌株中,牦牛和藏豬源大腸桿菌分別占各自來源的 36.89%(76/206)和60.98%(75/123),優勢耐藥譜型為AMP/CHL/GEN/OXY/RIF/ SMX/SM2/STR,占2.13%(7/329)。

表4 329株大腸桿菌耐藥譜型匯總Table 4 Summary of antibacterial susceptibility profiles of 329 E.coli
除 cat1、cat2、blaCMY-2、blaSHV、tetC、tetG、tetX外,329株大腸桿菌均檢測到其它21個耐藥基因,其中以aac(6′)-Ib最為流行,其次為sul1和floR,其檢出率分別為 35.26%(116/329)、33.13%(109/329)和 34.65%(114/329)。耐藥表型與耐藥基因型相關性分析表明,牦牛源大腸桿菌對酰胺醇類和氨基糖苷類耐藥表型與攜帶的耐藥基因型均相關(P<0.05),對β-內酰胺類耐藥表型與blaTEM和blaDHA顯著相關(P<0.01);藏豬源大腸桿菌對四環素類、酰胺醇類和氨基糖苷類耐藥表型與攜帶的耐藥基因型均相關(P<0.05),對喹諾酮類耐藥表型與 qnrA相關(P<0.05)。
整合酶基因檢測結果表明,31.61%(104/329)的大腸桿菌攜帶至少一種整合酶基因,int1Ⅰ和 int2Ⅰ的檢出率分別為30.09%(99/329)和4.56%(15/329),其中10株大腸桿菌(牦牛源2株,藏豬源8株)同時檢測到int1Ⅰ和int2Ⅰ(圖2)。牦牛源大腸桿菌int1Ⅰ和intⅠ2的檢出率均低于藏豬源大腸桿菌,牦牛源大腸桿菌int1Ⅰ和int2Ⅰ的檢出率分別為18.93%(39/206)和3.4%(7/206),藏豬源大腸桿菌int1Ⅰ和int2Ⅰ的檢出率分別為48.78%(60/123)和6.5%(8/123)。
整合酶基因陽性菌株的耐藥基因攜帶情況如表 5所示。同時攜帶整合酶基因菌株的四環素類耐藥基因tetA檢出率高于未攜帶整合酶基因的大腸桿菌;sul1、aadA2、aph(3’)-Ⅶ、aac(3’)-Ⅳ和 tetD 等 5 個耐藥基因與整合酶基因具有相關性(P<0.05),與 rmtB、aac(6’)-Ib、tetB、tetM、cmlB、blaDHA7個耐藥基因顯著相關(P<0.01),12個耐藥基因屬于磺胺類、氨基糖苷類、四環素類和β-內酰胺類。
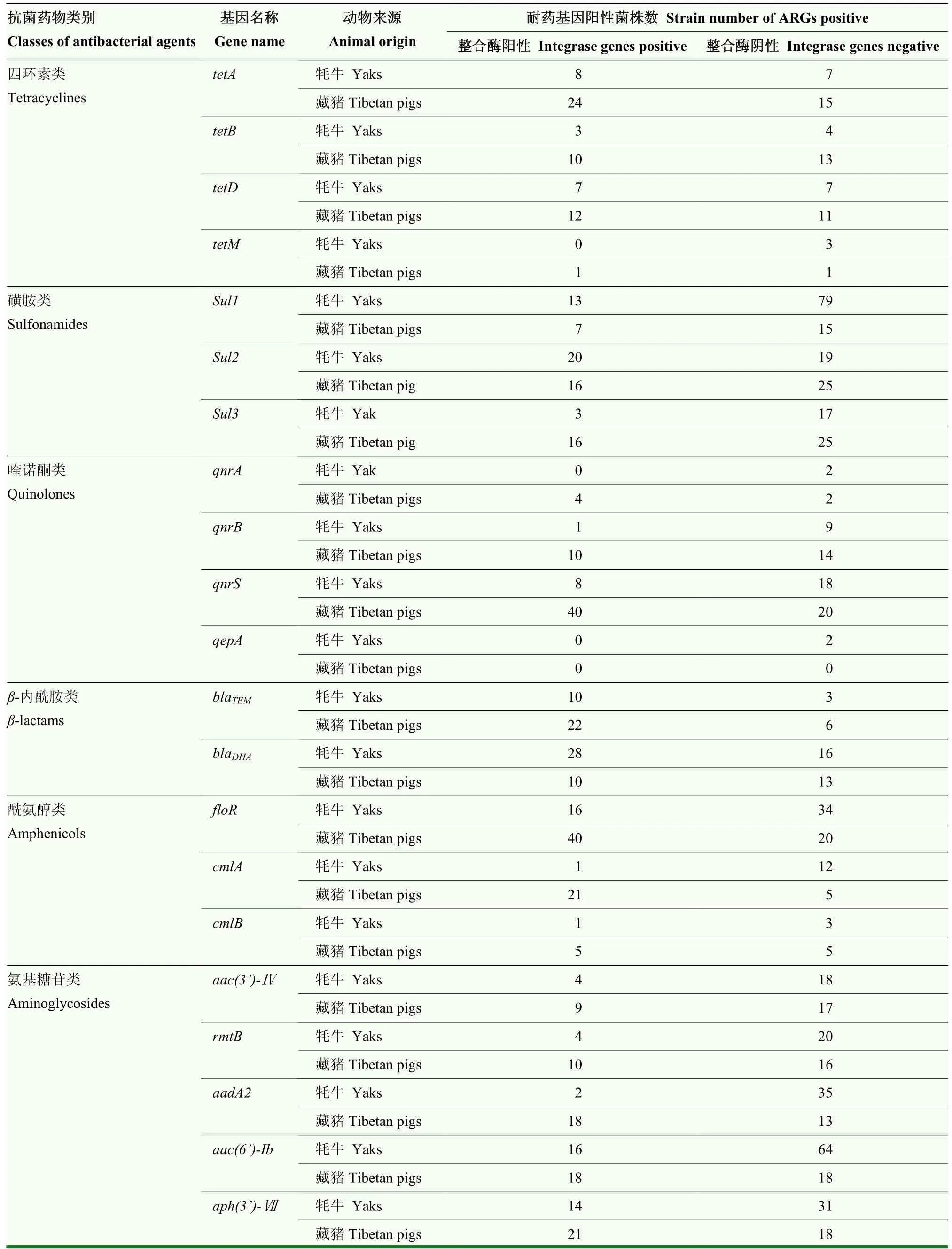
表5 整合酶基因陽性菌株的耐藥基因攜帶情況信息表Table 5 ARGs carriage information of integrase genes positive E.coli strains

續表4 Continued table 4
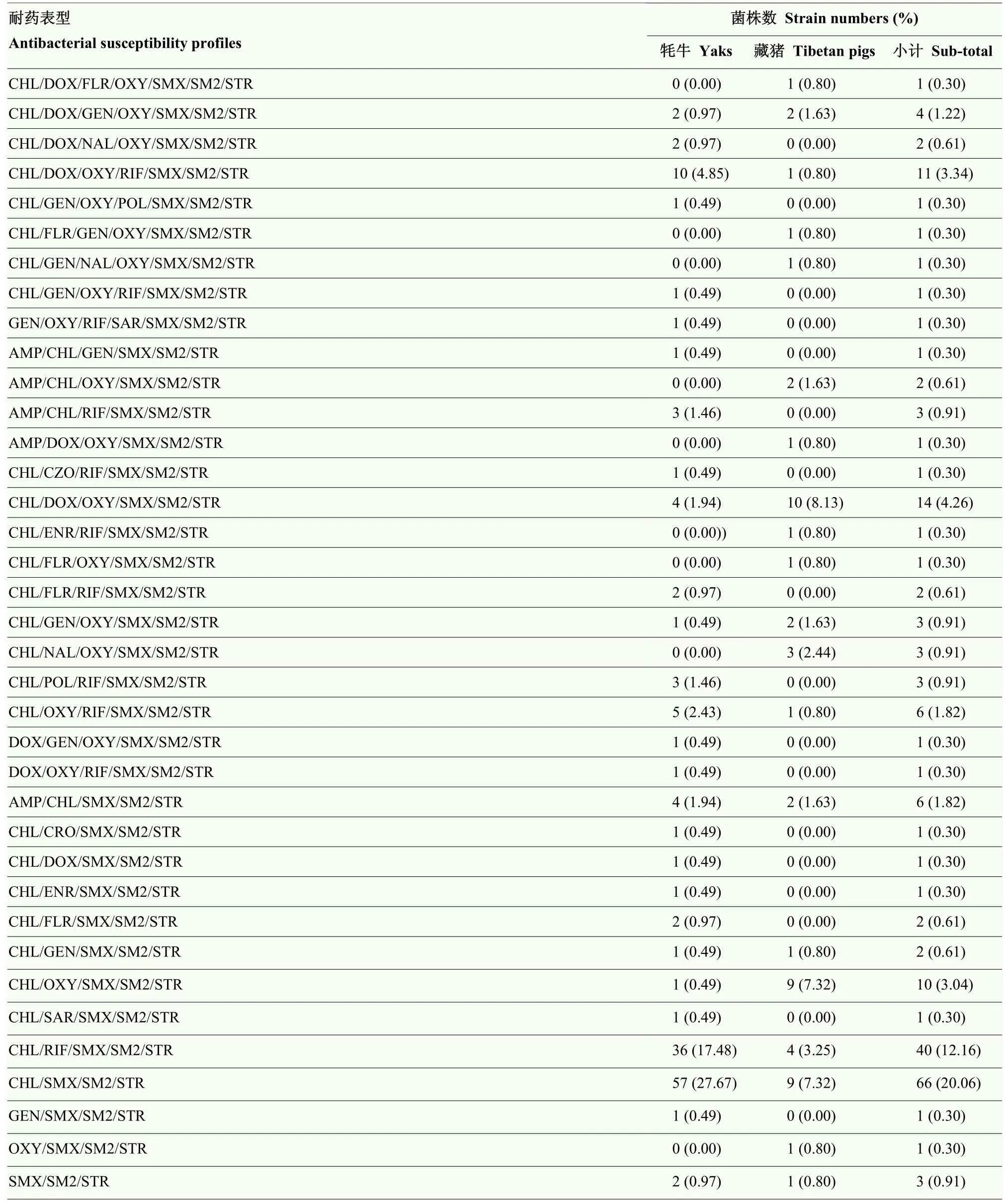
續表4 Continued table 4
毒力基因檢測結果表明,除 stx1、stx2、ehxA、bcsB、hlyA和hlyE外,其余9個毒力基因均有陽性檢出(圖3),其中以fimC陽性率最高,bcsA陽性率最低。agn43、bcsA、fyuA、irp2、sitA、fimC、LT、ompT、eaeA 的陽性率分別為53.5%(176/329)、4.26%(14/329)、6.08%(20/329)、7.29%(24/329)、45.59%(150/329)、75.68%(249/329)、12.16%(40/329)、35.26%(116/329)、32.52%(107/329)。牦牛源大腸桿菌agn43、bcsA、fyuA、irp2、sitA、fimC、LT、ompT、eaeA 的陽性率分別為 66.99%(138/206)、2.91%(6/206)、7.28%(15/206)、7.28%(15/206)、41.26%(85/206)、85.44%(176/206)、8.25%(17/206)、43.2%(89/206)和30.58%(63/206);藏豬源大腸桿菌 agn43、bcsA、fyuA、irp2、sitA、fimC、LT、ompT、eaeA 的陽性率分別為 30.89%(38/123)、6.5%(8/123)、4.07%(5/123)、7.32%(9/123)、52.85%(65/123)、59.35%(73/123)、18.7%(23/123)、21.95 %(27/123)和35.77%(44/123)。
329株大腸桿菌中,共有38種不同毒力譜型(表6,agn43與bcsA不具有直接致病性,毒力譜型和遺傳譜系分型分析時不計算在內),285株大腸桿菌至少攜帶其余7個毒力基因中的1個,其中最多攜帶6個毒力基因;攜帶 3個以上毒力基因的牦牛和藏豬源大腸桿菌占各自來源的 30.1%(62/206)和 50.0%(62/123),優勢毒力譜型為 fimC/ompT/sitA和eaeA/fimC/ompT/sitA,分別占8.25%(17/206)和8.94%(11/123)。
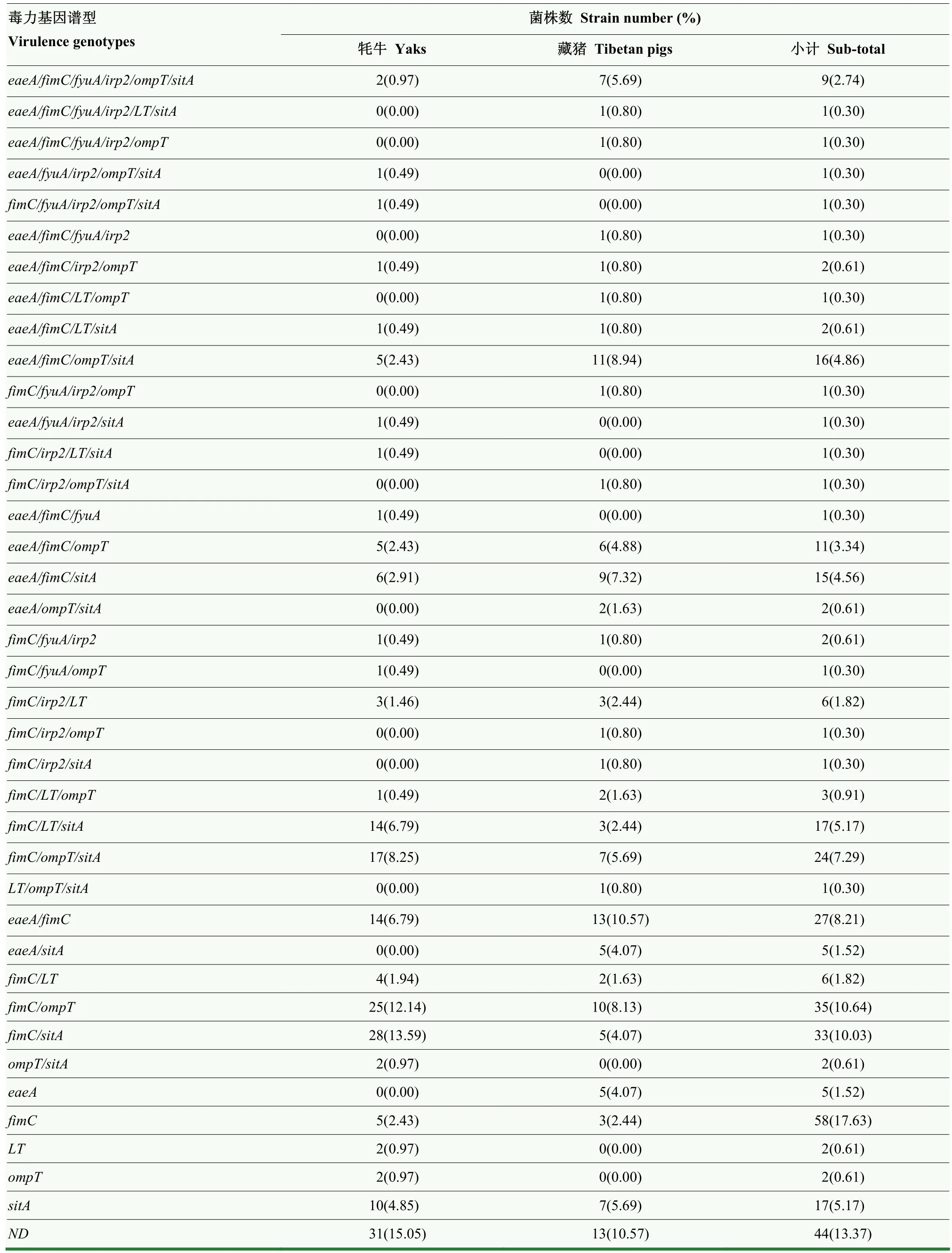
表6 329株大腸桿菌毒力基因譜型Table 6 Virulence genotypes of 329 E.coli
2.4 耐藥基因和毒力基因與遺傳譜系分型相關性分析
遺傳譜系分型結果如圖4和表7所示:329株大腸桿菌遺傳譜系以A型為主,共163株,占49.54%(163/329),其余依次為B1型、B2型和D型,分別占 39.21%(129/329)、6.08%(20/329)和 5.18%(17/329)。其中,牦牛源大腸桿菌遺傳譜系以 B1型為主,共103株,占50.0%(103/206),其余依次為A型、B2型和D型,分別占35.92% (74/206)、8.25%(17/206)和5.82%(12/206)。藏豬源大腸桿菌以A型為主,共89株,占72.36% (89/123),其余依次為 B1型、D型和 B2型,分別占 21.14%(26/123)、4.07%(5/123)和2.44%(3/123)。
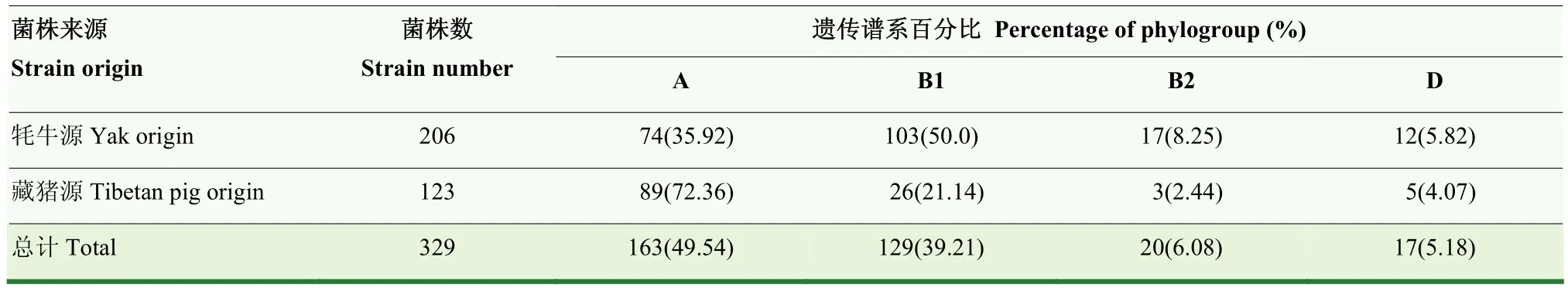
表7 329株大腸桿菌的遺傳譜系分型分析Table 7 Phylogenetic analyses of 329 E.coli
329株大腸桿菌的耐藥基因和毒力基因與遺傳譜系分型相關性熱圖分析結果顯示:A型和B1型分布的耐藥基因種類較B2型和D型豐富;A型中sul3、qnrS、tetM耐藥基因分布最廣,而qnrA和tetD分布較少;B1型中sul1和aac(6′)-Ib分布最廣,不存在tetM和 qnrA(圖5-a)。毒力基因主要分布于 A型和 B1型,且B1型略高于A型,其中,fimC、sitA和ompT基因主要分布于A型和B1型,eaeA、fyuA和irp2的主要分布于B1型,LT基因主要分布于A型,僅1株分布于D型(圖5-b)。
3 討論
3.1 牦牛和藏豬源大腸桿菌耐藥現狀及其用藥情況分析
大腸桿菌血清型復雜和毒力多樣的特點加上青藏高原地區牦牛和藏豬多采取自由放養方式等原因,由此引發的大腸桿菌病在影響動物健康的同時對牧民的生活和健康造成一定的影響。隨著抗菌藥物在牦牛和藏豬細菌性疾病治療中的不斷應用和推廣,大腸桿菌在川西北高原已呈現一定的耐藥性。藥物敏感性試驗結果表明,分離菌株均表現出不同程度的耐藥性,藏豬源大腸桿菌的耐藥率高于牦牛源,其中對氟苯尼考的耐藥率達到 30.9%,遠高于牦牛源的 9.7%,對四環素類抗生素(土霉素和多西環素)的耐藥率均比牦牛源大腸桿菌高出1倍左右。本研究與李佛生[1]等報道的犢牦牛源大腸桿菌耐藥率相近,但與彭青等[35]報道的結果相差較大,分析其原因可能與藥敏試驗方法和采樣地點等因素存在一定的關系。與課題組前期研究相比[3],牦牛源大腸桿菌的耐藥水平和整合子攜帶率較低,與2017—2018年樣本采集地點較為分散和樣本數量有關。值得注意的是,耐藥譜型分析表明,58.97%(194/329)的菌株表現為多重耐藥,最多對18種抗菌藥物耐藥,警示牦牛和藏豬源大腸桿菌耐藥情況已較為嚴重,建議相關部門應及時關注牦牛和藏豬大腸桿菌的耐藥現狀及其動態變化,采用藥物敏感性試驗篩選較為敏感的抗菌藥物進行治療,盡量避免養殖人員使用耐藥率高的抗菌藥物,同時應嚴格控制抗菌藥物用量和使用頻率以避免耐藥性的產生和廣泛傳播。在后續的研究中,必須從切斷耐藥性傳播途徑角度多方位探究川西北高原大腸桿菌耐藥性產生的原因,從而闡明其耐藥機制并指導抗菌藥物的合理使用。
3.2 牦牛和藏豬源大腸桿菌耐藥基因、毒力基因、整合酶基因和生物被膜形成能力
抗生素耐藥性被認為是全球性威脅之一,以大腸桿菌為代表的革蘭氏陰性菌多重耐藥菌株引起的持續性感染更加突顯,在廣泛持續的抗生素壓力下,菌株也可以形成生物被膜逃避機體免疫系統的清除和外源性抗菌藥物的殺滅,延長病程和增加醫療成本的同時造成疾病的遷延不愈。此外,在質粒、噬菌體、轉座子、整合子-基因盒等可移動元件的介導下,耐藥基因和毒力基因的廣泛傳播也給細菌性感染的治療帶來一定的困難[14]。
盡管分離菌株大多表現出弱或無生物被膜形成能力,但是對選用的24種抗菌藥物呈現不同程度的耐藥性并呈現多重耐藥現象,其中磺胺二甲嘧啶、磺胺甲噁唑和鏈霉素完全耐藥。耐藥表型和耐藥基因型之間存在一定的相關性,其中檢測到的21個耐藥基因中,以aac(6′)-Ib最為流行(35.2%),其次為sul1和floR,檢出率均在30.0%以上,與SOUFI[36]等報道的耐藥基因攜帶情況基本一致。此外,本研究中氯霉素的耐藥率也表現出較高的耐藥水平,考慮到氯霉素為食品動物禁用抗生素,其較高的耐藥率是否與人與動物之間的直接接觸或耐藥性基因的水平傳播有關需要在后續研究中進一步探究和闡明。
除stx1、stx2、ehxA、bcsB、hlyA和hlyE外,分離菌株中至少檢測到agn43、sitA、ompT、eaeA,bcsA、fimC、LT、fyuA和irp2中的1個,fyuA和irp2的檢出率均低于張艷芳等[37]的報道。
10株同時攜帶int1Ⅰ和int2Ⅰ大腸桿菌的耐藥基因表型、生物被膜表型和毒力基因型分析結果表明:5株對 11種以上的抗菌藥物表現出耐藥性;70.0%(7/10)的菌株表現出弱生物被膜形成能力,其余3株為無生物被膜形成能力;10株大腸桿菌均攜帶eaeA,為后續深入研究以eaeA為代表的毒力基因在大腸桿菌生物被膜形成、耐藥譜型和毒力譜型及整合子-基因盒系統之間的相關性及其相關性如何等提供一定的研究思路和數據支持,從而闡明毒力基因在大腸桿菌性腹瀉致病過程及耐藥機制中發揮的作用。
3.3 耐藥基因和毒力基因與遺傳譜系分型相關性
遺傳譜系分型技術將大腸桿菌分為 A、B1、B2和D等4個不同的型,其中A型和B1型多為腸道共生菌,而B2和D型多為腸外致病性菌群,該分型技術的優點是有助于了解大腸桿菌相關生物學特征和疾病之間的相關性[30,38]。
本研究中,牦牛源大腸桿菌遺傳譜系以 B1型為主,占50.0%(103/206),其余依次為A型、B2型和D型,分別占35.92%(74/206)、8.25%(17/206)和 5.82%(12/206),與王剛等[39]報道的結果基本一致;而藏豬源大腸桿菌遺傳譜系以 A型為主,占72.36%(89/123),其余依次為B1型、D型和B2型,分別占 21.14%(26/123)、4.07%(5/123)和 2.44%(3/123),與周陸紅等[40]對豬源大腸桿菌遺傳譜系分型結果基本一致。
329株大腸桿菌耐藥基因和毒力基因與遺傳譜系分型相關性分析結果表明,A型和B1型分布的耐藥基因種類較B2型和D型多;A型中,sul3、qnrS、tetM耐藥基因分布最廣,B1型中sul1和aac(6′)-Ib分布最廣,不存在tetM和qnrA;毒力基因主要分布于A型和B1型,fimC、sitA和ompT主要分布于A型和B1型,eaeA、fyuA和irp2的主要分布于B1型,LT基因主要分布于A型,僅1株分布于D型。
本研究結果表明,盡管分離菌株大多為腸道共生菌群,與采樣動物的健康狀況有一定關系。然而,分離菌株攜帶大量的耐藥基因和毒力基因的檢測結果提示,健康動物可能作為耐藥基因和毒力基因的儲存庫,因此,后續研究應結合細菌基因組重復序列PCR技術(enterobacterial repetitive intergenic consensus-PCR,ERIC-PCR)、多位點序列分型(multilocus sequence typing,MLST)和脈沖電場凝膠電泳(pulsed field gel electrophoresis,PFGE)等多種分型技術,從分子研究水平比較健康和患病動物耐藥基因和毒力基因差異并探究耐藥性和致病性之間的相關性。
4 結論
對無菌采自阿壩州和甘孜州部分養殖場或屠宰場牦牛、藏豬糞便和胃腸道內容物樣本進行大腸桿菌分離和鑒定,同時對分離菌株(329株)進行生物被膜形成能力、藥物敏感性試驗、耐藥基因、整合酶基因和毒力基因檢測及遺傳譜系分型相關性分析。329株大腸桿菌對24種抗菌藥物呈現不同程度的耐藥性并出現多重耐藥現象,耐藥表型和耐藥基因之間存在一定的相關性;285株至少攜帶除agn43和bcsA外7個毒力基因中的1個,最多攜帶6個毒力基因。31.61%(104/329)的菌株攜帶至少一種整合酶基因,int1Ⅰ和 int2Ⅰ的檢出率分別為30.09%和4.56%,其中10株大腸桿菌(牦牛源2株,藏豬源8株),同時檢測到int1Ⅰ和int2Ⅰ。耐藥基因和毒力基因與遺傳譜系相關性分析結果表明,A型和B1型分布的耐藥基因種類較B2型和D型豐富,毒力基因主要分布于A型和B1型。基于此,后續研究將從以下兩方面入手:結合多種分型技術,以同時攜帶int1Ⅰ和 int2Ⅰ的10株大腸桿菌為對象,分析eaeA毒力基因與生物被膜表型、耐藥譜型和毒力譜型及整合子-基因盒系統之間是否存在相關性及其相關性如何等?其次,基于牦牛和藏豬源大腸桿菌采樣信息資料,對產ESBL/AmpC多重耐藥菌株進行多位點序列分型和多因素邏輯回歸分析,從而對 β-內酰胺類抗菌藥物耐藥性流行情況、風險因子和ST分型進行深入探究探討,從分子機制探討其對 β-內酰胺類抗菌藥物耐藥的分子機制。

