茶樹乙烯受體ETR基因家族的鑒定與表達分析
晏美紅,鄭玉成,侯炳豪,陳雪津,陳曉君,葉乃興
(福建農林大學園藝學院/茶學福建省高校重點實驗室,福建 福州 350002)
0 引言
【研究意義】茶樹Camellia sinensis(L.)O.Kuntze是我國重要的無酒精飲料作物[1],在生長過程中容易受到低溫、干旱、洪澇等脅迫,從而影響茶樹的正常生長發育,降低茶葉的產量和質量。植物通過調節乙烯敏感性來對環境脅迫產生反應。乙烯受體ETR(Ethylene receptor)是乙烯信號轉導途徑的第一個元件,乙烯受體基因表達對調控乙烯信號傳遞,從而調節植物生長起著重要作用。因此,鑒定并分析乙烯受體基因,挖掘其相關的功能,以期從分子水平了解乙烯受體在茶樹生長過程中應對脅迫的作用機制。【前人研究進展】乙烯是通過其與受體的結合來被植物感知的。受體位于細胞內質網膜上,起著負調控乙烯反應的作用[2]。目前,植物乙烯信號轉導通路探明:在CU+的參與下,乙烯分子結合乙烯受體,致使CTR1(Constitutive triple response1),失活而減弱下游的EIN2(Ethylene Insensitive2)蛋白的磷酸化,EIN2蛋白c端被切割,c端移動到細胞核使其中的EIN3(Ethylene insensitive3)等因子感受到乙烯信號,促進下游的ERFs(Ethylene response factors)表達,激活乙烯反應[3]。在模式植物擬南芥中,研究者們發現了5種不同類型的乙烯受體,分別為:ETR1、ERS1、EIN4、ETR2和ERS2。每個受體都包含有N端跨膜區、GAF區和組氨酸(His)激酶結構域,ETR1、EIN4和ETR2受體中還包含一個接收域[4]。根據His激酶結構域中是否存在保守元素,將受體分為2個亞科:亞科1(ETR1和ERS1)和亞科2(ETR2、ERS2和EIN4)。前人已在對香蕉[5]、芒果[6]、木薯[7]、丹參[8]等的研究中證實了乙烯受體在果實成熟和花生長等組織生長發育方面的作用以及對逆境脅迫的抵御功能。茶樹基因組學的巨大進步有效促進了研究人員對茶葉品質及適制性的理解,2017年云抗10號茶樹基因組發表,開啟了茶樹基因組學研究序幕[9],2018年中國小葉種茶樹舒茶早完成測序,舒茶早采用二代測序和三代PacBio序列補洞的策略獲得了更高質量的茶樹基因組[10]。科學家們已經分離出2個茶葉品種:中國小葉種茶樹CSS(Camellia sinensisvars.sinensis)[11]和中國大葉種茶樹CSA(Camellia sinensisvars.assamica)[9]的基因組序列,尤其是3個中國種(舒茶早[12]、碧云[13]和龍井43[11])的高精度染色體水平基因組序列已經被科學家們研究獲得。但至今鮮有有關茶樹乙烯受體基因方面的研究報告。【本研究切入點】前人研究結果表明乙烯受體基因對植物生長發育有內部調控作用。但至今鮮有茶樹乙烯受體基因的有關研究報道。【擬解決的關鍵問題】本研究通過對茶樹ETR基因家族進行生物信息學分析,預測其潛在分子功能,明確乙烯受體在茶樹發育過程中的動態變化,初步了解家族各成員功能,篩選主要參與茶樹組織發育過程ETR基因家族成員,利用前期基因家族的研究及qRT-PCR技術研究在非生物和外源激素脅迫下ETR基因家族各成員相對表達量變化,為進一步探明茶樹乙烯受體各成員功能奠定基礎。
1 材料與方法
1.1 供試材料
試驗所用材料于福建農林大學茶學福建省高校重點實驗室采集。供試原料為相同栽培條件下生長狀態良好的二年生鐵觀音盆栽茶樹。原料于2019年4月參照陳丹(2017)等[14]的方法進行了以下處理:
1)低溫處理:將在適宜溫度(24±2) ℃下生長的原料植株移到人工氣候箱中發育,溫度設置為4 ℃,濕度為60%~70%,光照時間14 h,黑暗時間10 h。取低溫處理后0、4、24、48 h的頂端第2、3片茶樹成熟混合葉。
2)植物生長調節劑處理:制備新鮮的GA、MeJA和ABA溶液,提取100 μmol·L-1噴灑于不同植株[15],取各處理后0、6、24、48 h的頂端第2、3片茶樹成熟混合葉。
將以上試驗材料每個處理取3次重復,用錫紙包裹標記,液氮速凍后存于-80 ℃冰箱中。
1.2 試驗方法
1.2.1 CsETR基因家族成員鑒定 首先在茶樹基因組數據庫TPIA(http://tpia.teaplant.org)[16]中下載茶樹ETR基因蛋白序列,使用SMART(http://smart.emblheidelberg.de/)[17]和CDD(https://www.ncbi.nlm.nih.go v/cdd/)[18]在線網站查找鑒定到的潛在基因的ETR保守結構域,與完整的ETR基因結構域進行比對,以篩選準確的基因家族成員。采用ExPASY(http://www.expasy.org/)[19]和WoLF PSORT(https://wolfpsort.hgc.jp/)[20]在線網站分析CsETR家族成員的蛋白質理化性質并預測其亞細胞定位。
1.2.2CsETR基因家族系統發育樹構建 采用MEGA7.0軟件對CsETR基因進行保守序列分析,并于TAIR(https://www.arabidopsis.org/)網站和NCBI(https://www.ncbi.nlm.nih.gov/genbank/)網站下載擬南芥和番茄的乙烯受體基因序列,使用MEGA7.0軟件構建系統進化樹[21]。
1.2.3CsETR基因成員結構和保守結構域分析 從TPIA數據庫中下載CsETR基因的外顯子和內含子數據文件,利用GSDS(http://gsds.cbi.pku.edu.cn/)[22]在線網站制作CsETR家族成員的基因結構圖,包含外顯子和內含子數目。使用MEME5.0.2(http://memesuit.org/tools/meme)在線軟件分析CsETR基因蛋白序列的保守基序[23]。
1.2.4CsETR基因的順式作用元件分析 從TPIA數據庫中提取CsETR基因起始位置上游1000 bp序列,利用Editra軟件查找啟動子順式作用元件,并于TBtools軟件進行分析[24]。
1.2.5 實時熒光定量PCR分析 茶樹葉片總RNA使用北京天根多糖多酚植物總RNA提取試劑盒提取,參照北京全式金試劑盒合成茶樹乙烯受體cDNA用于qRT-PCR[10]。CsETR家族成員引物設計在primer3plus(http://www.primer3plus.com/)在線網站上進行(表1),內參基因選用CsGAPDH(登錄號GE651107)。qRTPCR反應在熒光定量PCR儀上進行。反應體系及程序參照實驗室前期方法,使用2-ΔΔCt方法計算基因相對表達量[25],并使用TBtools繪制熱圖。
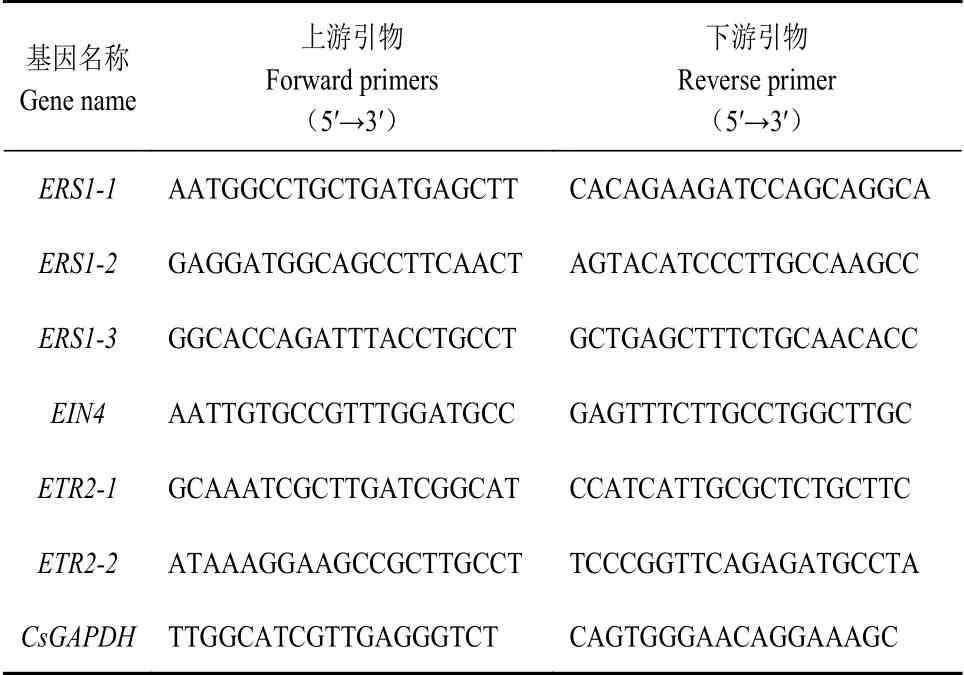
表1 茶樹CsETR家族成員引物序列Table 1 Primer sequence of CsETRs in tea plants
2 結果與分析
2.1 CsETR基因家族成員的鑒定
為準確鑒定CsETR家族成員,本研究采用了Blast比對方法,并將鑒定到的潛在CsETR家族成員提交至SMART和CDD網站再次進行鑒定,最終獲得6個CsETR家族成員,分別命名為CsERS1-1、CsERS1-2、CsERS1-3、CsEIN4、CsETR2-1、CsETR2-2(圖1)。采用ExPASY和WoLF PSORT在線網站分析6個家族成員各項因子的理化性質(表2)。通過蛋白質理化分析后得出結果,CsETR的ORF氨基酸長度為614 aa(CsERS1-1)~763 aa(CsETR2-1),分子量為68.63~85.56 kD,等電點大小為6.09(CsERS1-1)~7.57(CsETR2-2),親水性為0.014~0.250,表明CsETR基因蛋白為堿性疏水蛋白;通過亞細胞定位預測分析后發現,CsETR基因蛋白均位于質膜上。

表2 茶樹CsETR基因家族的序列特征Table 2 Characteristics of CsETR sequences in tea plants
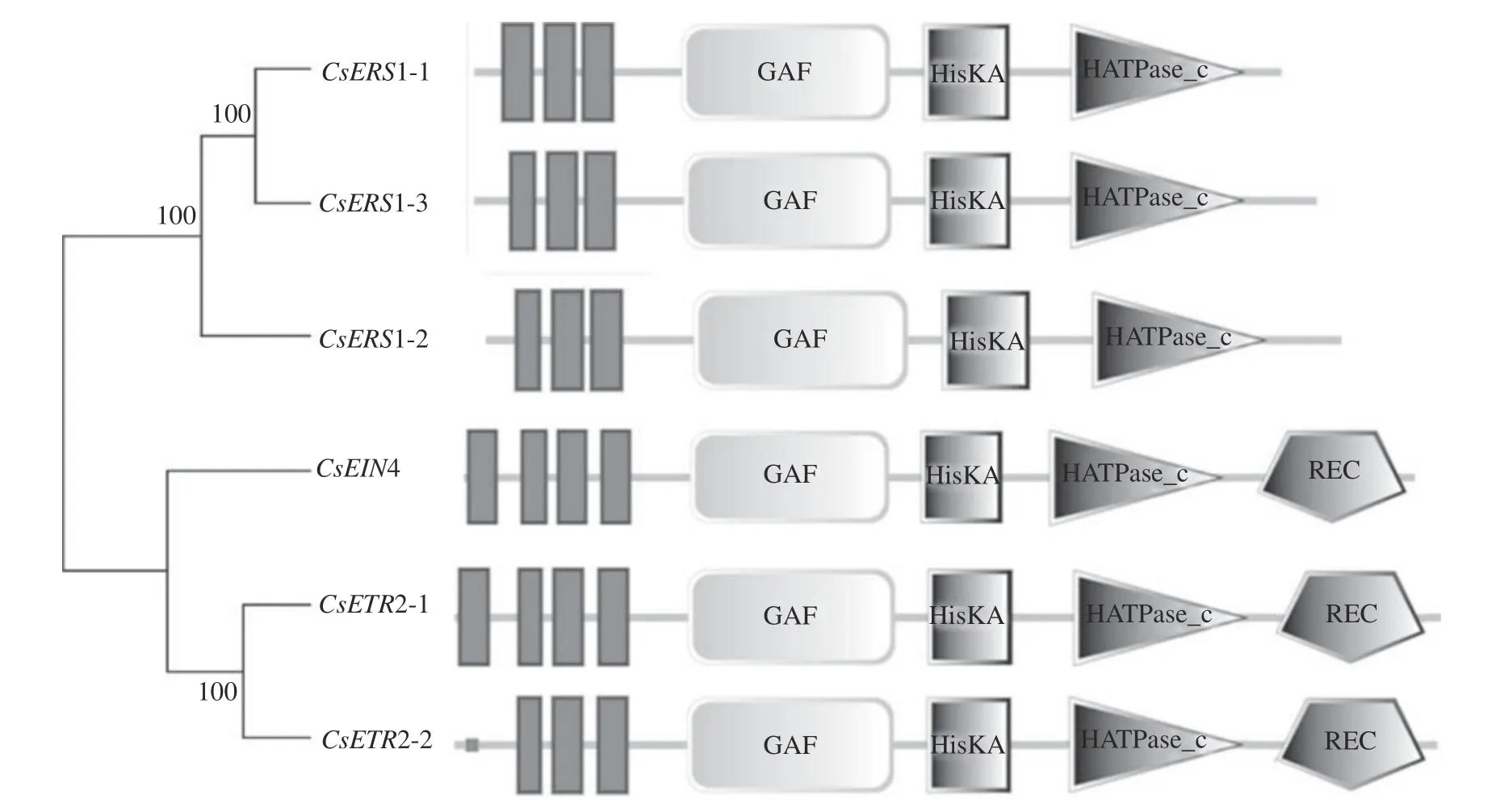
圖1 茶樹乙烯受體結構域Fig. 1 Ethylene receptor domain of tea plants
2.2 CsETR家族成員的系統發育和分類分析
為了解ETR蛋白之間的進化關系,本研究選取了3個典型物種的17個ETR蛋白用來構建系統進化樹。共采用6個茶樹乙烯受體基因、6個番茄乙烯受體基因和5個擬南芥乙烯受體基因來構建系統發育樹(圖2)。ETR家族總共可分為2個亞家族,分別為ETR家族和ERS家族。另外,番茄的變異受體基因Nr單獨形成一組,與其他2個亞家族功能有所區別。
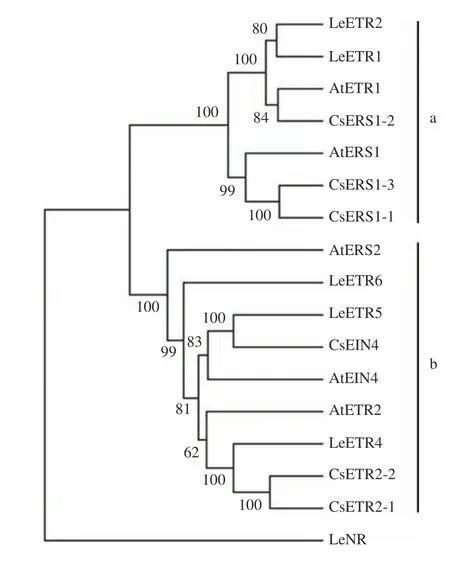
圖2 茶樹與其他植物蛋白的ETR基因系統進化樹Fig. 2 Phylogenetic tree of ETRs in tea and other plant proteins
2.3 CsETR家族成員結構和保守結構域分析
為分析CsETR基因家族成員結構的多樣性,本文通過在GSDS網站上制作基因結構圖來比較乙烯受體家族的內含子/外顯子數量(圖3),通過比較這6個成員的基因結構發現,外顯子的數量從1(ERS1-2)至12(ERS1-3)個不等,差別較大,其中ERS1-3基因序列最長,超過了10000 bp,ERS1-2除外顯子外,無內含子的存在,其他成員內含子均被外顯子中斷隔開。除此之外,發現ETR亞家族的基因序列分布相似,外顯子內含子數量均為2個,而ERS亞家族基因序列分布不均。

圖3 CsETR基因家族結構Fig. 3 Structure of CsETR family
利用分析網站MEME預測發現了ETR家族的6個保守基序(圖4)和基因的保守基序分布及長度,結果顯示所有家族成員都有相同的保守基序,且2個亞家族之間的分布在分布區域及長度上都十分相似。說明ETR家族成員基因功能較為保守,2個亞家族分別有著相似的遺傳功能。

圖4 CsETR基因的保守基序分析Fig. 4 Conservative motif analysis on CsETRs
2.4 CsETR基因家族啟動子順勢元件分析
啟動子順勢元件對于調控基因表達發揮著重要作用。CsETR基因啟動子順式作用元件使用Plant-CARE在線工具分析(圖5)。最終獲得3類順勢元件,與茶樹生長相關的順勢元件:玉米醇溶蛋白代謝 調 控(O2-site,1個)、光 響 應(TCT-motif,25個);脅迫相應元件:厭氧響應(ARE,10個)、干旱響應(MBS,3個)、低溫響應(LTR,3個)、防御和壓力響應(TC-rich repeats,1個)、創傷響應(WUN-motif,1個)以及激素響應元件:包括生長素(AuxRR-core,1個)、脫落酸(ABmotif,1個)以及激素響應元件:包括生長素(AuxRR-TATbox、GARE-motif,3個)、水楊酸(TCA-element,1個)。由圖可知,在ETR家族中6個成員均含有大量順勢元件,其中CsETR2-1含有1個O2-site,CsETR1-3 含 有1 個AuxRR-core,CsETR2-2含有1個WUN-motif。以上結果表明,CsETR家族在茶樹的生長發育、激素和外界脅迫響應中起著重要作用。
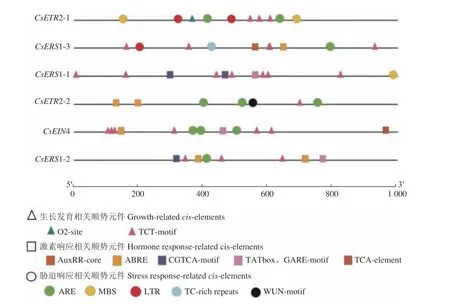
圖5 CsETR基因啟動子順勢元件預測Fig. 5 Predicted cis-elements in promoter of CsETRs
2.5 CsETR家族成員在不同組織中的表達模式
為研究CsETR基因家族對茶樹組織生長發育的功能,從TPIA數據庫中下載8種茶樹組織表達數據,利用TBtools軟件分析其在不同組織中的表達模式(圖6)。根據結果可分析出:ETR家族在果實中的表達最為明顯,莖和頂芽次之,在根和老葉部分表達相對較低,表明CsETR家族對茶樹的果實發育起著重要作用。分析各個基因家族成員的組織表達量發現,CsETR家族有著較為明顯的組織表達特異性,其中CsERS1-1、CsEIN4和CsETR2-2基因在果實中表達量較高,說明這3個基因在乙烯對果實成熟的影響過程中扮演著重要角色,而CsERS1-2、CsERS1-1在莖組織有較高表達,CsETR2-2在成熟葉中表達量較低。

圖6 CsETR基因家族的組織表達譜Fig. 6 Expression patterns of CsETR family
2.6 CsETR家族在4種處理下的表達模式
為探究CsETR基因家族在激素和脅迫下的生理反應,鑒定外界脅迫和激素影響下的乙烯受體表達,本研究使用熒光定量技術測定了CsETR家族6個成員在低溫(4 ℃)、赤霉素、脫落酸、茉莉酸處理下的相對表達量(圖7)。在對低溫4 ℃誘導下的試驗材料進行PCR分析后得出其不同時段的基因表達量,發現CsETR基因家族的6個成員表達量均呈現上調趨勢,其中CsERS1-1表達量上調幅度最大,CsERS1-3較小,大部分基因在低溫誘導48 h后的表達量最高。分別對GA、MeJA、ABA處理后試驗材料基因表達量進行分析,在GA的影響下,除去EIN4基因的表達量略有波動外,大部分ETR基因家族成員表達量均呈上調趨勢,其中CsERS1-3的上調幅度最大,而CsERS1-1在6~48 h的基因表達量差別不大。在JA影響下的ETR基因表達量均呈現上調趨勢,且CsERS1-3的上調幅度亦位于首位。在ABA的影響下,除CsETR2-2基因的表達量呈下調趨勢外,其他家族成員都呈上調趨勢,其中CsERS1-3的上調幅度依舊穩居首位。然而,ETR基因家族成員在ABA處理6 h后的表達量變化均難以測定,但內參處理下的基因表達量變化正常,推測其原因是ABA處理6 h對CsETR基因的影響不明顯。

圖7 CsETR基因在低溫、GA、MeJA、ABA處理下的表達譜Fig. 7 Expression profile of CsETRs under low-temperature, GA, MeJA, or ABA treatment
3 討論與結論
前人研究表明,ETR基因對植物生長,尤其是在成花及果實成熟階段發揮著重要的調節作用。目前已經在擬南芥中鑒定到5個ETR成員[10]、番茄中鑒定出6個ETR成員[26]、甜瓜中鑒定出3個家族成員[27]、水稻中分離出5個基因[28]、煙草中鑒定出4個ETR家族成員[29]。在對ETR基因的進化史研究發現,ETR家族成員中,類ETR1受體首先進化,可能伴隨著茶藻進化過程。乙烯反應在從藻類向陸地環境過渡期間可能很重要,對乙烯應對外界環境的進化研究有貢獻[30]。然而,目前尚無對茶樹ETR家族的研究。本研究在茶樹基因組數據的基礎上,根據其蛋白質結構鑒定出了6個ETR成員,分析結果介于擬南芥和番茄之間。通過對模式植物擬南芥ETR基因家族的分析發現,ETR基因分為2個亞家族,茶樹ETR基因在這2個亞家族中均有分布,其中亞家族1中ERS基因有3個。其中,CsETR2-1和CsETR2-2與LeETR4同源性最為接近;CsERS1-1和CsERS1-3與AtERS1同源性最近,表明它們可能行使了相同的功能。這些不同的主要序列,存在區域和表現出激酶活性的類型,可能表明受體間的功能差異性。在分析ETR家族結構之后,發現ETR基因外顯子-內含子高度保守,外顯子數目為1~12個,同一組間的外顯子數目相似,說明同一組基因間有著功能的相似之處。而在MEME網站上分析CsETR蛋白質的基序發現,6個基因都存在相同的6個基序,且相同組的距離幾乎相同,說明2個亞家族有著相似的遺傳功能。
乙烯受體是乙烯信號轉導通路中的第一步,對乙烯引起的植物生理反應有著重要的作用。研究表明,ETR基因對于調節植物果實成熟和花衰老有著關鍵作用。不同的乙烯受體,即使結構相似,在同一或不同植物中對于植物生長階段的表達水平與模式都有差異,如在同一株月季中,亞家族1的2個成員RhETR1和RhETR3結構相似,但在切花開放過程中,2個基因的表達卻完全相反,RhETR1上調,RhETR3則下調。在2個不同植物番茄和甜瓜中,番茄LeETR1與甜瓜Cm-ETR1同源,在果實成熟時,LeETR1表達不受乙烯合成影響,而Cm-ETR1的表達隨內源乙烯的合成同比變化[31]。ETR基因負調控乙烯信號轉導,即上調ETR基因的表達,植物的乙烯敏感性就降低,反之升高。因此,可以通過調節ETR基因的表達來調控植物對乙烯的敏感性,如在水稻培育過程中通過上調ETR2基因的表達來降低轉基因植株的敏感性,從而延遲水稻開花[32]。本研究發現CsETR家族在茶樹果實中高表達,尤其是CsERS1-1、CsEIN4、CsETR2-2,說明這些基因對于調控茶果成熟起著重要作用,其次,ERS亞家族對茶樹莖高表達,說明這些基因在茶樹莖的發育中發揮作用。
研究基因啟動子有助于了解植物基因表達模式的差異及其分子調控機制。前人研究發現,許多ETR基因自身含有響應非生物脅迫的順式作用元件,如在番茄中SlETR6基因含有LTR、MBS、ARE、TCTmotif、ERF(乙烯應答)等順式作用元件[33]。甘蔗的受體基因SoERS1中也含有干旱誘導的MYB結合位點和LTR元件,說明該基因的表達可能受干旱和高溫等因素的調控[34]。同樣,我們在對茶樹的啟動子研究當中,也發現了每個成員所攜帶的順式作用元件,如ARE、TCT-motif、LTR、ABRE、AuxRR-core、CGTCA-motif等,大部分都與非生物脅迫和激素有關。在對低溫及植物生長調節劑處理下的茶葉經PCR分析后發現,CsETR家族所有成員在低溫脅迫下的表達量均呈上調趨勢,這與啟動子順勢元件分析結果相匹配。在GA、ABA、JA的誘導下,大部分家族成員基因表達量都呈上調趨勢,而EIN4基因在GA處理6 h后達到最高值,說明EIN4基因在GA處理前期正調控反應最大,而ETR2-2基因在ABA處理下表達量呈下調趨勢,可能是ETR2-2基因在ABA的影響下表達收到抑制。在CsETR家族基因中,CsERS1-3在植物生長調節劑的影響下表達量上調幅度最大,說明ERS1-3在對植物生長調節劑的響應中可能發揮重要的正調控作用。
本研究首次開展了對茶樹全基因組數據庫中CsETR基因家族的鑒定分析,鑒定出6個家族成員,分為2個亞科,對其保守結構域、啟動子順勢元件分析以及在低溫、外源激素脅迫下的反應進行分析后得出初步結論:茶樹乙烯受體基因家族與茶樹的組織生長發育、非生物脅迫和外源激素影響有著密切的關系,后續還需進行細致的試驗具體驗證這些基因的生物學功能,并為茶樹新品種選育提供參考。

