CT定量分析鑒別富血供小腎癌與乏脂肪血管平滑肌脂肪瘤
王旭 宋歌 江海濤*
腎腫瘤是常見的泌尿系疾病之一,在男性泌尿系腫瘤中排第2位,且近年來其發病率明顯增高并有逐年遞增趨勢,約48%為偶發性[1]。腎腫瘤中大部分均為惡性腎細胞癌(RCC),約占90%[2]。RCC中最常見的是透明細胞腎細胞癌(ccRCC),約占70%~80%,其次為乳頭狀腎細胞癌和嫌色性腎細胞癌(chRCC)[3]。ccRCC為富血供腫瘤,一部分chRCC也可表現為富血供強化[4],這與部分強化明顯的乏脂肪血管平滑肌脂肪瘤(mfAML)具有相似的強化方式,當腫瘤體積較小時難以鑒別。本文比較sRCC與mfAMLCT影像學特征,旨在提高術前鑒別診斷的準確性。
1 資料與方法
1.1 臨床資料 回顧性分析2015年6月至2018年9月本院經手術病理證實的富血供小腎腫瘤73例,分為sRCC組及mfAML組,sRCC組53例,包括51例ccRCC及2例chRCC,mfAML組20例。納入標準:①腫瘤最大截面直徑≤3 cm;②均為偶然體檢發現或僅有輕微腰疼,且無結節性硬化癥病史;③mfAML患者CT平掃圖像均未測到明顯脂肪密度;④均行腎臟雙期增強掃描,增強掃描皮質期腫瘤實性部分CT值≥120 HU,且皮質期與平掃CT值差值≥60HU。sRCC組中,男31例,女22例;平均年齡(54.60±10.08)歲。均為單側單發,左腎27例,右腎26例,腫瘤直徑(2.52±0.70)cm。mfAML組中,男5例,女15例;平均年齡(50.70±6.90)歲。1例為單側雙發,余均為單側單發,左腎10例,右腎10例,腫瘤直徑(2.19±0.70)cm。
1.2 檢查方法 使用Siemens Somatom Definition flash 64排螺旋CT及Siemens Somatom sensation 16排螺旋CT進行掃描,管電壓120 kV,管電流自動控制,層厚5 mm,層間距5 mm,重建層厚1 mm。采用平掃及雙期增強掃描,先行腎臟平掃,再于注射對比劑后20~30 s、60~75 s分別行皮質期及實質期掃描,增強掃描采用高壓注射器經肘靜脈注入非離子型對比劑優維顯65 mL(370 mgI/mL),注射速率4.5 mL/s。掃描范圍從膈頂至腎下極水平。
1.3 圖像分析 (1)形態學征象判定:由2名有>8年腹部腫瘤診斷經驗的醫師以軸位圖像結合MPR重建圖像對腫瘤的形態學征象進行分析并達成一致意見。分析內容包括腫瘤的位置、形狀、腫瘤中心、有無皮質掀起征、假包膜征、角界面征、黑星征、囊變/壞死及強化均勻性等。在實質期圖像上進行皮質掀起征、假包膜征、角界面征及黑星征的判定。以腫瘤大部分區域強化是否均勻為標準分別判定皮質期及實質期腫瘤的強化均勻性。(2)定量參數測定:在皮質期期選取腫瘤實質部分強化最明顯的區域,放置感興趣區(ROI)測量腫瘤的CT值及正常腎皮質的CT值,并在相同位置分別測量平掃和實質期腫瘤的CT值以及實質期腎皮質的CT值。ROI的面積約10~20 mm2,應盡量避開腫瘤內出血、囊變、壞死、鈣化及血管走行區,并盡量放置在腫瘤實性部分強化最明顯的區域。各期ROI分別測量三次,取其平均值。計算皮質期及實質期腫瘤的凈強化值(皮質期/實質期腫瘤CT值與平掃腫瘤CT值之差)及相對強化值(皮質期/實質期腫瘤CT值與皮質期/實質期腎皮質CT值之差)。記錄腫瘤的強化方式:強化峰值位于皮質期且于實質期強化迅速減低為快進快出,強化峰值在實質期且強化呈上升趨勢為延遲強化。
1.4 統計學方法 采用SPSS 26.0統計軟件。計量資料以(x±s)表示用獨立樣本t檢驗;計數資料用χ2檢驗。對有統計學意義的定量參數值繪制ROC曲線,計算曲線下面積(AUC)。使用二元logistic回歸篩選形態學特征及定量參數中最有鑒別價值的獨立因素,并建模分析,繪制預測概率的ROC曲線,計算AUC值,準確性、特異性及敏感性。P<0.05為差異有統計學意義。
2 結果
2.1 sRCC與mfAML的臨床資料及影像學征象比較 兩組腫瘤在性別分布差異有統計學意義(P<0.05)。兩組腫瘤在假包膜征、角界面征、黑星征及囊變/壞死的比較差異有統計學意義(P<0.05)。強化特征方面,實質期時sRCC仍更多表現為不均勻強化(83.02%),而mfAML則更多表現為均勻性強化(60.00%),差異有統計學意義(P<0.01)。見表1。
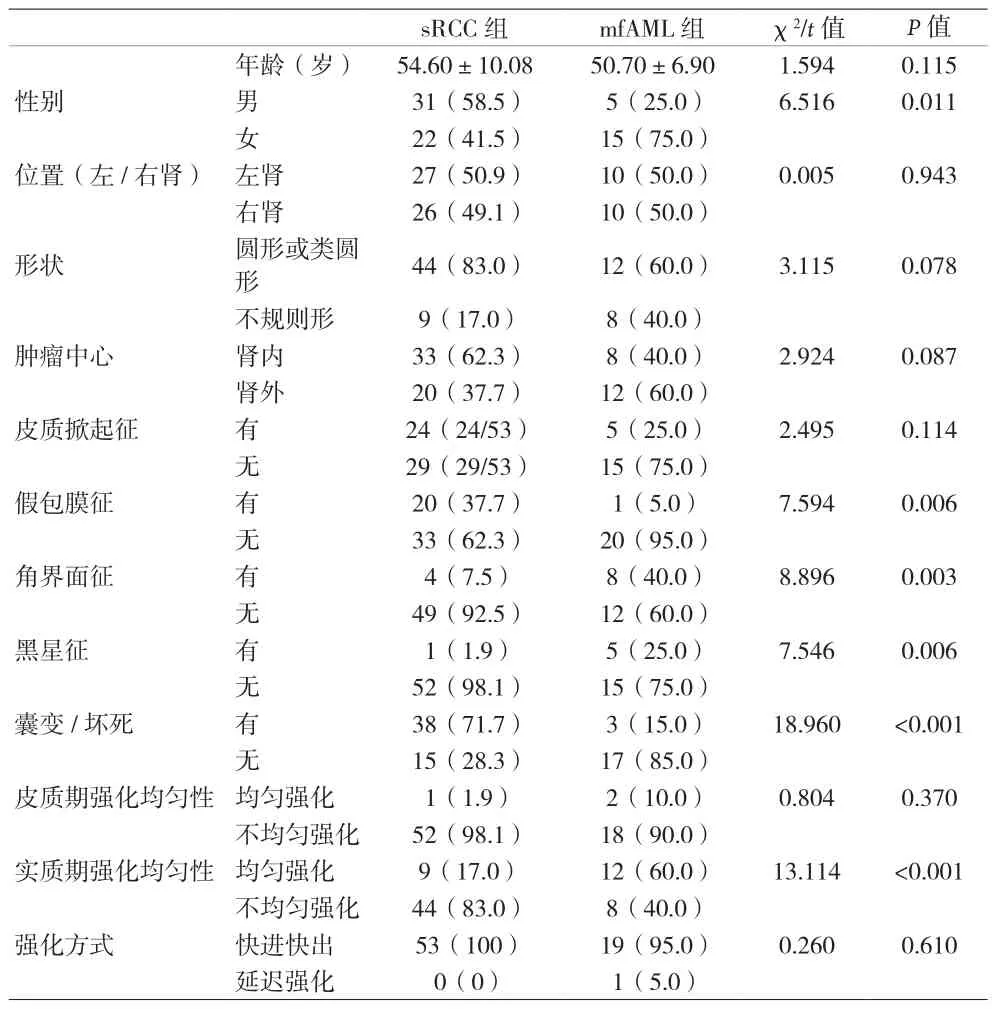
表1 富血供sRCC與mfAML的臨床資料及影像學征象比較
2.2 定量參數比較 增強掃描皮質期,sRCC平均CT值及凈強化值均高于mfAML(P<0.01);皮質期及實質期sRCC的相對強化值也高于mfAML,兩組間差異有統計學意義(P<0.01)。(見表2)。ROC曲線顯示皮質期CT值、皮質期凈強化值及雙期相對強化值的AUC值分別為 0.713(95%CI:0.584~0.842)、0.765(95%CI:0.646~0.884)、0.826(95%CI:0.730~0.922) 及 0.693(95%CI:0.568~0.819),其中皮質期相對強化值的AUC值較高(見圖3)。當皮質期相對強化值取2.55 HU為截斷值時,其鑒別診斷的特異性為80.0%,敏感性為79.2%。
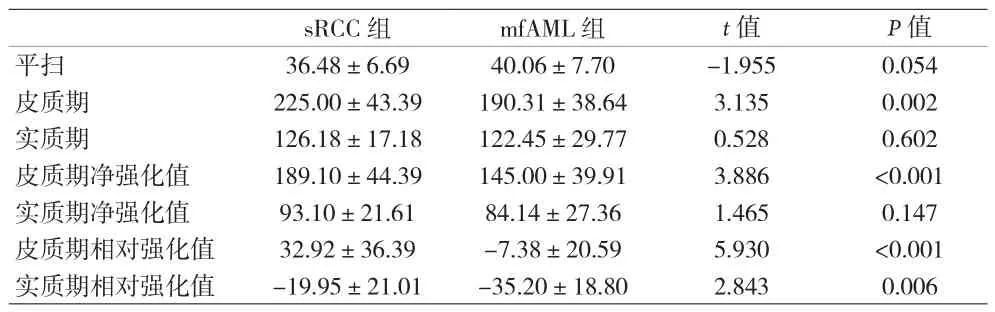
表2 富血供sRCC與mfAML的CT值比較[HU,(x±s)]
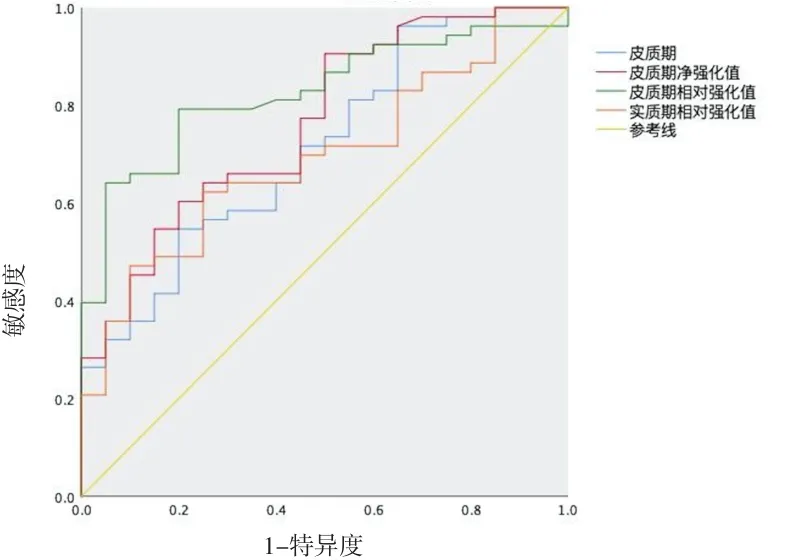
圖3 各定量CT值的ROC曲線
2.3 預測模型 以病理類型為因變量,將有統計學意義的性別、囊變/壞死、角界面征、假包膜、黑星征、實質期強化均勻性及定量參數中診斷效能最好的皮質期相對強化值作為自變量進行多因素分析,結果顯示:性別、囊變/壞死及皮質期相對強化值為sRCC的獨立危險因素(P<0.05),其OR值分別為10.107(95%CI:1.551~65.851)、15.842(95%CI:2.247~111.682)及 1.061(95%CI:1.021~1.103)。將性別、囊變 /壞死及皮質期相對強化值組合進行建模分析,該模型的AUC值為0.936(95%CI:0.879~0.992),診斷準確性為89.0%,敏感性為92.5%,特異性為80.0%。見圖4。
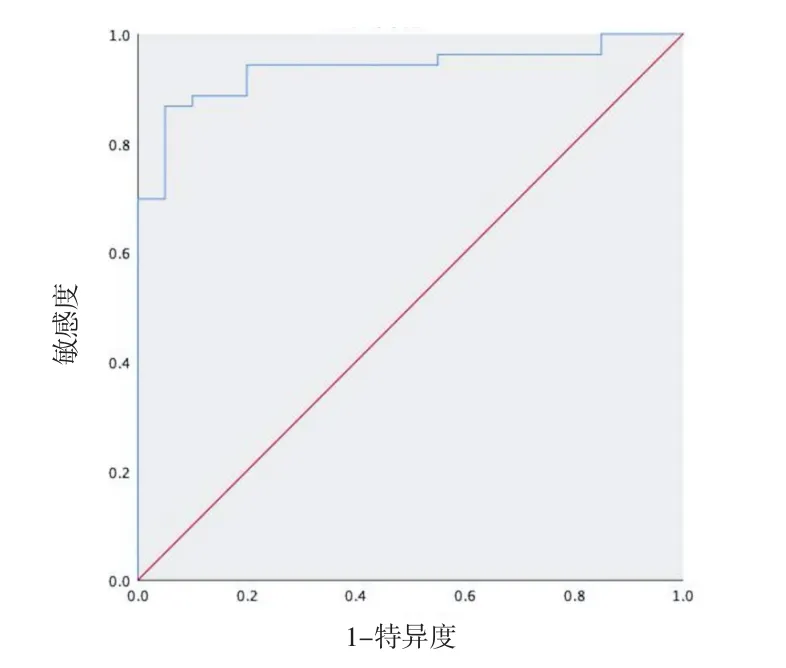
圖4 組合模型預測概率的ROC曲線
3 討論
臨床上通常把直徑≤4 cm的腎癌稱為sRCC(T1a期),大部分sRCC為早期局限性腎癌,相對于直徑>4 cm的腎癌其進展緩慢,轉移及復發率均較低。但部分sRCC的惡性程度較高,隨Fuhrman分級升高,其異質性越明顯[5]。而腫瘤大小也與sRCC的預后關系密切,有研究[6]發現直徑≤2 cm的sRCC腫瘤轉移率為4.8%,2~3 cm為4.9%,3~4 cm為7.1%,這表明腫瘤的大小與轉移呈線性關系,且直徑>3 cm是sRCC發生進展和轉移的高危因素。故本研究納入病例的直徑均≤3 cm,在此標準下的早期鑒別有利于盡早對sRCC進行臨床干預,降低其進展及轉移的風險。
sRCC中的ccRCC與部分chRCC以及良性的mfAML是最常見的富血供腎腫瘤,三種腫瘤均可富含血管成分而表現為富血供強化[7-8]。本資料顯示,兩組腫瘤性別分布有差異,男性在sRCC中多見,而在mfAML中比例較低,且為富血供sRCC的獨立危險因素,與以往報道相符[9]。囊變/壞死在富血供sRCC與mfAML中具有較高的診斷價值,本組sRCC中囊變/壞死率>70%,顯著高于mfAML,與文獻報道一致[7]。sRCC中的囊變/壞死是瘤體生長過快及新生血管供血不均衡所導致的瘤內缺血壞死或變性囊變,在ccRCC中較常見,惡性程度較高的chRCC中也可見,表現為瘤體內不規則的偏液性低密度區。本組中sRCC的囊變/壞死區多位于腫瘤中心或邊緣區域,形態為不規則小片狀及囊泡狀,數量較少,與mfAML內呈細小斑點狀隨機分布的黑星征有較明顯差異。兩組腫瘤的角界面征、黑星征、假包膜征及實質期強化均勻性間差異有統計學意義,但均非鑒別兩種腫瘤的關鍵因素,這與馬燕青等[10]的研究結果不符。可能是因本研究在限定腫瘤大小后部分形態學特征表現不典型致觀測到的比例較低有關。
定量參數方面,mfAML的平掃CT值雖然高于sRCC,但差異無統計學意義,這與之前的研究結果不符[11]。可能與本組sRCC體積較小,合并出血時密度偏高,而部分mfAML中平滑肌含量較少有關。增強掃描后兩組腫瘤除在實質期CT值及實質期凈強化值間的差異無統計學意義外,其余增強定量參數的差異均有統計學意義,與以往研究結果[12]一致。兩組腫瘤由于均富含血管成分而在皮質期明顯強化,但sRCC內血管內皮生長因子誘導的腫瘤新生血管基底膜完整性差,通透性較高,造影劑較正常組織更易彌散到組織間隙中,故其皮質期強化程度較良性的mfAML更加明顯,同時結合平掃或通過腎皮質進行標準化,可以減低個體及掃描技術間的差異,更好的對兩者進行鑒別。本資料中皮質期相對強化值的差異最為顯著,對兩者鑒別效能最優,且在綜合臨床信息及常規形態學特征分析后,發現其在鑒別診斷中的價值較高,是關鍵因素之一。
本資料結果顯示,男性、瘤內囊變/壞死及皮質期相對強化值為診斷sRCC的獨立因素,其參數化組合的診斷效能優于以往常規影像學特征或定量參數的單獨判定,更加有助于對sRCC與mfAML的鑒別。相對單一影像學特征的逐一判定,該組合模型可以最大限度利用這些定性及定量數據中最有價值的關鍵信息,減少較多的常規影像學特征判定中主觀因素的影響,具有較好的可重復性及臨床實用價值。馬燕青等[10]研究顯示,假包膜及強化方式為鑒別兩者的獨立因素,其組合模型的準確率為89.7%。本資料中兩組腫瘤的體積更小且均為富血供強化,在鑒別診斷中較之前的研究更加困難,但本預測模型在納入性別及定量參數后使模型的客觀性增加,且診斷準確率同樣較高,應用更加便捷。

