一種檢測KPC和NDM耐藥基因的雙重PCR-LF方法建立及初步應用*
王 潔,裴 兵,孫 寧,王衛萍,王 穎,李曉軍△
1.南京醫科大學附屬宿遷第一人民醫院中心實驗室,江蘇宿遷 223800;2.東部戰區總醫院臨床中心實驗科,江蘇南京 210002
隨著碳青霉烯類抗菌藥物的廣泛應用,耐碳青霉烯類腸桿菌科細菌(CRE)逐年增多[1],給感染的治療帶來了極大的挑戰[2]。在CRE的耐藥機制中,最主要是產碳青霉烯酶,其中肺炎克雷伯菌碳青霉烯酶(KPC)和新德里金屬β-內酰胺酶(NDM)是目前研究最多也最為常見的碳青霉烯酶。目前,采用常規實驗室的藥敏試驗方法指導臨床用藥,存在著培養時間過長的缺點,嚴重影響了臨床治療時效性。為了適應臨床治療對快速檢測的需求,低成本、快速的側流層析(LF)技術得到進一步發展[3]。本研究將雙重聚合酶鏈反應(PCR)技術和LF技術有機結合,建立雙重PCR-LF方法檢測2種重要碳青霉烯酶基因(KPC和NDM),實現在一個反應體系中快速、特異地檢測2個靶標基因,并將該方法直接用于臨床無菌體液標本的檢測,為早期指導臨床用藥提供依據。
1 材料與方法
1.1菌株來源 攜帶KPC、NDM肺炎克雷伯菌,產KPC-2的碳青霉烯類抗菌藥物耐藥標準肺炎克雷伯菌菌株ATCCBAA-1705,攜帶blaIMP的銅綠假單胞菌,攜帶blaVIM的惡臭假單胞菌,攜帶blaNDM-1的肺炎克雷伯菌均由東部戰區總醫院中心實驗科微生物室保存。
1.2儀器與試劑 Premix TaqTM(TaKaRa TaqTMVersion 2.0 plus dye); PCR分析試劑盒(Takara公司)和DL2000 DNA標記物(Takara公司);TIANamp Blood DNA 檢測試劑盒(天根生物科技有限公司);核酸染料GelRed(美國Biotium公司)。PCR擴增儀(美國BioRad公司)、電泳儀(美國BioRad公司);凝膠電泳成像分析系統(上海歐翔科學儀器有限公司);高速離心機(Eppendorf5417R);VITEK 2 Compact 全自動細菌鑒定及藥敏分析系統(法國生物梅里埃公司);微量分光光度計(美國Thermo Fisher Scientific公司)。
1.3方法
1.3.1DNA提取 將細菌接種于MH瓊脂平板上,分區劃線培養,挑取單個菌落,將其懸浮于100 μL滅菌去離子水,100 ℃ 10 min,12 000×g離心5 min,轉移上清液至—20 ℃保存備用。無菌體液標本DNA按照試劑盒說明書進行提取。
1.3.2引物 根據GenBank已發表的序列[4-6],設計KPC、NDM引物。引物序列由上海Invotrigen公司合成。
1.3.3雙重PCR 擴增體系(25.0 μL):Premix Ex Tap Hot Start Version 12.5 μL,2種耐藥基因(KPC、NDM)的正向和反向引物(10 μmol/L)各加0.5 μL至同一反應體系,1.0 μL DNA模板,加ddH2O補足至25.0 μL。反應條件:95 ℃ 5 min,95 ℃ 40 s,55~60 ℃ 40 s,72 ℃ 1 min,共計35個循環;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,10個循環;72 ℃ 10 min。取產物經瓊脂糖凝膠電泳后,進行測序驗證。
1.3.4雙重PCR方法學評價 將攜帶KPC、NDM的肺炎克雷伯菌,按照上述1.3.1步驟進行DNA提取后,檢測其水平,進行10倍梯度稀釋,按照建立的雙重PCR反應體系進行檢測。
1.3.5LF試紙的制備與性能測試 以半抗原地高辛、熒光素與相應抗體的免疫反應為基礎,制備LF試紙。在雙重PCR檢測KPC和NDM的研究基礎上,將上述KPC和NDM引物進行標記(KPC上下游引物分別標記生物素和地高辛;NDM上下游引物分別標記生物素和熒光素),擴增帶有雙標記的DNA產物,電泳后回收產物,利用NanoDrop-1000檢測其水平;而后進行LF試紙的性能測試,以1 ng的雙標記DNA產物為測試模板,首先分析不同抗體水平的檢測效果,兩條檢測線:T1為抗地高辛抗體,T2為抗熒光素抗體,質控線C為生物素化的牛血清清蛋白(B-BSA)。
1.3.6雙重PCR-LF檢測KPC和NDM 采用雙重PCR-LF檢測標準菌株和臨床分離菌株中的KPC和NDM基因。取雙重/單重PCR產物5 μL點樣在層析試紙條上,5~10 min后進行結果判讀。
1.3.7應用雙重PCR-LF檢測臨床標本 收集臨床微生物送檢無菌體液標本120份(包括腦脊液、穿刺液、關節液、引流液等),進行DNA提取。按照上述建立起來的反應體系,進行雙重PCR-LF檢測。
1.4統計學處理 采用SPSS19.0統計軟件進行數據處理及統計分析。將雙重PCR-LF的檢測結果與耐藥表型結果進行配對比較,采用McNemar檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1雙重PCR檢測KPC和NDM方法學評價 雙重PCR檢測KPC和NDM的檢測限為200 CFU/mL,與常規單重PCR檢測結果一致,見圖1。

注:A為雙重PCR結果;B為常規PCR擴增KPC;C為常規PCR擴增NDM;M為DL1000 DNA 標記物;7~1為梯度稀釋的產KPC和NDM的肺炎克雷伯菌(2~2×106 CFU/mL) 。
2.2LF試紙的性能測試 LF試紙的性能測試結果表明,抗地高辛抗體、抗熒光素抗體和B-BSA的點樣水平分別為250、50、50 ng時效果最佳,見圖2。

圖2 不同抗體水平對檢測雙標記DNA的影響
2.3雙重PCR-LF檢測KPC和NDM方法學評價 雙重PCR-LF檢測KPC和NDM,最低可檢測到200 CFU/mL的肺炎克雷伯菌,并且與其他超廣譜β-內酰胺酶(ESBLs)基因沒有交叉反應,見圖3。
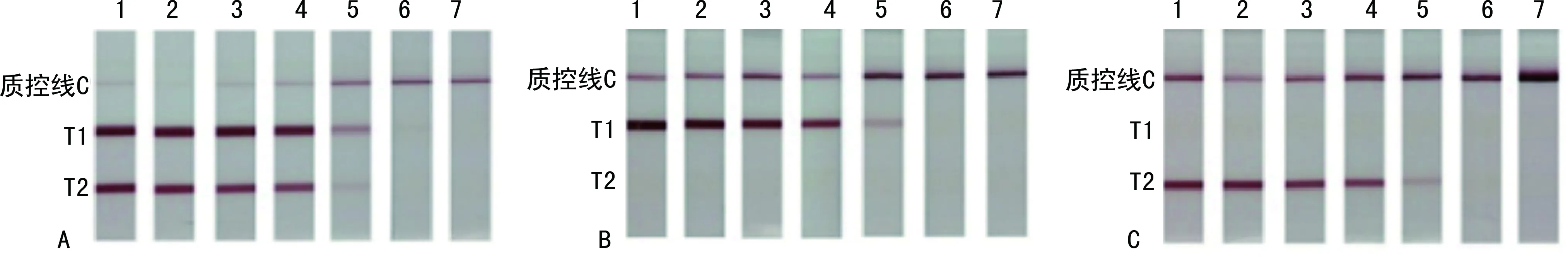
注:7~1為梯度稀釋的產KPC和NDM的肺炎克雷伯菌(2~2×106 CFU/mL);A為雙重PCR-LF檢測結果;B為單重PCR-LF檢測KPC的結果;C為單重PCR-LF檢測DNM的結果。
2.4雙重PCR-LF與藥敏表型檢測結果比較 以藥敏表型為參考方法,雙重PCR-LF檢測的靈敏度為69.39%,特異度為92.96%,Kappa值為0.644,兩種方法結果比較,差異無統計學意義(P>0.05)。見表1。

表1 雙重PCR-LF與藥敏表型檢測結果比較(n)
3 討 論
據2017年全國細菌耐藥監測報告顯示,在臨床常見細菌感染中,大腸埃希菌、肺炎克雷伯菌、銅綠假單胞菌和鮑曼不動桿菌對碳青霉烯類抗菌藥物(對亞胺培南、美羅培南或厄他培南任意一種藥物耐藥)的耐藥率分別為1.5%、9.0%、20.7%和56.1%。就江蘇省而言,碳青霉烯類抗菌藥物耐藥率高于全國平均水平,這一現象對當地居民的健康和感染控制造成了嚴重威脅[7-10]。因此,迫切需要建立一種快速、準確的碳青霉烯酶基因檢測方法,指導臨床用藥,縮短TAT時間,避免抗菌藥物的濫用,預防產碳青霉烯酶細菌暴發性感染。
常規微生物實驗室多采用藥敏表型檢測的方法指導抗菌藥物使用,需要進行細菌分離培養,整個檢測流程時間較長,且易產生假陰性[11],易延誤治療。多重PCR可一次擴增多種耐藥基因,提高檢測效率同時降低檢測成本,減輕患者負擔[5]。然而多重PCR仍存在一定不足,例如:常規的多重PCR技術需采用電泳或測序進行產物分析,實時熒光PCR技術需要配有熒光檢測通道的PCR儀器,存在著操作煩瑣、易污染等問題,且需要嚴格的操作流程和實驗環境要求。
本研究將雙重PCR檢測方法和LF技術相結合。LF技術主要分為兩類,一類是以堿基互補配對原則為反應基礎的核酸LF技術(NALFT);另一類是以免疫反應為基礎的LF技術(NALFIA),即在雙鏈DNA上標記半抗原或生物素,而后利用生物素-親和素反應或半抗原-抗體的免疫反應,以膠體金或量子點等作為標記物,進行核酸檢測,實現快速、準確、可視化的檢測需求。
本研究建立的雙重PCR-LF方法直接用于無菌體液標本的檢測,結果顯示,LF試紙能夠快速有效檢測到耐藥基因KPC和NDM,與藥敏表型檢測結果的Kappa值為0.644,一致性較好,且靈敏度達69.39%,特異度達92.96%,可為臨床用藥提供依據。但是本研究發現,部分無菌體液標本的藥敏表型為耐藥表型,但雙重PCR-LF方法檢測結果為陰性。分析原因:一是細菌的耐藥方式并不僅局限于產碳青霉烯酶[12];二是本研究建立的方法不能包含全部的碳青霉烯酶基因。但是隨著細菌耐藥機制研究的不斷深入,發現KPC和NDM是較為常見和分布較廣的碳青霉烯酶[2,13-14]。因此,從一定程度上講,多重PCR-LF可以滿足臨床檢測碳青霉烯酶基因的需求。
綜上所述,本研究建立的雙重PCR-LF方法檢測時間約為3 h,且靈敏度、特異度均達到較高水平,實現了碳青霉烯酶基因的快速檢測,可在臨床藥敏結果出來之前,指導臨床用藥,避免抗菌藥物的濫用。同時,該檢測方法也為今后在一個反應體系納入3種及以上的耐藥基因檢測方法提供了思路與基礎。

