犬弓首蛔蟲感染比格犬不同階段肝circRNAs表達模式的分析
鄒 揚,鄭文斌,張金鵬,路義鑫*,朱興全2,*
(1.東北農業大學動物醫學學院,黑龍江省動物源性人獸共患病重點實驗室,哈爾濱 150030;2.中國農業科學院蘭州獸醫研究所,家畜疫病病原生物學國家重點實驗室,蘭州 730046;3.山西農業大學動物醫學學院,太谷 030801)
犬弓首蛔蟲是一種呈全球性分布的被嚴重忽視的人獸共患寄生線蟲,可引起包括人類在內的多種動物的弓首蛔蟲病,尤其是在熱帶和亞熱帶地區較低社會經濟階層的人群中[1]。據統計在2011—2015年我國東北和華北地區人感染弓首蛔蟲病的血清學陽性率為12.25%(351/2 866)~19.3%(281/1 458)[2-4]。寄生于終末宿主(犬科動物)腸道內的犬弓首蛔蟲成蟲,可通過糞便將受精蟲卵排出體外,在適宜的土壤環境中,這些受精蟲卵可發育為感染性蟲卵,并存活數月至數年。當被包括人類在內的轉續宿主誤食后,犬弓首蛔蟲幼蟲雖不會發育為成蟲,但幼蟲會在宿主的多種組織器官中移行,造成嚴重的病理損傷[1]。如內臟幼蟲移行癥(visceral larva migrans,VLM)、眼睛幼蟲移行癥(ocular larva migrans,OLM)和神經型弓首蛔蟲病(neurotoxocariasis,NT)等[1,5-6]。截至目前,弓首蛔蟲病的確診比較困難[7],且對其預防、治療和監測的關注也十分有限,因此往往確診感染時,已經出現了嚴重的不可逆的病理特征[8-9]。雖然用顯微鏡檢測病原是鑒定犬弓首蛔蟲病的金標準,但在實際操作上卻很難實現。而ELISA檢測雖然是當前推薦的一種可行的方法,但是它的敏感性只接近80%[10],因此開發一種更為精準的檢測手段是十分必要的。通過對寄生蟲與宿主相互作用關鍵分子的鑒定,可以為開發寄生蟲病新的診斷方法提供潛在的生物標志物。
作者前期研究發現,許多長鏈非編碼RNAs(lncRNAs)和編碼RNAs(mRNAs)以及小RNAs(miRNAs)在犬弓首蛔蟲感染宿主的過程中發揮著重要的作用[11-12]。環狀RNA(circular RNA,circRNA)廣泛地存在于真核轉錄組中,且具有細胞和組織特異性,能通過吸附miRNAs而成為競爭性內源RNA[13-14],并通過與RNA結合蛋白結合而參與生物體多種生理和病理學進程。此外,由于分子量低的特性,環狀RNA能通過外泌體、納米微粒等胞外囊泡進行轉運,被選作結核病等多種疾病的診斷靶標和治療靶點。然而,在犬弓首蛔蟲感染宿主過程中,circRNAs的調控及其在宿主肝中的發病機制中所起的作用仍然未知。因此本研究通過對犬弓首蛔蟲感染比格犬肝的circRNAs進行RNA測序,揭示宿主肝circRNAs在犬弓首蛔蟲感染過程中發揮的作用,為進一步探究犬弓首蛔蟲與宿主之間的相互作用奠定基礎。
1 材料與方法
1.1 感染蟲卵的制備
從雌性成蟲的子宮內分離出犬弓首蛔蟲受精蟲卵,將收集到的受精蟲卵放置于含有高壓滅菌的濾紙和脫脂棉的培養皿中,置于0.5%的甲醛溶液中,28 ℃恒溫孵育28 d后,收集感染性蟲卵。用200目篩網除去雜質,并將蟲卵浸泡在1%的甲醛溶液中,置于4 ℃冰箱保存[15]。
1.2 比格犬感染模型的建立
從國家犬類實驗動物資源庫購買18只6~7周齡的未進行任何疫苗免疫的比格犬,所挑選的比格犬通過糞檢以確保無任何蠕蟲蟲卵,且采用間接ELISA法[16]檢測犬弓首蛔蟲抗體以確保所有的幼犬均無犬弓首蛔蟲感染,并飼養于廣州醫藥研究總院有限公司的大動物GLP實驗室中。這些幼犬被平均分成3組:感染后0.5 d組、感染后1 d組和感染后36 d組,每組包括試驗和對照各3只幼犬。試驗組的幼犬灌服300個感染性的蟲卵,來模擬自然感染,而對照組的幼犬灌服相同劑量的生理鹽水。感染后0.5、1及36 d,用EDTA-K2分別采集幼犬血液來檢查幼犬的嗜酸性粒細胞。使用Zoletil 50(Virbac,法國)將幼犬進行全身麻醉,用KCl溶液注射入心臟內進行人道猝死。然后采集幼犬肝并用生理鹽水沖洗掉表面的血液,取10 g的肝組織剪碎,置于-80 ℃液氮中保存,用于提取組織總RNA。
1.3 比格犬肝組織總RNA的提取
用液氮將-80 ℃冷凍保存的18個幼犬肝組織研磨成粉末,用TRIzol(Life Technologies,美國)提取組織總RNA,然后用DNase I(NEB,美國)除去肝組織總RNA中的基因組DNA。采用1%的瓊脂糖凝膠法來檢測肝組織RNA的降解情況。使用NanoPhotometer?分光光度計(IMPLEN,CA,USA)檢測RNA純度。對于初篩合格的肝組織RNA樣品,分別使用Qubit?2.0 Flurometer(Life Technologies,美國)和Agilent生物分析儀2100系統(Agilent Technologies,美國)評估肝組織總RNA的濃度和完整性。之后,對RNA完整性(RNA integrity number,RIN)≥8的樣品進行后續分析[17]。
1.4 circRNA文庫的構建及鑒定
吸取5 μg每個肝樣品的總RNA用于構建RNA測序文庫。使用Epicentre RibozeroTMrRNA Removal試劑盒(Epicentre,USA)去除核糖體RNA,用乙醇沉淀法清除rRNA殘留。然后用RNase R進行線性RNA酶切(Epicentre,美國)。選擇150~200 bp的cDNA片段,用AMPure XP系統(Beckman Coulter,Beverly,USA)進行純化。然后用3 μL USER Enzyme(NEB,美國)進行片段大小的篩選,與選擇尺寸的接頭連接的cDNA在37 ℃ 下連接15 min,然后在95 ℃下連接5 min,用高保真DNA聚合酶、通用PCR引物和指數(X)引物進行PCR擴增。最后對產物進行純化(AMPure XP系統),并在安瑞倫生物分析儀2100系統上進行文庫質量評估。測序文庫由針對Illumina?(NEB,美國)的NEBNext?UltraTM定向RNA文庫準備試劑盒并按照制造商的說明構建,并利用HiSeq 4000測序平臺構建18個肝樣品的circRNA測序文庫,生成150 bp的配對端序列[18]。高通量測序(illumina HiSeq 4000)測序得到的原始圖像數據文件經堿基識別(base calling)分析轉化為測序序列(raw reads),結果以FASTQ(簡稱為fq)文件格式存儲。所獲序列去除帶有接頭、ploy-N和低質量的reads (來自原始reads),以獲得有效reads (clean reads)。然后從Ensembl數據庫中下載Canislupusfamiliaris基因組和注釋文件(CanFam3.1)。使用bowtie2 v2.2.8[19]建立參照基因組指數,并使用Bowtie將配對末端clean reads與參照基因組對齊。映射到的reads被刪除,未映射的reads包括拼接連接對齊的reads,由find_circ[20]和CIRI2[21]軟件進一步處理。最后,識別出含有剪接位點對齊reads的circRNAs。選擇兩種算法的交集進行circRNAs的預測。
1.5 circRNAs的定量、差異分析及差異circRNAs序列親緣關系進化分析
通過每百萬條reads的轉錄本(transcripts per million reads,TPM)[22]的表達水平來評估circRNAs相對表達量。試驗組和對照組的肝circRNAs的差異表達量采用DESeq2軟件進行分析,默認以Pvalue值0.05為差異表達閾值。對差異的circRNAs序列進行親緣關系的進化樹比較,在Tamura-Nei模型的基礎上,利用極大似然法(maximum likelihood)對其演化歷史進行了推斷[23]。利用雙參數遺傳距離模型在MEGA7軟件上構建系統發育樹[24]。使用引導分析(1 000次重復)對系統發育樹的穩健性進行評估,以評價差異circRNAs親緣關系[25]。
1.6 實時熒光定量PCR (qRT-PCR)驗證分析
為了驗證RNA-seq結果的準確性,隨機挑選9個差異性表達的circRNAs與1個管家基因進行熒光定量PCR(qRT-PCR)的驗證。利用Hiscript II Q RT SuperMix cDNA試劑盒(Vazyme,中國南京)合成了circRNA的第一鏈cDNA。采用ChamQ SYBR qPCR Master Mix qRT-PCR試劑盒(Vazyme,中國南京)進行qRT-PCR。反應條件包括95 ℃預變性30 s,95 ℃預變性10 s,60 ℃預變性30 s,40個循環,所有反應都進行了3次重復。此外進行解離曲線分析,以保證每個反應的特異性擴增。反應條件為95 ℃10 s,65 ℃1 min,從65 ℃逐步升高到95 ℃。使用內參基因GTI[26]對所有的circRNA表達量進行歸一化處理,用2-ΔΔCt方法[27]計算每個樣品中特定circRNAs的相對表達量。所有基因和引物見表1。

表1 用于環狀RNA的實時熒光定量PCR分析的引物Table 1 Primers used in circRNA specific quantitative real-time PCR (qRT-PCR)analysis
1.7 統計分析
使用 GraphPad Prism 8對qRT-PCR中基因表達的circRNAs差異結果進行分析,并用平均值±標準誤差(SEM)表示。
1.8 circRNA親本基因的功能分析
根據circRNAs與其來源基因(source gene)間的對應關系,對每組差異表達的circRNAs的來源基因進行功能預測,使用R包中的GOseq進行基因本體論(gene ontology,GO)的注釋分析[28],并分析這些差異表達的circRNAs在犬弓首蛔蟲感染幼犬中的生物學功能,包括3個分類:生物進程(biological process,BP)、細胞成分(cellular component,CC)和分子功能(molecular function,MF),Pvalue 小于0.05被認為是顯著注釋。通過 KEGG(kyoto encyclopedia of genes and genomes)Pathway顯著性富集確定circRNAs的來源基因參與的最主要生化代謝途徑和信號轉導途徑[29]。
1.9 倫理道德
本研究經中國農業科學院蘭州獸醫研究所動物倫理委員會批準(編號:2018-015)。試驗用比格犬按照國家和地方有關實驗動物福利倫理規定的要求進行操作。
2 結 果
2.1 比格犬感染犬弓首蛔蟲后血清中嗜酸性粒細胞的變化
在感染后0.5 d,試驗組中的犬血清嗜酸性粒細胞的數量與對照組的犬相比顯著增加(P<0.05)(圖1)。

*.P<0.05圖1 感染組與對照組比格犬血清中的嗜酸性粒細胞的量Fig.1 Eosinophils level in serum of infected and control Beagle dogs
2.2 幼犬肝RNA數據及環狀RNA的差異表達
在本研究中從18只幼犬的肝樣本(3個感染階段:0.5、1、和36 d)中獲得了2 119 950 482個raw reads、2 068 104 062個clean reads和310.22 Gb clean reads。Clean reads中GC和Q30的平均值分別為52.47% 和93.73%。在感染后0.5 d,試驗組與對照組相比,共有94個差異的circRNAs,其中包括55個上調的circRNAs,39個下調的circRNAs(圖2A);在感染后1 d,共鑒定到103個差異的circRNAs,其中包括61個上調的circRNAs,42個下調的circRNAs(圖2B);在感染后36 d,共鑒定到84個差異的circRNAs,其中包括47個上調的circRNAs,37個下調的circRNAs(圖2C)。但是在3個感染階段,沒有發現共同的差異circRNAs(圖3)。此外在3個感染階段隨機篩選出10個差異的circRNAs構建系統進化樹,來評估各階段犬肝的差異circRNAs親緣關系(圖4)。

圖2 差異表達環狀RNA的火山圖Fig.2 Volcano plot of the differentially expressed (DE)circRNAs
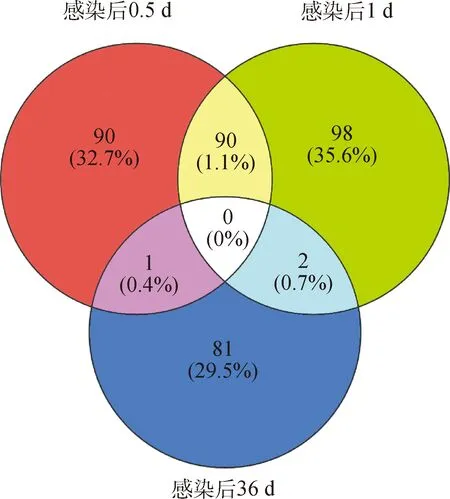
圖3 差異表達環狀RNA的維恩圖Fig.3 Venn diagram of the differentially expressed (DE)circRNAs

進化樹系按比例繪制,用每個位點的替換次數來衡量分支長度。分析涉及30個核苷酸序列。密碼子定位為1+、2+、3+及非編碼。消除所有包含間隙和缺失數據的定位。最終的數據集中共有111個定位The tree is drawn to scale,with branch lengths measured in the number of substitutions per site.The analysis involved 30 nucleotide sequences.Codon positions included were 1 st+2nd+3rd+Noncoding.All positions containing gaps and missing data were eliminated.There were a total of 111 positions in the final dataset圖4 3個感染階段部分差異表達環狀RNA的系統進化樹Fig.4 Phylogenetic tree of partial differential expression of circRNAs at three stages of infection
2.3 實時熒光定量PCR驗證
隨機挑選了9個差異的circRNAs進行表達趨勢驗證,如圖5。其中轉錄組測序結果為4個上調和3個下調的circRNAs,與qRT-PCR檢測表達趨勢一致,進一步驗證了轉錄組測序結果的可靠性。

y軸表示環狀RNA與管家基因GTI表達水平的相對變化,x軸顯示用于表達分析交叉驗證的9個環狀RNAs的名稱The y-axis shows the relative change of circRNA levels expressed compared with the control GTI gene.The x-axis shows the name of the nine circRNAs used in the cross-validation of expression analysis圖5 差異表達環狀RNA的實時熒光定量PCR驗證Fig.5 qRT-PCR validation of the differentially expressed (DE)circRNAs
2.4 差異性表達的環狀RNAs的GO注釋和KEGG富集分析
通過GO注釋分析發現,在犬弓首蛔蟲感染后0.5 d,共有415個GO條目中被顯著富集(P<0.05)。差異的circRNAs主要與“化合物代謝生物過程”“細胞器組成相關”(見OSID開放科學數據與內容附圖1A);在感染后1 d,共涉及768顯著富集的條目。差異的circRNAs主要與“調節中性粒細胞介導生物過程”“連接酶的活動分子功能”相關(見OSID開放科學數據與內容附圖1B);在感染后36 d,有344個GO條目被顯著富集。差異的circRNAs主要與“胞內部分細胞組成”相關(見OSID開放科學數據與內容附圖1C)。另外,作者篩選出一些與免疫或炎癥相關的GO條目(P<0.05),而這些條目大部分富集在感染后1 d(圖6)。并主要與“固有免疫”“中性粒細胞介導”和“細胞因子的產生”進程相關(圖6)。在犬弓首蛔蟲感染后0.5 d,novel_circ_0016108、novel_circ_0016184和novel_circ_0027468參與固有免疫進程;在感染后1 d,novel_circ_0002212與中性粒細胞介導作用過程相關;在感染后36 d,novel_circ_0002091、novel_circ_0014164、novel_circ_0019985、novel_circ_0023071和novel_circ_0023218主要參與細胞因子的產生進程。
KEGG富集分析表明,在感染后0.5 d,2條KEGG信號通路被顯著富集,如“促性腺激素釋放激素信號通路”“丙型肝炎通路”(圖7A)。其中novel_circ_0025586、novel_circ_0016800和novel_circ_0024378與“丙型肝炎通路”相關;在感染后1 d,有4條通路被顯著富集(P<0.05),如“丙酮酸代謝”“精氨酸和脯氨酸代謝”“核糖體在真核細胞中生物合成作用”和“脂肪酸的生物合成”通路(圖7B)。其中novel_circ_0002212和novel_circ_0019907涉及“精氨酸和脯氨酸代謝”通路;在犬弓首蛔蟲感染后36 d,有6條通路被顯著富集,如“泛醌及其他萜醌類生物合成”“軍團桿菌病”“血小板激活”“泛素介導的蛋白水解作用”“抗壞血酸和醛酸代謝”和“類固醇生物合成”通路(圖7C)。其中novel_circ_0019985和novel_circ_0001521與軍團桿菌病通路相關。

A、B和C.代表靶基因在感染后0.5、1和36 d顯著富集的與免疫或炎癥相關的基因本體(GO)術語。y軸左側代表靶基因個數,右側代表P value值。x軸表示基因本體(GO)術語A,B and C.Represent the significantly enriched immunity-or inflammation-related differential GO terms at 0.5 dpi,1 dpi and 36 dpi.The left y-axis shows the numbers of target genes,and the right y-axis shows the P value.The x-axis shows the Gene Ontology (GO)terms of the source gene圖6 與免疫或炎癥相關的差異環狀RNA的GO條目Fig.6 The enriched immunity-or inflammation-related differential GO terms of the differentially expressed (DE)circRNAs

A、B和C.代表靶基因在感染后0.5、1和36 d的差異環狀RNA親本基因富集的信號通路。y軸左側代表信號通路,右側矩形代表-lg P value 值,黑色圓圈表示靶基因數目,x軸表示靶基因比率A,B and C.Represent the signaling pathways enriched by the source genes of differentially expressed (DE)circRNAs at 0.5 dpi,1 dpi and 36 dpi.The left y-axis shows the signaling pathways,and the right rectangle shows the -lg P value,and the black circle shows gene numbers.The x-axis shows the Gene Ontology (GO)terms of the source gene圖7 前20個差異環狀RNA親本基因富集的信號通路Fig.7 The top 20 signaling pathways enriched by the source genes of differentially expressed (DE)circRNAs
3 討 論
犬弓首蛔蟲是一種被忽視的寄生性蠕蟲,它可以導致人體弓蛔蟲病,如內臟和眼睛幼蟲移行癥以及明顯的免疫病理反應等。目前的治療手段主要是藥物,而對犬弓首蛔蟲病疫苗研究仍十分有限[30]。circRNAs是一類新興的內源性非編碼RNA,因其不具有5′端帽子和3′端poly(A)尾結構,所以能夠穩定地存在于各種類型的真核細胞中[31]。circRNAs能夠吸附miRNAs發揮海綿(sponge)作用,從而在轉錄后水平調控基因表達[14]。研究表明,circRNAs在生物的生長發育、脅迫應答、疾病發生和發展等方面發揮重要作用,并顯示出其在疾病診斷標記物等方面的應用潛力[31]。因此本研究對犬弓首蛔蟲不同感染階段的比格犬肝的circRNAs轉錄本變化進行研究,分析其差異表達的circRNA,預測其來源基因的生物功能,從而為闡明犬弓首蛔蟲與終宿主之間相互作用的機制提供基礎數據。
本研究中,在犬弓首蛔蟲感染的過程中大部分差異的circRNAs被上調。這表明,在犬弓首蛔蟲感染比格犬期間,犬肝的circRNAs受到正向調控,從而參與犬弓首蛔蟲的感染過程。通過對差異的circRNAs序列親緣關系的進化樹比較,發現在犬弓首蛔蟲感染的不同階段,肝差異的circRNAs的親緣關系不強。另外隨著犬弓首蛔蟲感染的不同階段,犬肝的生物學進程也發生了改變,這說明犬弓首蛔蟲感染比格犬后肝的生物學功能發生改變可能與circRNAs表達量的改變有關。據文獻報道,大部分犬弓首蛔蟲幼蟲在終末宿主(犬)體內,在24 h移行到肝,可引起肝劇烈的免疫反應[32]。這也進一步解釋了為什么大部分與炎癥或免疫相關的GO條目被顯著富集在感染后1 d。此外,在感染后0.5 d,與免疫或炎癥相關的GO條目主要與固有免疫相關,這說明犬弓首蛔蟲在感染后0.5 d時可引起宿主肝的天然免疫反應。而作者推測novel_circ_0016108、novel_circ_0016184和novel_circ_0027468可能參與了犬弓首蛔蟲引起的宿主肝的天然免疫反應相關,但其作用機制仍需進一步研究。中性粒細胞是免疫防御所必需的多功能先天效應細胞,在防御的同時也會引起炎癥反應。有試驗證明在缺乏中性粒細胞或中性粒細胞遷移或功能受損的小鼠中,實驗性誘導的關節炎沒有發生[33-34]。類似的研究表明,中性粒細胞是介導多種免疫疾病如神經炎癥和結腸炎中關鍵的效應因子[35-36],是一種重要的藥物靶點。而在本研究中,在感染后1 d,大部分與免疫或炎癥相關的通路是與中性粒細胞介導相關,這也說明中性粒細胞在犬弓首蛔蟲感染的過程中發揮著重要作用。并且novel_circ_0002212可能參與了犬弓首蛔蟲引起的肝炎癥反應,并可能成為治療該炎癥的潛在藥物靶點。細胞因子一般通過與相應的細胞表面受體結合發揮其免疫調節作用,包括調節細胞增殖分化、激活先天和獲得性免疫應答,參與促炎和抗炎反應機制等。而本研究中,在感染后36 d,novel_circ_0002091、novel_circ_0014164、novel_circ_0019985、novel_circ_0023071和novel_circ_0023218參與細胞因子的產生過程。這說明在犬弓首蛔蟲感染比格犬后期,這幾種新鑒定到的環狀RNA在肝的免疫反應中發揮著重要作用。
丙型肝炎可以觸發多種信號通路誘導宿主先天免疫應答,并可以利用自噬抑制先天免疫反應[37]。KEGG富集分析發現在感染后0.5 d,環狀RNA novel_circ_0025586、novel_circ_001680和novel_circ_0024378與“丙型肝炎通路”顯著相關。這說明這三種circRNAs,可能與犬弓蛔蟲感染引起宿主肝的先天免疫反應有一定的聯系。在利什曼原蟲感染過程中,L-精氨酸代謝可調節免疫應答和炎癥反應[38-39]。精氨酸代謝在宿主防御以及生長和分化中發揮作用。精氨酸代謝可以使機體在受傷后24~72 h內誘導型一氧化氮合酶(iNOS)達到高峰,并產生瓜氨酸和一氧化氮(NO)。一氧化氮對微生物和寄生蟲是有毒的,可以抵抗寄生蟲的增殖[40]。因此我們猜測,在感染后1 d,大部分移行到肝處的幼蟲[32]導致肝損傷,從而促使精氨酸代謝上調,釋放NO來抵抗犬弓首蛔蟲侵襲。但這仍需要后續試驗進一步驗證。然而,在本研究中,novel_circ_0002212和novel_circ_0019907與“精氨酸和脯氨酸的代謝”通路有密切聯系。這說明這兩種環狀RNA可能在宿主肝抵抗犬弓首蛔蟲侵襲的過程中發揮著重要作用。在軍團桿菌病通路中,有一種半胱氨酸蛋白酶Caspase-3(Casp3),它在細胞凋亡和炎癥反應中發揮作用,在Casp3敲除的小鼠中,炎癥基因表達被上調,出現輕度脾腫大和腎炎癥[41]。作者之前的研究發現,Caspase-3在犬弓首蛔蟲感染宿主的肺后被上調了15.6倍,在犬弓首蛔蟲感染的過程中發揮抗炎的作用[11]。這些研究表明,軍團桿菌病通路可能與犬肝抵抗犬弓首蛔蟲的感染有關。在感染后36 d,novel_circ_0019985和novel_circ_0001521參與“軍團桿菌病”通路,提示這兩種circRNAs可能與犬肝抵抗犬弓首蛔蟲的感染的抗炎作用有關。
4 結 論
本研究結果表明,犬弓首蛔蟲感染會引起比格犬肝的circRNAs表達譜的改變,這些差異的circRNAs參與宿主肝的免疫或者炎癥反應。這些發現也為后續研究circRNAs在犬弓首蛔蟲致病機制中的作用提供了參考。

