LncRNA SNHG15對子宮內膜癌細胞增殖及去集蛋白-金屬蛋白酶17表達的影響
王秋宇 朱軍義 許 靜 郭 哲 孫慧霞 姜 平
(南陽市中心醫院 南陽 473000)
子宮內膜癌是雌性激素及非雄性激素誘導的疾病。以往研究顯示,人體子宮內膜屬于動態結構的組織,當發病癌變時,癌細胞能夠快速侵襲周旁組織,產生新腫瘤病灶[1]。子宮內膜癌具體的發病機制仍不清楚,尋找致癌基因及有效靶向治療方法對于揭示子宮內膜癌發生發展具有重要作用[2]。小核仁RNA宿主基因15(small nucleolar RNA host gene 15,lncRNA SNHG15)屬于lncRNA,位于人體染色體7p13,包含百余個轉錄本,在胃癌、肺癌等惡性腫瘤中表達顯著升高,通過調節多種信號通路介導細胞遷移等生物活性[3]。去集蛋白-金屬蛋白酶17(adisintegrin and metalloproteinase 17,ADAM17)是近年新發現的多功能的的表面糖蛋白,通過EGFR-PI3K-Akt 途徑促進癌細胞增殖及遷移[4]。LncRNA SNHG15 在子宮內膜癌中研究機制暫無報道。本研究探討lncRNA SNHG15 對子宮內膜癌細胞的作用及對ADAM17 基因的影響。
1 材料和方法
1.1 子宮內膜癌組織樣本收集
選擇2018年12月~2019年12月南陽市中心醫院通過病理確診,經外科手術的12 例子宮內膜癌患者組織及癌旁3 cm 的正常組織。患者外科手術前均未接受化學治療,組織存于液氮中保存。本研究通過醫院倫理委員會規定,并取得患者同意。
1.2 PCR 檢測子宮內膜癌組織中及細胞中lncRNA SNHG15 水平
利用TRIzol 法檢測子宮內膜癌組織及癌旁組織和細胞中總RNA,利用PrimeScript cDNA 轉錄合成cDNA,獲得反體系,進行熒光定量PCR 反應,以GAPDH 為內參,根據Ct 值計算子宮內膜癌組織 中lncRNA SNHG15 水 平,lncRNA SNHG15 上游引物序列為5'-CCTAGTGAGGAGTGGAGCTG A-3',下游引物序列為5'-CTCATTCTGGAAGCAG AGAACC-3';內參GAPDH 上游引物序列為5'-GTC GGTGTGAACGGATTTG-3',下游引物序列為5'-AAGATGGTGATGGGCTTCC-3',用2-△△Ct法計量表達量。
1.3 細胞株、主要試劑
Ishikawa細胞及RPMI1640培養基(上海一基實業);Lipofectamine 2000 (美國 Thermofisher 公司);lncRNA SNHG15-siRNA及對照物NC-siRNA(上海吉瑪生物);兔抗人ADAM17多克隆抗體(北京來福賽思科技生物);CCK-8(上海慧穎生物科技)。
1.4 細胞培養
將低溫冷藏的Ishikawa 細胞,快速移入37℃水中溶解,離心后,離棄上清液,加入培養基,5%CO237.5℃培養,貼壁生長,1~2 d 更換新的培養液。細胞生長到90%時,加入蛋白液消化,傳代保存,以備后用。
1.5 細胞轉染及分組
將5×103個的細胞平鋪到16 孔板中,按照Lipofectamine 2000 說明書進行轉染,分別將lncRNA SNHG15-siRNA 及NC-siRNA 轉染到Ishikawa 細胞中,37.5 ℃,5%CO2繼續培養。分為EC 組、NC 組及實驗組,EC 組為無干預的Ishikawa 細胞,NC 組為Ishikawa 細胞轉染lncRNA SNHG15si-NC,實驗組為Ishikawa 細胞轉染lncRNA SNHG15-siRNA。將數量為1×104個 的Ishikawa 細胞接種到96 孔中,15 h 后,待Ishikawa細胞重復融合,在EP 管中放入200 μL 轉染液體和4 μL 脂質體,后加入5 μg 的lncRNA SNHG15-siRNA,充分混合后,轉染9 h 后,用含血清、雙抗的培養液繼續培養。
1.6 CCK-8 檢測Ishikawa 細胞活力
各組Ishikawa 細胞加入蛋白酶消化,按照數量5×103接種到96 孔板中,每孔200 μL,置于37.5℃,5%CO2培養,每組設置6 孔,培養0、24、48 h 及72 h 后,加入100 μL 10%的CCK-8 培養基,37.5℃,5%CO2下培養3 h,酶標儀450 nm 下計算細胞活力,計算公式細胞活力(%)=實驗組450 nm 吸光度/對照組450 nm 吸光度×100%.
1.7 Transwell 小室檢測Ishikawa 細胞侵襲能力
50 mg/L 的基質膠稀釋后加入小室上層,37℃下呈凝膠狀態,Ishikawa 細胞數目為1×105/mL,上室中加入細胞懸液,下室中加入少量胎牛血清培養基,拭去殘留細胞,0.1%結晶紫染色,計算Ishikawa 細胞侵襲的數量。
1.8 流式細胞儀檢測Ishikawa 細胞凋亡
對數生長的Ishikawa 細胞加入PBS 溶液中,予以洗滌,再離心,5 min,運用100 μL 結合緩沖液,對細胞進行重懸,用 5 μL 標記FITC 的Annexin Ⅴ與5 μL PI 染色混勻,無光條件下,孵育15 min 后注入400 μL 結合緩沖液混勻,予以洗滌,次數3 次,記錄細胞凋亡情況。
1.9 免疫印跡檢測兔抗人ADAMl7 蛋白水平
取對數生長Ishikawa 細胞,胰蛋白酶消化,高速離心后,保留血清樣本。進行電泳,PVDF 膜TBS 浸泡10 min,反復PBS 沖洗,每次5 min,分別加入兔抗人單克隆抗體兔抗人ADAM17、GAPDH 抗體(1∶500 )、過氧化物酶標記二抗(1∶2 000),分別雜交,PBS 沖洗。后將膜浸入ECL 工作液,隨后進行檢測,獲取圖像。
1.10 統計學處理
采用SPSS 23.0 軟件對數據進行分析,子宮內膜癌組織及癌旁組織中lncRNA SNHG15 水平,Ishikawa 細胞活性、凋亡、侵襲及ADAM17 蛋白水平指標結果采用±s表示,組間比較用t檢驗,3 組間比較采用方差分析,P<0.05 表示差異有統計學意義。
2 結果
2.1 子宮內膜癌組織及癌旁組織中lncRNA SNHG15水平
lncRNA SNHG15 在子宮內膜癌癌旁組織和癌組織的表達量分別為1.00±0.06、2.15±0.23,在子宮內膜癌組織中水平顯著高于癌旁組織(P<0.05)。
2.2 各組Ishikawa 中lncRNA SNHG15 水平
EC 組、NC 組及實驗組中lncRNA SNHG15 水平分別為1.00±0.00、0.98±0.03 和0.52±0.09,實驗組中lncRNA SNHG15 顯著低于EC 組和NC組,差異有統計學意義(P<0.05),說明轉染成功。
2.3 各組Ishikawa 細胞活力
CCK-8 檢測結果顯示,0、24、48、72 h 時,EC 組及NC 組Ishikawa 細胞活力OD 值比較均無差異(P>0.05);24、48、72 h 時,實驗組與EC 組相比,Ishikawa 細胞活力OD 值明顯降低(P<0.05),表明敲低lncRNA SNHG15 能夠抑制Ishikawa 細胞活力(表1)。
表1 各組Ishikawa 細胞活力OD 值(±s)
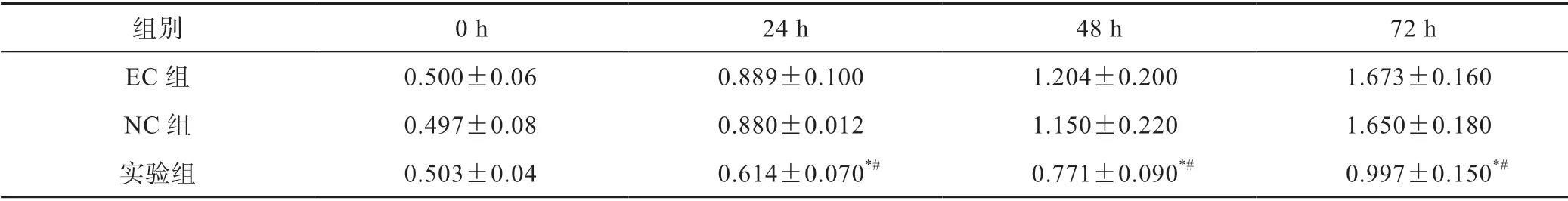
表1 各組Ishikawa 細胞活力OD 值(±s)
*P<0.05 vs EC 組;#P<0.05 vs NC 組
組別 0 h 24 h 48 h 72 h EC 組 0.500±0.06 0.889±0.100 1.204±0.200 1.673±0.160 NC 組 0.497±0.08 0.880±0.012 1.150±0.220 1.650±0.180實驗組 0.503±0.04 0.614±0.070*# 0.771±0.090*# 0.997±0.150*#
2.4 各組Ishikawa 細胞侵襲數目
Transwell 小室檢測結果顯示,EC 組,NC 組及實驗組Ishikawa 細胞侵襲數分別為(79.67±8.79)個,(76.02±9.30)個及(33.26±4.30)個,3 組比較差異有統計學意義(P<0.05),EC 組與NC 組侵襲數相比差異無統計學意義(P>0.05),實驗組Ishikawa 細胞侵襲數目低于EC 組及NC 組(P<0.05)(圖1)。
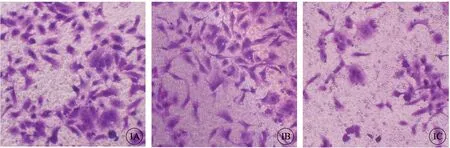
圖1 各組Ishikawa 細胞侵襲數目。A:EC 組;B:NC 組;C:實驗組.
2.5 Ishikawa 細胞凋亡率
流式細胞儀檢測結果顯示,EC 組、NC 組及實驗組細胞凋亡率分別(5.32±1.23)%、(6.21±1.15)%及(19.06±2.40)%,3 組比較差異有統計學意義(P<0.05),EC 組與NC 組細胞凋亡率相比差異無統計學意義(P>0.05),實驗組Ishikawa 細胞凋亡率高于EC 組及NC 組(P<0.05)(圖2)。

圖2 各組Ishikawa 細胞凋亡率。A:EC 組;B:NC 組;C:實驗組.
2.6 ADAM17 蛋白表達量
免疫印跡檢測結果顯示,EC 組、NC 組及實驗組子宮內膜癌中ADAM17 蛋白表達水平分別為1.00±0.12、0.97±0.15 及0.47±0.08,3 組間比較差異有統計學意義(P<0.05),EC 組與NC 組ADAM17 蛋白表達相比差異無統計學意義(P>0.05),實驗組ADAM17 蛋白表達低于EC 組及NC組(P<0.05)(圖3)。
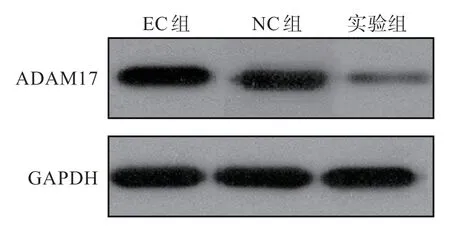
圖3 各組ADAM17 蛋白電泳圖
3 討論
LncRNA 是由聚合酶Ⅱ轉錄產生的長鏈非編碼RNA,無翻譯蛋白質作用,但對蛋白質翻譯后修飾等作用具有影響。隨著基因工程技術的問世,發現LncRNA 與多種疾病病理改變具有相關性[6-7]。lncRNA SNHG15 屬于lncRNA 其中之一,以往研究表明能夠對膠質瘤及甲狀腺癌細胞具有加快增殖的作用,但是對子宮內膜癌細胞的影響暫未見文獻報道。因此,本研究通過體外培養子宮內膜癌細胞轉染lncRNA SNHG15-siRNA 觀察其細胞活性,并探討其發生機制。
本研究通過收集本院外科手術切除子宮內膜癌組織及癌旁組織,通過PCR 檢測顯示,在子宮內膜癌組織中lncRNA SNHG15 表達顯著高于癌旁組織,說明lncRNA SNHG15 表達升高與子宮內膜癌患者癌細胞發生侵襲及轉移相關。LncRNA SNHG15 是一個被公認的lncRNA,染色體體7p13,包含837bp 轉錄本,是多種惡性腫瘤中潛在的分子標志物[9]。LncRNA SNHG15 在不同惡性腫瘤中發揮的作用存在差異,其產生與多因素、多基因及多通路相關[10]。LncRNA SNHG15 具有調節癌細胞生長及凋亡的能力[11]。在膠質瘤細胞中,轉染lncRNA SNHG15 模擬物能夠通過抑制miR-153 加快細胞遷移,當敲低lncRNA SNHG15 后miR-153水平升高,表示lncRNA SNHG15 能夠增加膠質瘤細胞活性與特異性結合血管內皮生長因子(VEGF)因子相關,加快腫瘤血管生長,惡化病情。在結腸癌細胞中敲低lncRNA SNHG15 能夠加快線粒體凋亡途徑,增加胃癌細胞凋亡的同時,具有抑制炎癥因子等作用[12]。在EC 中敲低lncRNA SNHG15,細胞增殖能力減弱,凋亡加劇,結果提示lncRNA SNHG15 與EC 增殖及侵襲密不可分,能夠通過多種信號調節子宮內膜癌基因。
ADAM17 是ADAM 超家族成員之一,位于人體染色體2p25,由824 個氨基酸組成,主要以非活化酶原形式存在,當受到外界刺激時,能夠產生EGFR 配體,通過生長因子介導EGFR 水平升高,發揮介導腫瘤細胞惡性侵襲、腫瘤血管生成等作用[13-14]。子宮內膜癌侵襲生理活動較強,可以發生腫瘤遠處轉移,其中腫瘤細胞粘連、基質內增殖等貫穿了整個侵襲的過程。ADAM 與腫瘤發生發展的關系已有眾多文獻,但是與子宮內膜癌之間的關系研究較少。子宮內膜癌發生發展機制首先是癌細胞之間黏附能力降低,減少接觸性抑制,后發生遠處轉移,ADAM17 在其中發揮重要作用,腫瘤細胞生成的重要基礎物質例如血管生成因子等均是ADAM17 重要底物,ADAM17 能夠減除細胞間的黏性作用,為子宮內膜癌發展發揮促進作用[15]。楊潔玉[16]研究表示,在EC 組織中ADAM17 呈現強陽性表達,顯著高于子宮內膜增生組織中ADAM17的水平,顯示其水平高低能夠直接反映子宮內膜癌病理分期及是否發生肌層浸潤等[17]。本研究結果顯示,實驗組EC通過敲低lncRNA SNHG15后免疫印跡檢測ADAM17水平顯著低于NC組及內膜癌組,說明敲低lncRNA SNHG15能夠抑制ADAM17表達,其機制可能在于抑制lncRNA SNHG15表達水平能夠降低子宮內膜癌血管生成,減少VEGF水平,間接抑制ADAM17活性[18]。在以往研究中[7],肝癌細胞的ADAM17能夠誘導TNF-α介導VEGF水平升高,活性肝癌細胞活性,加快侵襲,惡化病情,敲低lncRNA SNHG15水平能夠下調VEGF,從而改善腫瘤發生發展。LncRNA SNHG15降低后能夠改變子宮內膜癌細胞生物活性的機制也可能與調節線粒體信號通路相關,相關研究發現si-lncRNA SNHG15可下調Bcl-2和caspase-3表達水平,上調Bax、c-caspase3和Cyt-C表達水平,而同時抑制lncRNA SNHG15和miR-153表達可減弱抑制lncRNA SNHG15對Bcl-2、caspase-3、Bax、c-caspase3和Cyt-C 表達影響,提示lncRNA SNHG15調控miR-153對乳腺癌細胞凋亡影響可能是通過線粒體途徑實現的[19]。
本研究也有一定的不足,由于成本、時間等問題,未進行RNA 測序及生物信息學分析ADAM17包含的主要信號通路,可能產生的結果有一定偏差,存在局限性,在今后的研究中應加入更多的實驗方法為子宮內膜癌的治療提供更有力的實驗依據。綜上所述,敲低lncRNA SNHG15 能夠抑制子宮內膜癌細胞增殖及侵襲,凋亡加劇,作用機制可能與降低ADAM17 水平相關。

