阿昔洛韋對體外培養人眼Tenon囊成纖維細胞增殖遷移的影響
吳靖怡,吳志航,李淑婷,劉 瑤
?KEYWORDS:acyclovir; HTFs; cell proliferation; migration; apoptosis
0引言
青光眼是全球公認的視力喪失和失明主要原因之一。青光眼的主要治療方法是通過局部應用降眼壓藥物、激光治療或手術降低眼壓。青光眼的手術方法多種多樣。但是,小梁切除術是公認的青光眼的一線外科手術方法[1]。小梁切除術的遠期成功率較低的主要原因是術后濾過泡瘢痕的形成阻礙房水外引流[2-3]。目前術中使用抗代謝藥物如5-氟尿嘧啶(5-FU)和絲裂霉素-C(MMC)能夠部分減輕術后濾過泡的瘢痕愈合[4]。但是,5-FU和MMC的使用增加了濾過泡形成不良、濾過過暢、角膜緣干細胞功能的衰竭以及眼內炎等藥物相關并發癥的發生率[4-5]。多種抗病毒藥物已被報道通過不同機制直接參與細胞抑制和細胞毒性活動[6-7]。阿昔洛韋(ACV)是臨床常用抗病毒藥物,但是目前阿昔洛韋對人眼Tenon囊成纖維細胞(HTFs)的作用尚無相關研究。本研究應用ACV作用于體外培養HTFs,旨在探索ACV對成纖維細胞增殖和遷移影響,為減少青光眼術后濾過泡瘢痕化,提高青光眼濾過術的成功率提供新的思路。
1材料和方法
1.1材料本研究經蘇州大學附屬第三醫院倫理委員會審查通過并獲得患者及其家屬的知情同意。取玻璃體切除手術患者的Tenon囊組織,剪碎,加入0.25%膠原酶Ⅳ(美國Gibco公司),孵育2h;離心,加入胰蛋白酶(美國Gibco公司),孵育30min;200目濾網過濾,離心,加入培養基[含20%胎牛血清(美國Gibco公司),含1%雙抗(美國Gibco公司)的DMEM-F12(美國Gibco公司)];待細胞生長至培養皿80%時即可傳代。傳代后使用含10%胎牛血清,1%雙抗的DMEM-F12的培養基進行培養。取第3代細胞使用免疫熒光法進行細胞鑒定(免疫熒光顯微鏡及照相系統,德國Leica),免疫熒光一抗采用1∶300小鼠抗人單克隆抗體波形蛋白(美國Genetex),二抗采用1∶500山羊抗小鼠單克隆抗體(IgG)(美國Proteintech)。取3至5代細胞進行實驗。
1.2方法
1.2.1 CCK8檢測收集HTFs制成細胞懸液,接種于96孔板中;細胞貼壁后換無血清DMEM-F12培養24h;隨機分為ACV處理組,空白組以及標準組;ACV處理組加入ACV終濃度分別為0.45、1.125、2.25、3.375、4.5mmol/L的無血清培養基,空白組加入無血清培養基培養,標準組為無成纖維細胞孔加入無血清DMEM-F12培養基,培養72h;加入CCK8試劑,孵育4h;酶標儀(美國寶特公司)測定490nm處的吸光度(A490)。計算出不同濃度阿昔洛韋對HTFs的抑制率,抑制率=(實驗組A490值-標準組A490值)/(對照組A490值-標準組A490值)×100%。
1.2.2劃痕實驗收集HTFs制成細胞懸液,接種于6孔板中,待細胞長至90%時,換無血清培養基培養24h;100μL槍尖劃痕;隨機分為ACV處理組和空白組。ACV處理組加入ACV終濃度分別為2.25、4.5mmol/L的無血清培養基,空白組加入無血清培養基培養。0、72h取樣,拍照(相差顯微鏡,日本Olympus公司)。采用Image-J軟件計算細胞劃痕距。計算細胞遷移率,細胞遷移率(%)=(T0h寬度-T72h寬度)/T0h寬度×100%。
1.2.3流式細胞儀檢測收集4.5mmol/L ACV處理24h后HTFs和空白組細胞制成細胞懸液,分成兩部分,一部分加入YF488-Annexin V和PI工作液(Annexin V-FITC細胞凋亡檢測試劑盒, 美國EVERBRIGHT),避光孵育15min,測定細胞凋亡(流式細胞儀,美國BD),計算細胞凋亡率。另一部分細胞加入預冷75%乙醇,置于-4℃固定過夜。后加入碘化丙啶染色液(細胞周期檢測試劑盒,美國EVERBRIGHT),避光孵育15min,測定細胞周期(流式細胞儀,美國BD)。
統計學分析:采用Graphpad Prism 8統計學軟件進行統計學分析,連續變量采用均數±標準差表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t檢驗,兩組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2結果
2.1細胞免疫熒光鑒定酶消化法取原代HTFs,培養4~5d可見細胞貼壁,胞體呈梭型或不規則三角形,中央有卵圓形核,生長良好,符合HTFs形態;采用免疫熒光進行細胞鑒定培養的細胞為HTFs,免疫熒光顯微鏡下可見培養的細胞胞質中波形蛋白表達呈陽性,胞質內呈綠色染色,見圖1。
2.2 ACV對HTFs增殖的影響CCK8檢測顯示,不同濃度ACV作用于HTFs的A490值,差異有統計學意義(F=54.8,P<0.0001)。與空白組對比,ACV濃度為0.45mmol/L時,差異無統計學意義(t=0.4604,P=0.6551);當ACV濃度為1.125、2.25、3.375、4.5mmol/L時,差異有統計學意義(t=3.946,P=0.0027;t=4.660,P=0.0009;t=8.057,P<0.0001;t=12.95,P<0.0001),見表1。ACV濃度為1.125mmol/L與2.25、3.375、4.5mmol/L組間差異有統計學意義(P=0.004、=0.005、<0.0001、<0.0001)。結果顯示當ACV濃度達到1.125mmol/L時,開始對HTFs有抑制作用,并呈濃度依賴性。
2.3 ACV對HTFs遷移活性的影響劃痕實驗結果顯示,不同濃度ACV作用于HTFs的細胞遷移率,差異有統計學意義(F=15.23,P=0.0074),見表1。2.25、4.5mmol/L ACV組細胞遷移率與空白組比較差異有統計學意義(t=2.303,P=0.005;t=5.019,P=0.0074)。ACV濃度為2.25mmol/L與4.5mmol/L組間差異有統計學意義(t=3.495,P=0.025),見圖2、3。結果顯示ACV對HTFs的遷移活性有抑制作用,并且隨著ACV濃度的增加,抑制作用增強。
2.4 ACV對HTFs凋亡和細胞周期的影響經流式細胞儀檢測,空白組細胞凋亡率(2.29%±0.24%)與4.5mmol/L ACV處理組(7.35%±0.64%)比較差異有統計學意義(t=10.33,P=0.0005),見圖4。結果顯示4.5mmol/L ACV作用HTFs 24h后,HTFs細胞凋亡增加。經流式細胞儀檢測,空白組(G0/G1期59.97%±2.13%;S期23.64%±1.89%)與ACV處理組(G0/G1期74.8%±1.27%;S期8.77%±0.93%)比較差異有統計學意義(t=8.434,P=0.0011;t=9.953,P=0.0006),見圖5。結果顯示4.5mmol/L ACV作用HTFs 24h后,G0/G1期峰值升高,S期峰值下降,HTFs細胞周期阻滯于G0/G1期。
3討論
濾過泡瘢痕的生成主要由HTFs的異常增殖、以及其向肌成纖維細胞的轉化,分泌膠原和促纖維化因子的能力增強及細胞外基質的合成增多等引起[8]。目前術中使用抗代謝物減輕術后濾過泡的瘢痕的生成。但是,抗代謝物的使用增加了藥物相關并發癥的發生率[4-5]。因此,發現更安全有效的瘢痕抑制劑對提高青光眼濾過手術的遠期成功率有深刻意義。
目前,多項研究發現抗病毒藥物可通過抑制細胞增生和促進其凋亡參與細胞抑制。如西多福韋可以促進未感染病毒的間皮瘤細胞內促凋亡蛋白p53、caspase-3等的升高,生存蛋白Bcl-x的降低[9];利巴韋林可通過減少eIF4E靶點的mRNA輸出和蛋白表達從而抑制乳腺癌細胞的增殖[10]。已有研究證實抗病毒藥物IFNγ對HTFs的增殖具有明顯的抑制作用。IFNα-2b能夠通過減少HTFs中TGF-β1、TGF-β2的表達,從而減少Ⅰ型膠原蛋白及纖維連接蛋白的表達,參與抑制HTFs的增殖[11-12]。ACV是一種合成鳥苷類似物,作為傳統抗病毒藥物,阿昔洛韋滴眼液在眼科局部應用有長期臨床經驗,安全性高,耐受性良好[13-14]。Benedetti等[15]發現ACV可以抑制白血病細胞的活性并誘導其凋亡,并且用ACV預處理白血病細胞,可以增強細胞對5-FU的敏感性。但目前ACV對HTFs的作用尚無相關研究。
ACV微溶于水,在水中的溶解性為3.3~5.7mmol/L,隨著溫度的改變而改變[16-17]。本實驗中觀察到,當ACV濃度高于4.5mmol/L時,溶液有沉淀析出。因此,本實驗采用ACV最大濃度為4.5mmol/L。首先,本實驗通過CCK8證實ACV抑制HTFs增殖。選擇不同濃度ACV作用于HTFs,CCK8檢測結果顯示ACV對HTFs有抑制作用,并且隨著ACV濃度的增長,對HTFs的抑制作用逐漸增強。在后續的細胞凋亡和細胞周期檢測中,采用本實驗中ACV的最高藥物濃度4.5mmol/L。流式細胞儀檢測結果顯示,ACV處理后,HTFs細胞周期G0/G1期的峰值增高,S期下降,細胞周期阻滯于G0/G1期,并且細胞凋亡率明顯升高。提示ACV可能通過阻滯細胞周期,抑制HTFs的增殖,促進細胞凋亡。劃痕實驗結果顯示ACV對HTFs向周邊的遷移具有明顯的抑制作用。成纖維細胞可通過遷徙、增殖、分泌膠原等生物學行為參與創面修復過程[18]。因此通過減弱成纖維細胞遷移運動,進一步減少其增殖,可以減輕瘢痕的生成。有研究發現,小鼠腹腔注射ACV后,腎臟組織的VEGF及其受體以及成纖維細胞生長因子(FGF)表達水平降低[19]。提示ACV可以抑制VEGF及其受體的生成。VEGF被認為是血管內皮細胞生長最常見的刺激因子[20]。有研究發現VEGF及其受體在HTFs中呈高表達,VEGF可直接促進HTFs的增生和遷移[21]。Park等[22]研究表明,VEGF誘導TGF-β1蛋白的產生,并且呈劑量依賴性。TGF-β被認為是青光眼濾過術后瘢痕形成的關鍵因子。由此推測ACV可能通過抑制VEGF從而降低TGF-β1的水平,進而抑制HTFs的增殖,誘導其凋亡,與干擾素類似。
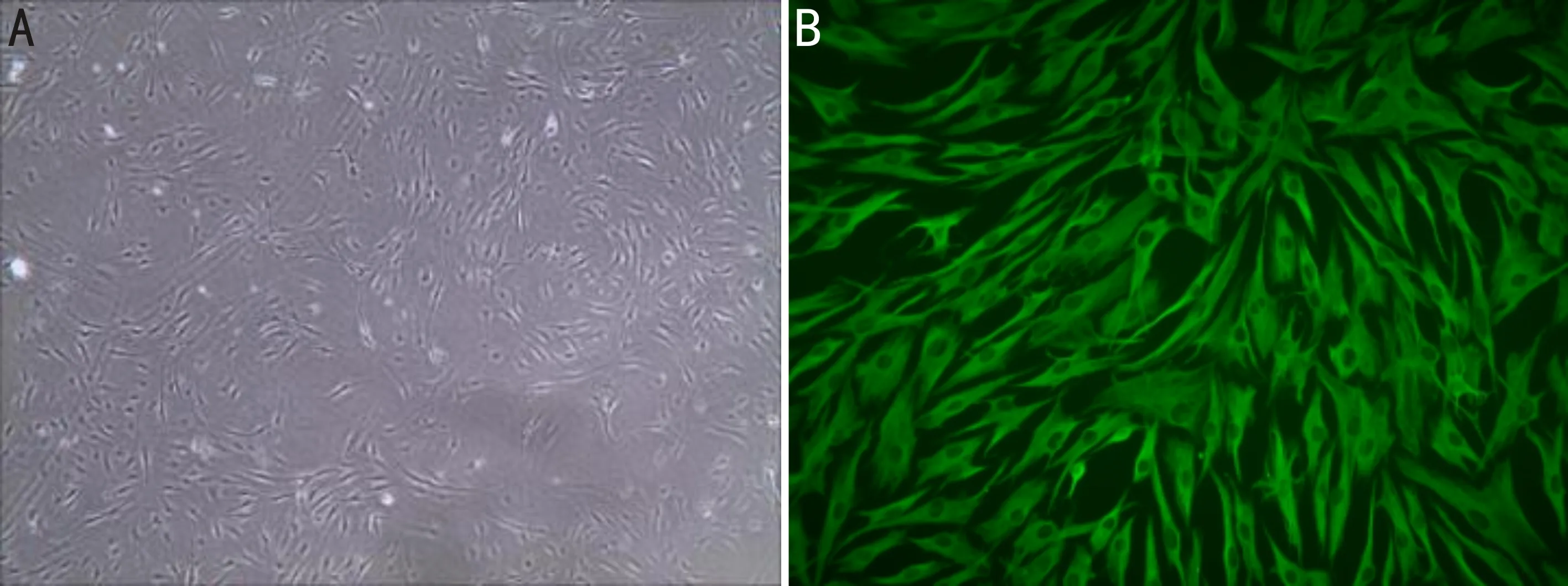
圖1 細胞免疫熒光鑒定結果 A:原代人Tenon囊成纖維細胞(×40);B:HTFs免疫熒光鑒定(×400)。

圖2 不同濃度ACV作用抑制HTFs的細胞遷移(×400)。

表1 不同濃度阿昔洛韋作用后對HTFs的抑制作用和遷移活性的影響
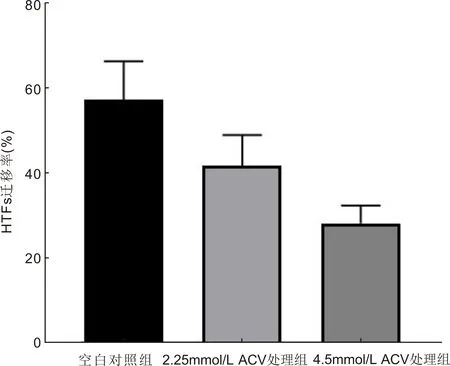
圖3 不同濃度ACV作用72h對HTFs遷移率的影響。
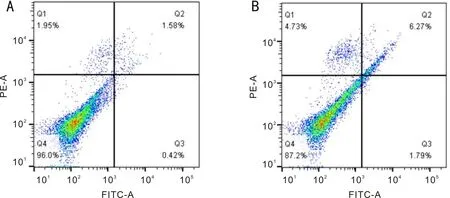
圖4 4.5mmol/L ACV誘導HTFs凋亡結果 A:空白對照組;B:4.5mmol/L ACV處理組。
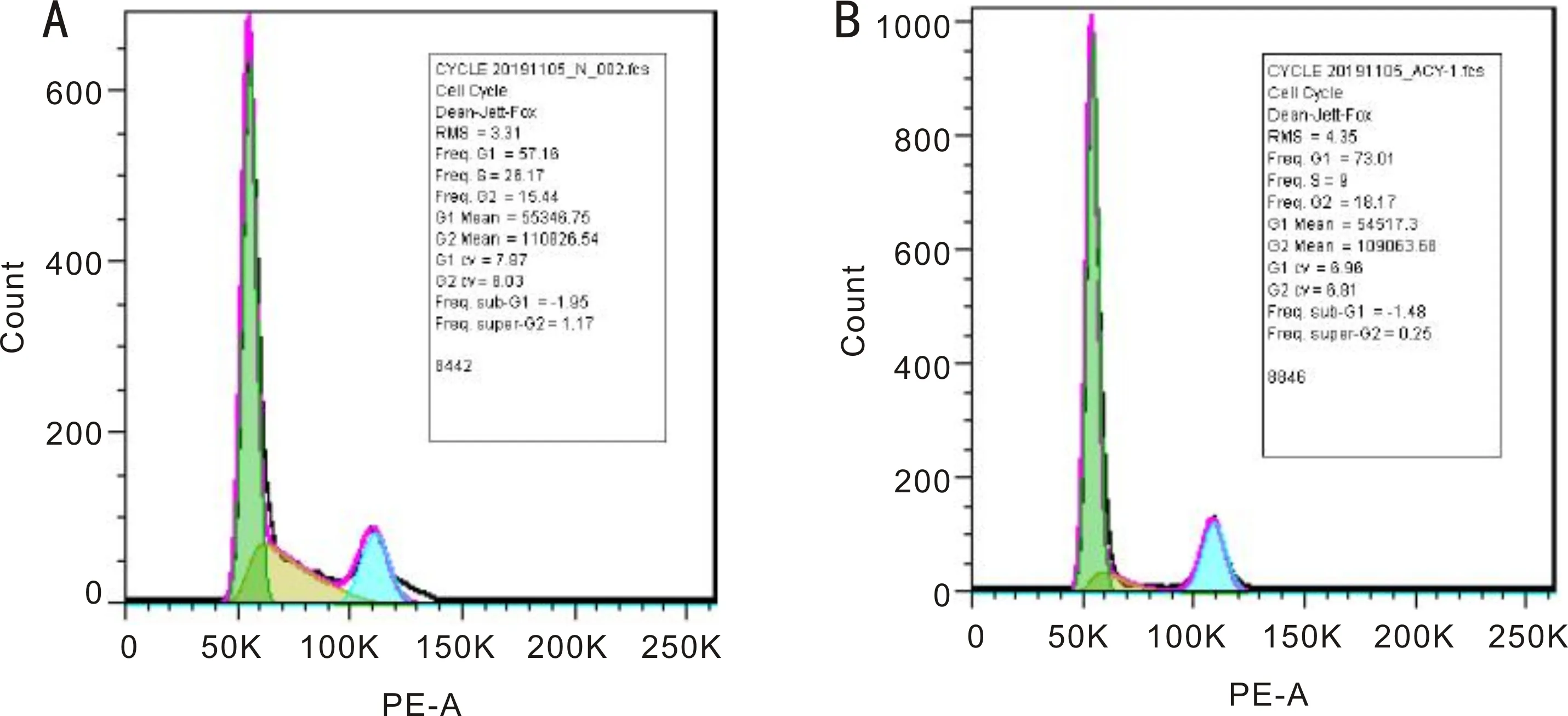
圖5 4.5mmol/L ACV阻滯HTFs細胞周期結果 A:空白對照組;B:4.5mmol/L ACV處理組。
綜上所述,通過本實驗可以得出如下初步結論:ACV可以通過誘導HTFs細胞周期阻滯,抑制HTFs的增殖,從而誘導其凋亡,并且能通過削弱HTFs的遷移能力抑制HTFs向周邊侵襲和轉移。這一研究結果有望應用于青光眼術后抑制濾過泡瘢痕化,為提高青光眼濾過術長期成功率提供新思路。本實驗未進一步深入探討ACV阻滯細胞周期的作用機制,其確切的信號通路有待進一步研究。并且ACV能否提高5-FU對于青光眼術后成纖維細胞的敏感性,有望在后續實驗中進一步深入探討。

