兩種三聚氯氰生產工藝的對比
姜龍,孫振民,袁媛,孫穎
(營口營新化工科技有限公司,遼寧 營口 115003)
三聚氯氰[(ClCN)3]外觀為白色結晶粉末,在空氣中不穩定,有揮發性,具有刺激性氣味,熔點154 ℃,沸點194 ℃,相對密度(20 ℃)1.32;溶于苯、熱乙醚、丙酮、乙腈、二氧六環、乙醇、醋酸、氯仿、四氯化碳等有機溶劑,不溶于水,遇水及堿易分解生成三聚氰酸,同時放出氯化氫氣體。由于三聚氯氰具有一個穩定的六元環和三個活潑的氯原子,可以被—OH、—NH、—SH、—NHR等官能團取代,生成多種衍生物,使得其在農藥、醫藥、橡膠助劑、熒光增白劑、紫外線穩定劑、抗氧劑、潤滑劑、紙張處理劑以及紡織助劑等多個領域具有廣泛的用途[1]。
三聚氯氰的工業生產方法主要有氰化鈉法和氫氰酸法兩種,兩種方法比較如下。
1 氰化鈉法生產工藝
以氰化鈉和氯氣為原料合成氯氰單體,再經過氣相催化聚合制得三聚氯氰。工藝過程為:將罐區送來的質量分數為30%左右的氰化鈉溶液配制成質量分數約為15%的水溶液,與氯氣按一定比例混合后,經過特制的噴嘴進入氯化反應器進行反應;同時進行氣液分離,生成的氣態氯氰單體經一級冷卻器用循環冷卻水進行冷卻脫水,再經過二級冷卻器用恒溫水冷卻脫水后進入三級氯化鈣干燥器進一步脫水干燥,使氯氰單體中的含水質量分數達到0.01%以下。干燥的氯氰單體進入聚合反應器,在催化劑活性炭的作用下生成氣態三聚氯氰,在約-20 ℃的冷空氣下結晶,生成粉末狀三聚氯氰產品;尾氣經過捕集器、尾氣吸收塔用堿吸收處理后,經尾氣風機送入煙囪排出。氯化反應產生的廢液中含有一定量的氯化鈉,此廢液進入解吸釜加熱至90~100 ℃,解吸得到的氯氰單體返回氯化反應器中;廢液送污水站進一步處理。不可再生的氯化鈣干燥劑經過一定使用周期后,加水排放,并進行更換。該法生產工藝成熟,裝置運行比較穩定、安全,但生產路線較長,“三廢”處理比較復雜,成本較高。目前我國主要采用該法生產三聚氯氰。
氰化鈉法生產三聚氯氰的簡易工藝流程如圖1所示。

圖1 氰化鈉法生產三聚氯氰工藝流程示意圖
2 氫氰酸法生產工藝
氫氰酸法生產三聚氯氰是目前世界上較先進的方法。液態氫氰酸和氯氣在氯化反應器中進行氣液反應,產生的氯氰氣體經過洗滌和恒溫水冷卻脫水后,進入水霧捕集器進一步脫水;然后通過硫酸鈣干燥劑干燥后,以氣態進入裝有活性炭催化劑的聚合反應器中生成三聚氯氰氣體;最后進入結晶器中,經過間接冷卻結晶得到固態三聚氯氰產品。含氯尾氣同樣經過噴淋吸收塔用堿液處理后,進入煙囪排放。氯化反應生成的反應液中含有一定量的鹽酸,此反應液進入汽提塔中加熱至100~115 ℃,得到的氯氰單體、氰化氫和氯氣等返回氯化反應器中;而濃縮后的含有微量氯化銨的鹽酸溶液作為副產品進行銷售或自用。
該方法在產品質量、收率、“三廢”排放、生產成本等方面都優于其他生產方法,并且易于規模化生產,因此,在國外氫氰酸法三聚氯氰生產工藝發展較快。由于氫氰酸是劇毒品,且容易聚積而產生爆炸,因此,在儲存、輸送和使用氫氰酸的過程中,對整個系統的密封性要求較高;另外,為防止氫氰酸聚合,要對氫氰酸管線用冷鹽水進行冷卻,使之溫度必須低于5 ℃,同時添加阻聚劑,使氫氰酸pH值≤5。
氫氰酸法生產三聚氯氰工藝流程如圖2所示。

圖2 氫氰酸法生產三聚氯氰工藝流程示意圖
3 兩種生產工藝的對比
氫氰酸一步法工藝比氰化鈉法生產工藝具有以下3個主要的優點。
3.1 節省原料氫氧化鈉溶液
由于生產氰化鈉須使用原料氫氧化鈉溶液,且氫氧化鈉溶液過量。因此,采用氫氰酸代替氰化鈉作為氯化反應的原料后,三聚氯氰的生產過程就不再消耗氫氧化鈉。
經計算可知,氰化鈉工藝生產1 t三聚氯氰消耗約2 730 kg的氰化鈉溶液(質量分數30%),則消耗質量分數30%的氫氧化鈉溶液2.28 t,因此,采用氫氰酸法生產1 t三聚氯氰節省質量分數30%的氫氧化鈉溶液2.28 t。
3.2 氯氣消耗更低
在氰化鈉法生產三聚氯氰工藝中,為了避免廢水里的氰根過高和產生黑色的廢水,甚至把過量氯控制在10%左右,生產1 t三聚氯氰消耗1.3 t氯氣;在氫氰酸和氯氣生產三聚氯氰的工藝中,能夠更好地控制過量氯氣的量,把過量氯控制在1%左右,生產1 t三聚氯氰消耗1.2 t氯氣。氯氣過量越多,不僅消耗越高,還會增加尾氣處理的成本。
3.3 不產生廢水
在氫氰酸法生產工藝中,生產1 t三聚氯氰產生3.3 t可銷售或自用的副產品鹽酸溶液(質量分數18%);采用氰化鈉法工藝,會產生高含鹽廢水。
3.3.1 氫氰酸法工藝的物料衡算
氫氰酸法工藝過程發生以下反應:

(ClCN)3+ClCN+4HCl (主反應);
(1)

NH4Cl+CO2(副反應)。
(2)
發生的總反應方程式:

(ClCN)3+CO2+4HCl+NH4Cl。
根據以上反應方程式可得表1物料平衡表。
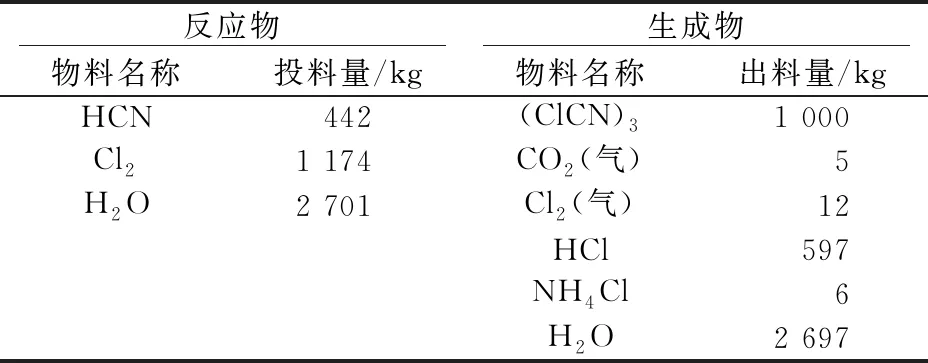
表1 氫氰酸法物料平衡表
對表1生成物進行計算可得:生產1 t三聚氯氰產生含質量分數0.2%氯化銨雜質的3.3 t 18%鹽酸溶液。
3.3.2 氰化鈉法工藝的物料衡算
采用氰化鈉和氯氣生產三聚氯氰的工藝過程發生以下反應:

(ClCN)3+ClCN+4NaCl(主反應);
(3)

NH4Cl+CO2(副反應);
(4)

NaCl+NaClO+H2O (副反應);
(5)
NaCN+NaClO

(6)
反應(5)發生的原因是氰化鈉溶液為了保持pH值在11~12而含有氫氧化鈉。
發生的總反應方程式為:

(ClCN)3+CO2+6NaCl+NaCNO+NH4Cl。
根據以上反應方程式可得表2物料平衡表。

表2 氰化鈉法物料平衡表
對表2生成物進行計算可得:生產1 t三聚氯氰會產生8 t含氯化鈉質量分數12.5%的含鹽廢水。
4 結語
采用氫氰酸代替氰化鈉與氯氣進行反應,不僅節省了堿液的消耗,還避免了高含鹽廢水的產生;而且該工藝產生的副產物18%鹽酸溶液,可以作為副產品出售或自用。另外,在氯化反應中,可以把過量氯氣控制在較低的水平,大大降低了氯氣的消耗。
該法由于使用劇毒品氫氰酸,液態氫氰酸泄漏到環境中變成氣體容易擴散,因此,生產中存在安全風險,要加強管理。

