基于HPLC-RID的花生籽仁可溶性糖含量檢測方法的建立
李威濤 郭建斌 喻博倫 徐思亮 陳海文 吳 貝 龔廷鋒 黃 莉 羅懷勇 陳玉寧 周小靜 劉 念 陳偉剛 姜慧芳
中國農業科學院油料作物研究所 / 農業農村部油料作物生物學與遺傳育種重點實驗室, 湖北武漢 430062
花生(Arachis hypogaeaL.)是我國重要的油料作物和經濟作物。花生籽仁富含蛋白質、脂肪、碳水化合物、維生素、白藜蘆醇、礦物質、植物營養素等[1], 深受人們喜愛。隨著生活水平的提高和營養科學的發展, 其較高的營養價值將會不斷的通過科學試驗被確認[2]。目前, 我國花生產量的 50%~60%用來榨油, 約 30%是食品工業的重要原材料[3]。國外對花生的利用與我國有很大的差別, 特別是美國和歐盟各國, 其花生總產的 70%~90%以上用于食用及食品加工[4]。近年來, 我國花生食品加工業發展迅速,食用花生的需求也呈逐年上升趨勢[5]。食用花生品質評價重要因素之一是口味, 包括甜度、香味、脆度、柔嫩度、細膩度、異味6個指標, 它直接影響花生的食用體驗及經濟價值[3]。其中甜度與籽仁中的可溶性糖含量緊密相關,可溶性糖主要有果糖、葡萄糖和蔗糖。研究表明, 甜度與花生籽仁的口味品質相關系數達 0.88, 花生籽仁中蔗糖含量達到 5%以上時, 口感較好[6]。目前, 我國關于食用型花生品種的培育及與之相關的品質性狀研究進展緩慢,尚未形成食用花生品種專用化[3]。對花生資源及育種后代材料進行可溶性糖含量快速準確測定, 一方面可以選育可溶性糖含量高的后代, 培育口感好的新品種, 提高育種的效率; 另一方面還可以將鑒定到的可溶性糖含量高和低的材料構建群體, 對花生籽仁中可溶性糖含量的積累機制進行深入的研究, 定位相關主效 QTL, 進而克隆基因并開發分子標記, 為甜花生高效的分子育種奠定基礎。
目前花生籽仁中的果糖、葡萄糖和蔗糖含量多采用比色法測定, 如3,5-二硝基水楊酸比色法、菲林試劑比色法等[6]。比色法檢測效率較低, 難以大規模應用, 而且比色法檢測糖含量的準確性低, 重復性差[7-8]。近年來也出現了應用紅外光譜法測定花生籽仁中的蔗糖含量, 雖可快速檢測蔗糖含量, 但需要復雜的前期工作, 需要先測出大量樣品的蔗糖含量來建立模型[9-11]。對蜂蜜[7-8]、洋蔥[12]、甘蔗[13]等的研究結果表明, 高效液相-示差折光法(HPLC-RID)可以同時分析樣品中果糖、葡萄糖和蔗糖的含量, 且檢測的準確性高, 前期樣品處理也簡單, 可大規模高效測定樣品中的可溶性糖含量。有關利用HPLC-RID快速測定花生可溶性含量的應用尚未見系統報道。本研究以花生為材料, 建立了利用 HPLC-RID快速測定花生籽仁中可溶性糖含量的方法, 旨在為花生資源可溶性糖含量的快速檢測及食用型花生高效育種奠定基礎。
1 材料與方法
1.1 試驗材料
本試驗選用20份花生品種, 其基本信息見表1。花生莢果收獲曬干后剝殼, 選取成熟飽滿、無發芽、無破損、無病斑的籽仁為試驗材料。
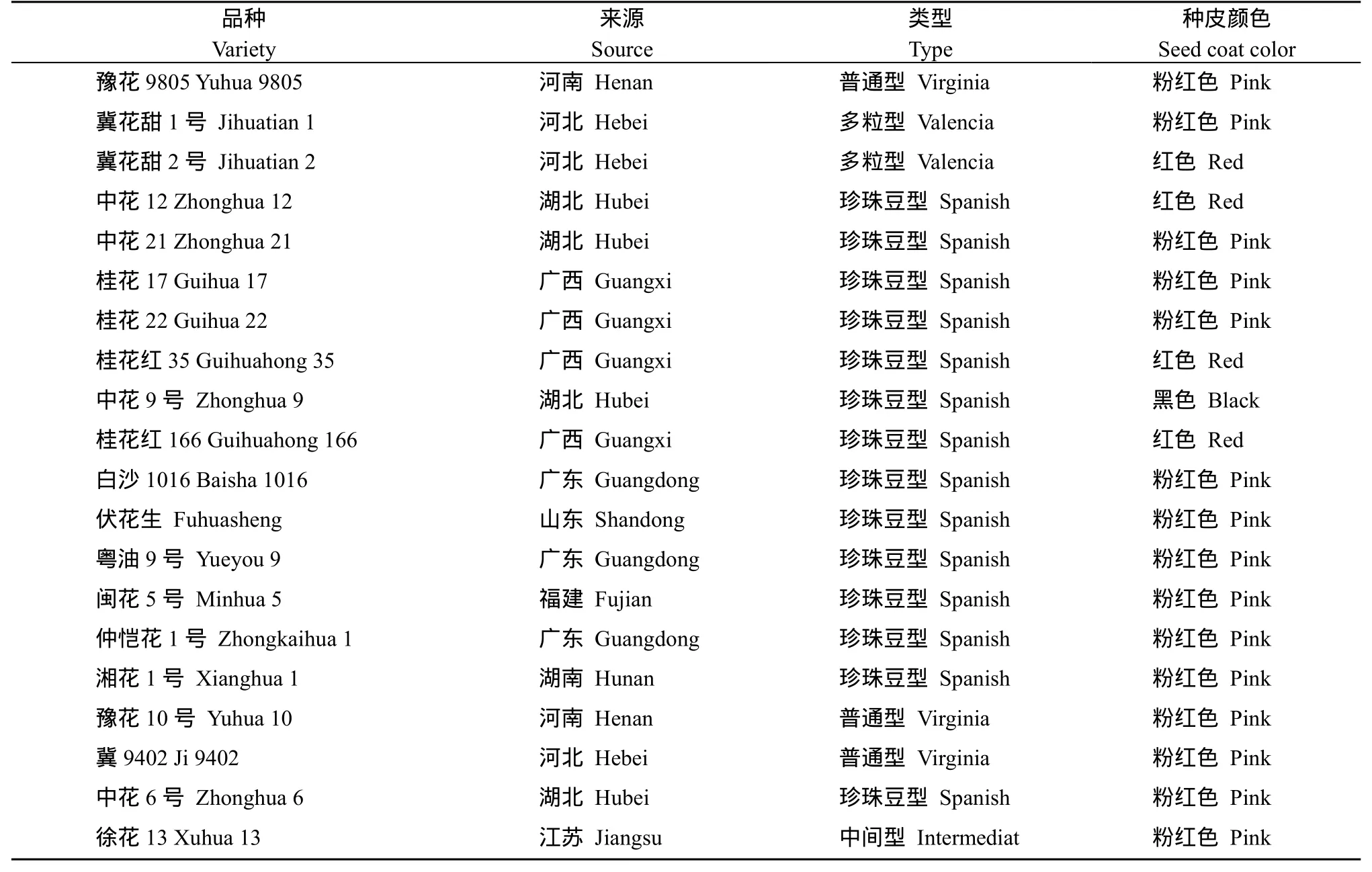
表1 試驗所用花生樣品Table 1 Peanut samples used in the study
1.2 樣品處理條件探索
將30粒花生籽仁樣品用粉碎機碎成粉末, 過20目篩,稱量1 g樣品至50 mL離心管中, 加一定量(10、15和20 mL)80%乙醇(乙醇∶水 = 80∶20)[14], 混勻后置于80℃水浴鍋中水浴, 期間每隔10 min混勻1次, 結束后冷卻至室溫,取上清液1.5 mL至2.0 mL離心管中, 12,000×g離心5 min, 然后用0.45 μm濾膜將樣液過濾入樣品瓶中供液相色譜測定。
1.3 色譜條件
本研究在楊成聰等[15]方法的基礎上, 略有調整, 選擇流動相中乙腈和水的體積比為75∶25, 流速0.8 mL min-1,進樣量10 μL, 檢測器和色譜柱溫度均為40℃, 進行色譜分析。
1.4 蔗糖含量的計算
蔗糖含量(mg g-1) = 測定的糖濃度(mg mL-1)×提取液體積(mL)。根據測定峰面積和標準曲線計算獲得測定的糖濃度。
1.5 重復性、精密度和加標回收率試驗
多次重復取樣, 按照1.2 (20 mL 80%乙醇)和1.3所述方法測定含糖量, 根據測定結果計算相對標準偏差(relative standard deviation, RSD)考察樣品重復性。對色譜分析樣品連續進樣多次, 測定可溶性糖含量, 通過計算測定結果的RSD考察試驗的精密度。按照1.2 (20 mL 80%乙醇)方法制備樣品, 依次加入不同體積的80%乙醇和糖儲備液, 按照1.3方法測定可溶性糖含量, 通過計算加標回收率考察試驗的準確性。加標回收率的計算公式如下:P=(c2-c1)/c3×100%, 其中P為加標回收率,c2為加標后測定可溶性糖濃度(mg g-1),c1為不加標測定的濃度(mg g-1),c3為加標量(mg)。
1.6 國標法測定花生籽仁中的可溶性糖含量
參照國標法(GB 5009.8-2016)中脂肪大于10%的食品的處理方法制備樣品, 利用高效液相色譜法測定可溶性糖含量。
2 結果與分析
2.1 標準曲線的繪制
通過材料與方法1.3確定的色譜條件檢測蔗糖標品發現, 基線平穩, 果糖和葡萄糖可以很好的分離(圖1-A)。分別取葡萄糖、果糖和蔗糖分析純2.5 g, 在80℃烘箱中烘干至恒重, 分別準確稱取烘干后葡萄糖、果糖和蔗糖2.0 g至100 mL容量瓶中, 加80%乙醇90 mL, 超聲助溶, 然后定容至100 mL, 配制成20 mg mL-1的糖儲備液, 4℃保存,按照表2配制標準液。以標準液濃度為橫坐標, 樣品峰面積為縱坐標繪制標準曲線, 得回歸方程, 葡萄糖y1=92225x–13864,R2 = 0.9991; 果糖y2= 81506x+10534,R2 =0.999; 蔗糖y3= 91367x+2270.2,R2= 0.9991。說明葡萄糖、果糖和蔗糖濃度在0.5~6.5 mg mL-1之間線性關系良好。
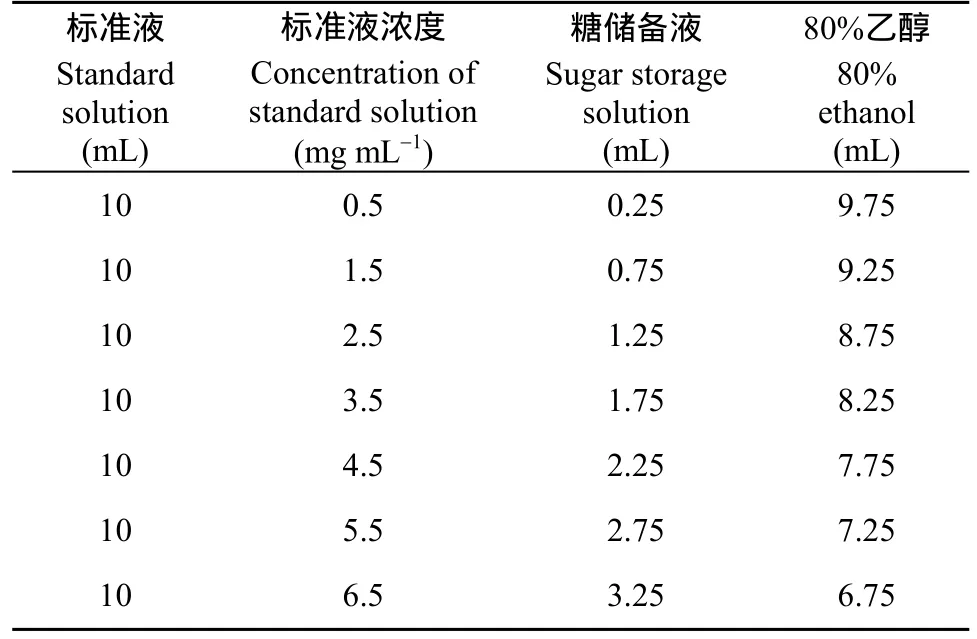
表2 蔗糖標準液的配制Table 2 Preparation of sucrose standard solution
2.2 樣品處理時間和提取液體積對測定結果的影響
將花生籽仁磨成粉末后, 分別加入10、15、20 mL的80%乙醇提取液, 分別在80℃水浴鍋中水浴30、35和40 min, 測定不同條件下的果糖、葡萄糖和蔗糖含量。在花生籽仁(中花12)中只檢測到蔗糖的存在, 果糖和葡萄糖沒有檢測到(圖1-B)。進一步對其他花生品種(徐花13、中花6號、中花21、中花9號等)的籽仁進行檢測, 仍然是只有蔗糖, 沒有檢測到果糖和葡萄糖。對不同處理中花12籽仁蔗糖的測定結果(表3)進行方差分析表明, 提取液的體積和水浴時間對蔗糖測定的結果影響不顯著(表4)。由于10 mL 80%乙醇, 水浴30 min比較經濟, 而且快速, 因此, 本試驗選擇10 mL 80%乙醇, 水浴30 min作為后續試驗條件。
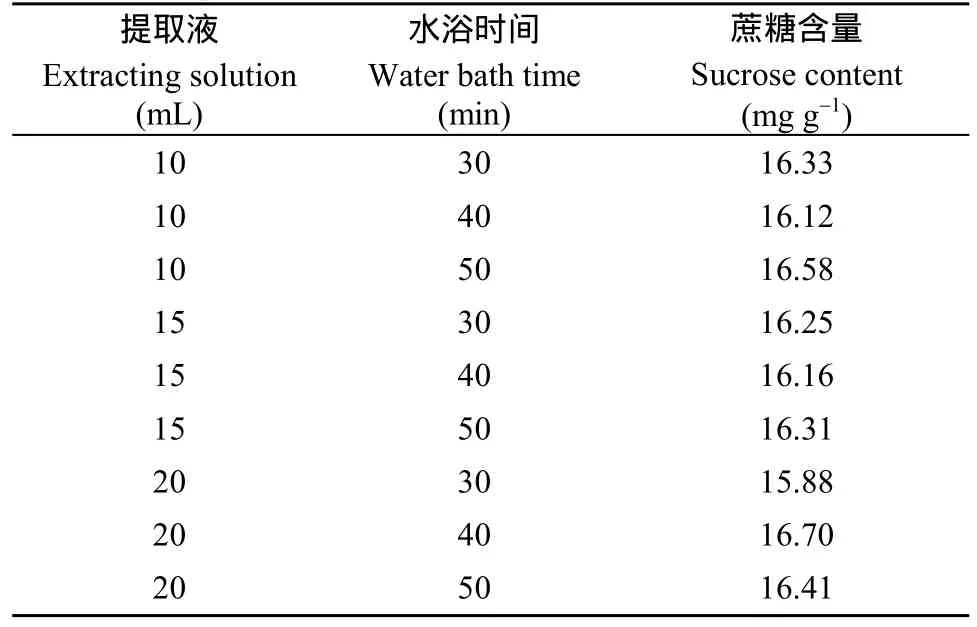
表3 不同處理時間和提取液體積下的蔗糖含量Table 3 Sucrose content under different treatment time and extraction liquid
2.3 方法的準確性驗證
2.3.1 方法的精密度試驗 將中花12籽仁研磨成細粉后, 按照1.2和2.2確定的樣品處理方法處理樣品, 然后對待測的同一樣品連續進樣10次, 測定峰面積, 并通過標準曲線計算蔗糖濃度, 通過1.4所示公式計算蔗糖含量, 進而計算相對標準偏差(RSD)考察測定的精密度, 得出蔗糖的RSD為0.59%, 精密度良好(表5)。
2.3.2 方法的重復性試驗 對中花12花生籽仁重復取樣6次, 按照1.2和2.2確定的樣品處理方法處理樣品, 然后測定峰面積, 通過標準曲線計算蔗糖濃度, 通過1.4所示公式計算蔗糖含量, 進而計算相對標準偏差(RSD)考察測定的精密度, 得出蔗糖的RSD為0.73%, 該方法的穩定性良好(表6)。
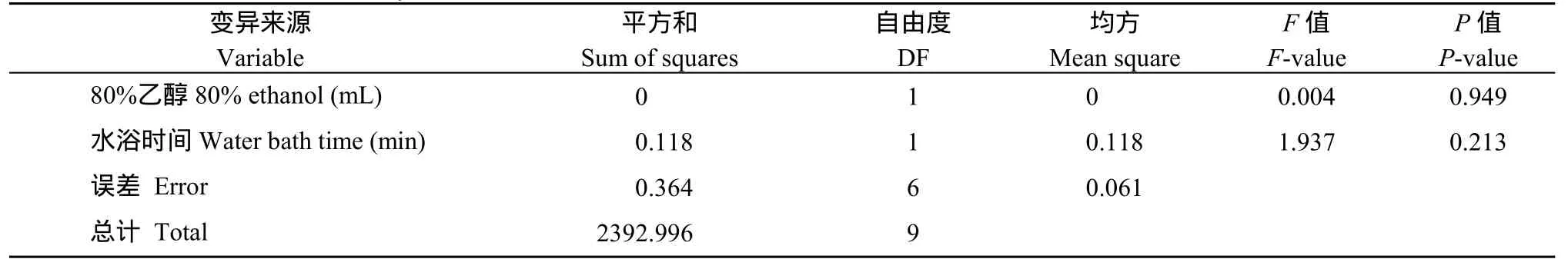
表4 方差分析結果Table 4 Results of ANOVA analysis

表5 精密度試驗結果Table 5 Results of precision test
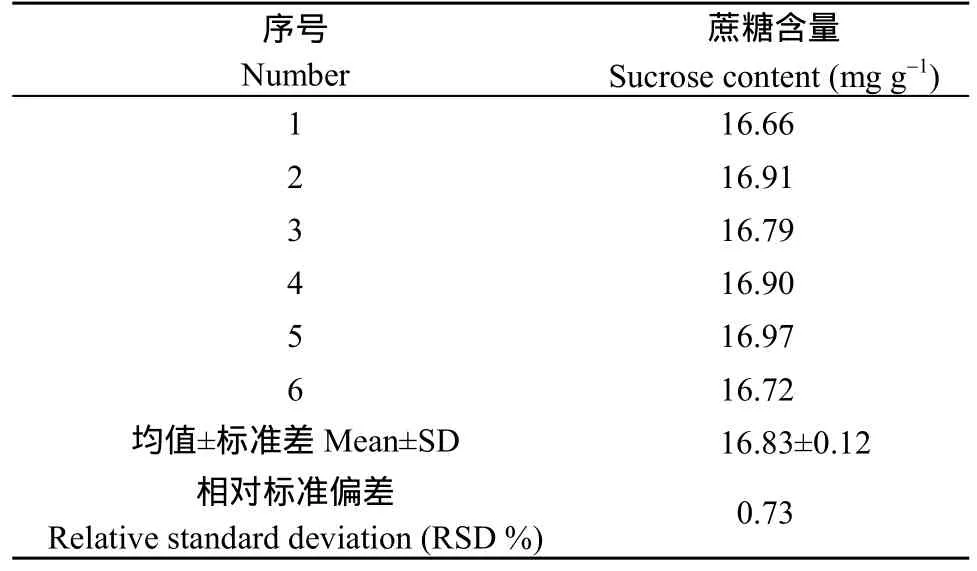
表6 重復性試驗結果Table 6 Result of repetitive test
2.3.3 加標回收率試驗 將中花12籽仁研磨成細粉,過20目篩, 稱取1 g至編號為1~4的50 mL離心管中, 依次加入80%乙醇20、19.5、19和18.5 mL, 然后在2~4號管中分別加0.5、1.0和1.5 mL糖儲備液, 然后按照1.2的方法提取可溶性糖并制備供色譜分析的樣品, 并按照1.3的色譜條件測可溶性糖含量, 通過計算加標回收率考察試驗的準確性。結果顯示加標后的平均回收率為97.6% (表7), 表明該方法準確可靠。
2.4 HPLC-RID和國標法測定蔗糖含量的結果比較
以本實驗室20份花生品種為材料, 用HPLC-RID法測定的蔗糖含量最高的品種為冀花甜1號 [(83.81±0.59) mg mL-1], 其次為冀9402 [(60.26±0.90) mg mL-1], 最低的為中花12 [(16.19±0.20) mg mL-1], 其次為豫花9805[(16.58±0.44) mg mL-1](表8)。通過國標法測定的蔗糖含量最高的品種為冀花甜1號 [(81.38±3.67) mg mL-1], 其次為冀9402 [(59.52±1.73) mg mL-1], 最低的為豫花9805[(15.60±0.75) mg mL-1], 其次為中花12 [(17.39±0.73) mg mL-1](表8)。由此可見, 2種方法鑒定出的蔗糖含量高和低的材料一致。將2種方法的測定結果進行相關性分析, 其相關系數為r= 0.99, 表明2種方法測定結果的相關性很高。另外, 經過配對樣本T檢驗分析可知,t= 0.774,P=0.448 > 0.05, 表明2種方法所測結果差異不顯著。綜上所述,HPLC-RID可以作為花生種子中蔗糖含量測定的有效方法。
3 討論
花生是我國傳統的油料作物, 近年來品質相關性狀研究工作主要集中在含油量[16-21]、脂肪酸[22-26]和蛋白質[27-31]上, 而有關花生籽仁中含糖量的研究鮮有報道。對花生品質的研究結果顯示, 甜度與花生的口味緊密相關[6],而甜味來源于花生籽仁中的可溶性糖(果糖、葡萄糖和蔗糖)。先前的研究結果顯示, 花生籽仁中存在果糖、葡萄糖和蔗糖, 且蔗糖是最主要的糖[32-37]。也有研究結果顯示,花生籽仁中主要含蔗糖, 而果糖和葡萄糖是在樣品處理過程當中產生的[14]。其測定結果的差異主要是由于樣品的不同處理方式造成的, 本方法采用80%乙醇(乙醇∶水= 80∶20) 80℃水浴30 min抽提花生籽仁中可溶性糖, 不會改變真實的糖成分及含量, 其結果顯示中花12成熟的花生籽仁中主要含蔗糖, 而果糖和葡萄糖并未檢測到。利用本研究摸索得到的條件對本實驗室其他花生品種徐花13、中花6號、中花21、中花9號等進行糖含量的測定, 結果也顯示籽仁中只檢測到蔗糖。其原因可能是成熟花生籽仁中果糖和葡萄糖的含量極小, 不能有效的被檢測。將未成熟的花生籽仁研磨成粉后, 利用該方法可同時檢測到果糖、葡萄糖和蔗糖的存在, 因此該方法可以有效地測定花生籽仁中3種可溶性糖的含量。綜合前人研究結果和本研究的結果, 蔗糖是花生籽仁中最主要也是含量最高的可溶性糖。其含量是影響花生口味的重要因素, 含量越高,口感越好。
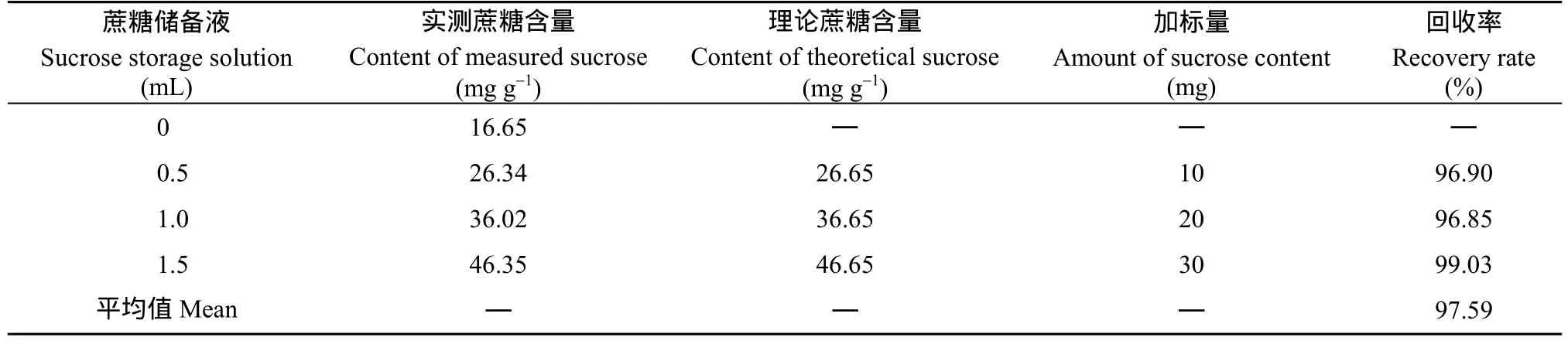
表7 加標回收率試驗結果Table 7 Results of spike recovery test
檢測花生籽仁中可溶性糖含量的方法有很多種, 如比色法、氣相色譜法、高效液相法。其中比色法步驟繁瑣且準確性較差[7-8]。氣相色譜雖然也可以測定不同糖的含量, 但是測定過程含將樣品置于三氟乙酸中加熱到70℃的轉化步驟, 這會導致部分低聚糖的降解, 導致檢測的結果與實際籽仁中糖的含量有明顯差別, 得出不符實際的結論[14]。近年來紅外光譜技術也在花生籽仁中含油量[38]、脂肪酸[39-41]、蛋白質[42]和糖含量[6]的測定得到了應用, 但測定之前需要根據參試樣品建立模型, 一旦建模完成, 也可以對大量育種材料進行可溶性糖含量的測定, 測定精度能滿足育種工作需要。利用國標法測定可溶性糖的樣品需要經過石油醚(沸程30~60℃)除去其中的油脂、蒸干、加水溶解以及乙酸鋅和亞鐵氰化鉀溶液沉淀蛋白質等復雜的處理步驟, 導致樣品測定效率較低。
本研究利用HPLC-RID建立了花生籽仁中果糖、葡萄糖和蔗糖的快速測定的方法。選擇提取溫度80℃, 以水浴時間和80%乙醇的體積為變量, 以測定的可溶性糖含量為指標, 探索出最佳的水浴時間為30 min, 提取液體積為10 mL, 在該條件下, 花生籽仁中的可溶性糖能完全溶解在80%乙醇中。HPLC-RID檢測可溶性糖一般用乙腈和水的混合溶劑作為流動相, 乙腈和水的比例變化會影響出峰時間和峰信號。乙腈在流動相中的比例增大可有效改善色譜峰形, 有利于果糖、葡萄糖和蔗糖的基線分離, 但糖在乙腈中的溶解度很小, 乙腈比例增大不利于糖的溶解,各組分出峰時間也顯著延長, 且峰信號較弱; 當增加流動相中水的比例時, 各組分出峰時間縮短, 峰信號增強, 但水的比例過大會造成果糖和葡萄糖基線不能分離, 影響結果[43]。流動相流速, 檢測器溫度和柱溫也會顯著影響各組分出峰時間和峰信號。該方法采用流動相乙腈和水的體積比為75∶25, 流速0.80 mL min-1, 進樣量10 μL, 檢測器和色譜柱溫度均為40℃時, 果糖、葡萄糖和蔗糖的基線在13 min內達到分離, 可以有效的進行可溶性糖含量的準確測定。
利用該方法在花生樣品中只檢測到蔗糖的存在, 精密性試驗相對標準偏差值為0.59%, 重復性試驗相對標準偏差值為0.73%, 平均回收率為97.59%, 說明測定結果穩定且準確。以該方法和國標法檢測本實驗室20份花生材料籽仁中的蔗糖含量表明, 成熟的花生籽仁中的蔗糖含量存在豐富的變異, 蔗糖含量最高的約是蔗糖含量最低的5倍。2種方法的測定結果相關性很高(r= 0.99), 樣本配對T檢驗的結果表明, 兩者的測定結果差異不顯著。由此可見, 本研究建立的方法結果準確可靠, 適用于花生籽仁中蔗糖含量的定量分析。有研究報道, 花生籽仁的甜味是可遺傳的性狀, 而蔗糖又是花生籽仁中最主要的可溶性糖[44], 因該方法可大規模快速準確測定蔗糖含量, 可以為甜花生資源篩選、花生籽仁中控制蔗糖含量關鍵基因的定位、分子標記的開發以及我國未來花生品質育種提供技術支持。

