紅心火龍果不同發育時期果肉呈色相關基因表達模式研究
趙國文 賈瑞宗 郭靜遠 郭安平
摘 ?要:火龍果屬于仙人掌科量天尺屬,是具有重要經濟和營養價值的熱帶水果之一,其果實富含花青素和甜菜紅素。在果實成熟后期甜菜紅素的大量積累引起紅心火龍果果實轉色的現象。果肉色澤是評價火龍果果實品質的重要指標之一,然而其果實轉色背后的基因表達調控模式并不清晰。深入研究火龍果果實發育過程中果肉顏色調控的分子機理有助于豐富火龍果品質形成的理論基礎。本研究以‘美紅一號’紅心火龍果為實驗材料,采集果實發育過程中9個不同時期的樣品,通過比較轉錄組學共識別了96種差異表達的基因,最后分析發現15個與色素代謝通路相關的基因在果實發育不同階段顯著差異表達。GO功能富集分析發現差異表達基因主要富集在與結合活性、催化活性、轉運活性和結構分子活性相關的功能分類上,且與色素代謝都有重要聯系;KEGG代謝途徑富集結果顯示,次生代謝物合成途徑、氨基酸和核酸代謝途徑、酪氨酸代謝途徑富集基因較多。利用實時熒光定量PCR技術對15個與色素相關的差異表達基因進行了驗證,其結果與轉錄組分析結果一致。生理分析和轉錄組分析結果表明,紅皮紅肉火龍果發育過程中伴隨大量甜菜色素的合成,且甜菜色素合成途徑中DODA基因逐漸上調,在果實轉色其中在P4時期明顯的上升趨勢,其它關鍵基因表達逐漸下調。本研究發掘火龍果中與果實轉色相關的相關基因,為后續火龍果遺傳改良提供了重要的目標基因和遺傳基礎。
關鍵詞:火龍果;果實轉色;轉錄組測序;基因挖掘;
中圖分類號:S667.9 ? ? ?文獻標識碼:A
Abstract: Pitaya belongs to the genus of Cactaceae and is one of the tropical fruits with important economic and nutri-tional value. Its fruits are rich in anthocyanins and betaine. In the late stage of fruit maturity, the accumulation of beta red pigment causes the phenomenon of red-hearted dragon fruit fruit color change. The color of the pulp is one of the important indicators to evaluate the quality of the dragon fruit. However, the gene expression regulation mode behind the color change of the fruit is unclear. In-depth study of the molecular mechanism of the color regulation of the pitaya fruit during the development of the dragon fruit will help to enrich the theoretical basis for the formation of pitaya quality. In this study, ‘Meihong No. 1’ red-hearted dragon fruit was used as the experimental material. Nine samples from different stages of fruit development were collected. A total of 96 differentially expressed genes were identified through comparative transcriptomics. Finally, 15 genes were found to be related to pigments. Genes related to metabolic pathways were significantly differentially expressed at different stages of fruit development. GO functional enrichment analysis found that differentially expressed genes were mainly enriched in functional classifications related to binding activity, catalytic activity, transport activity and structural molecule activity, and were importantly related to pigment metabolism. The results of KEGG metabolic pathway enrichment showed that there were many enriched genes in the biometabolite synthesis pathway, amino acid and nucleic acid metabolism pathway, and tyrosine metabolism pathway. Real-time fluorescent quantitative PCR technology was used to verify 15 the differentially expressed genes related to pigments, and the results were consistent with the results of transcriptome analysis. The results of physiological analysis and transcriptome analysis showed that the development of red skin and red flesh dragon fruit was accompanied by the synthesis of a large number of beet pigments, and the DODA gene in the beet pigment synthesis pathway was gradually up-regulated. During the fruit color change, there was an obvious upward trend in the P4 period. The expression of key genes is gradually down-regulated. This study explored the related genes related to fruit color change in dragon fruit, and provided an important target gene and genetic basis for subsequent genetic improvement of dragon fruit.
Keywords: dragon fruit; fruit color conversion; transcriptome sequencing; gene mining
DOI: 10.3969/j.issn.1000-2561.2021.11.0012
火龍果起源中美洲熱帶雨林地區,為仙人掌科量天尺屬,果實外形獨特,香甜多汁,含有花青素和蛋白質等多種成分,營養價值較高深受消費者的喜愛[1-3]。火龍果原產地在中美洲的墨西哥、古巴等地區[4],在我國火龍果的種植主要在南方的廣西、福建、云南、海南等地進行種植[5],為當地果農帶來了良好的經濟收益。紅皮紅肉(Hylocereus costaricensis)品種是一種新的改良品種[6],其果實呈近圓形,鱗片粗短,反卷似“蓮花座”,是火龍果的主要栽培品種[7]。目前,火龍果研究不僅在種植栽培、生物學特性、儲藏保鮮等方面進行;同時也在火龍果分子生物學、細胞生物學、色素提取[8-10]和植物病害[11-12]等方面取得了一定的進展。但火龍果基因組序列尚未報道,其分子生物學的研究仍受到較大限制。
火龍果根據其果皮果肉顏色分為紅皮白肉、紅皮紅肉和黃皮白肉3種[13]。市場上常見的品種是紅皮紅肉和紅皮白肉,紅皮紅肉更受到消費者喜愛。目前,火龍果色素生物合成途徑已基本明確,代謝途徑中的關鍵酶也已克隆分離,但對色素合成基因表達模式調控的研究還十分有限。因此,本研究以‘美紅一號’紅皮紅肉火龍果為實驗材料,進行轉錄組測序和后續分析,比較研究同一品種火龍果果肉在不同時期中基因的差異表達情況,對其進行相關的基因功能和代謝通路富集分析,篩選出差異表達基因,進一步對紅肉火龍果中色素的代謝差異進行初步分析。通過對篩選出的基因開展功能驗證實驗,可以為甜菜色素合成代謝提供可靠信息。
1 ?材料與方法
1.1 ?材料
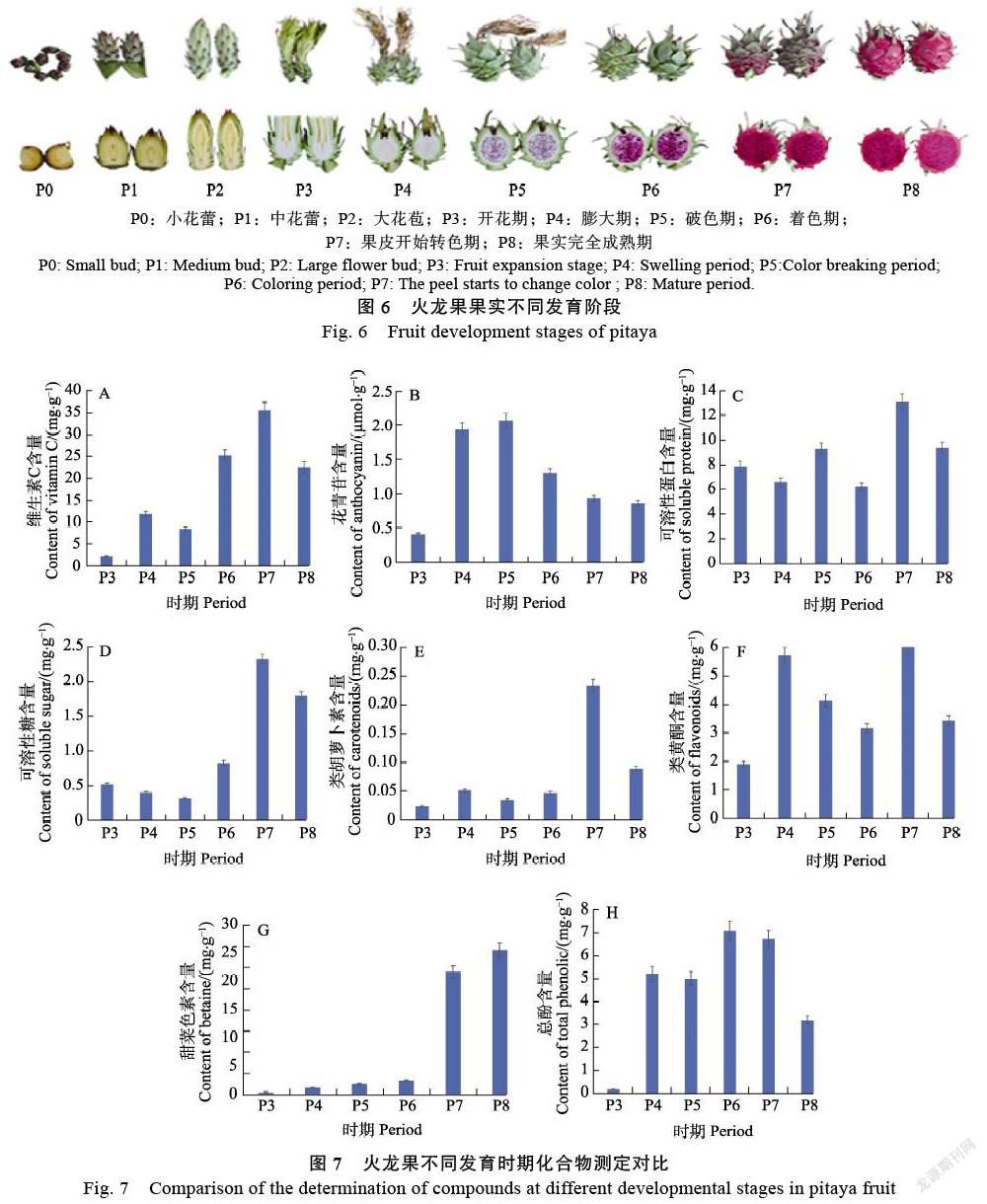
‘美紅一號’紅心火龍果(Hylocereus cos-taricensis)的P0:小花蕾;P1:中花蕾;P2:大花苞;P3:開花期;P4:膨大期;P5:破色期;P6:著色期;P7:果皮開始轉色期;P8:果實完全成熟期9個發育時期的果肉樣品的和根、莖、花、果皮和果肉5個不同組織的樣品。實驗材料來自海南省昌江市火龍果種植基地,現場取樣并用液氮進行速凍處理,每個個體設計3個生物學重復,總共42份樣品,存于–80 ℃冰箱。
1.2 ?方法
1.2.1 ?RNA提取與檢測 ?將火龍果果實9個不同發育時期果肉組織和不同組織部位樣品寄送至生工生物工程(上海)股份有限公司進行基于IlluminaHiSeqTM2000的轉錄組測序。樣品放入含有液氮的研缽成粉末,轉入放有裂解液的EP管中,采用CTAB法提取RNA[14]。取適量樣品進行檢測,于–80 ℃保存。RNA提取流程與檢測均委托生工生物工程(上海)股份有限公司。
1.2.2 ?文庫構建和測序 ?使用SMRT Link的Iso-Seq protocol進行全長轉錄本分析,將最終得到的高質量全長轉錄本用于后續分析。火龍果果肉樣品在PacBio Sequel平臺上測序,建立PacBio IsO-Seq文庫,獲得原始聚合酶read序列,去除read序列,使用SMRT分析套件進行reads of insert(ROI)、分類、聚類和校正,最終得到高質量的全長共有序列。將每個庫的高質量全長序列組合在一起,在沒有參考基因組的情況下,使用LoRDEC軟件利用Illumina二代數據對一致的轉錄本序列進行糾錯,去除聚集和糾錯的轉錄本。在PacBio RS sequel測序平臺是基于單分子實時(SMRT)的測序技術,環狀測序得到polymerase read。polymerase read中含有很多無效數據會對后續分析帶來嚴重干擾,如測序接頭序列,建庫長度的偏差,以及測序錯誤、低質量堿基、未測出的堿基等情況,因此需通過一些手段將上述無效數據過濾掉,以保證分析的正常進行。最終得到有效的subreads插入片段。
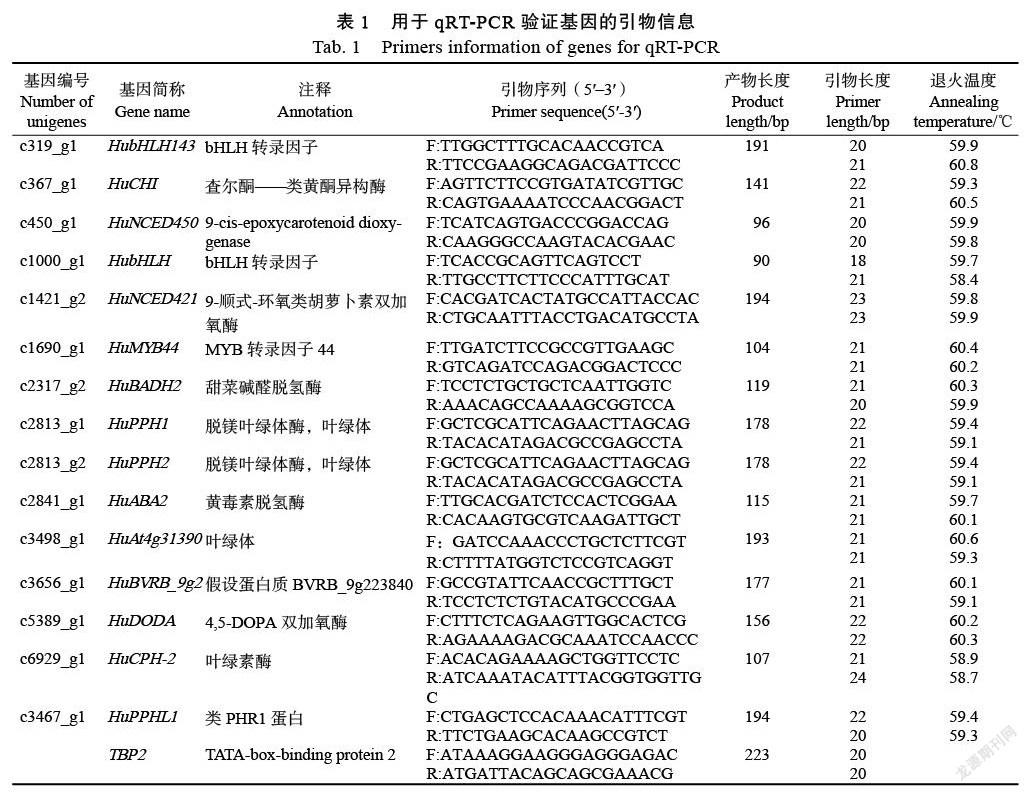
1.2.3 ?內參基因的選擇 ?內參基因在各種組織和細胞中的表達量相對恒定,常作為檢測基因表達水平變化的參考。其作用是校正上樣量和上樣過程中的實驗誤差,保證實驗結果的準確性。通過檢測每個樣品的內參量,可用于校正上樣誤差,使定量結果更加可靠。一般應選擇在加工因子條件下表達不發生變化的基因作為內參。本研究選擇TBP2作為內參基因(表1)。
1.2.4 ?轉錄組數據的處理 ?測序后,對得到的所有原始數據(raw data)進行分析,過濾后得到clean data,然后去除無效的低質量序列。進行PacBio測序數據評估,最終得到有效的subreads inserts。使用SMRT Link的Iso-Seq protocol進行全長轉錄本分析,并使用最終的高質量全長轉錄本進行后續分析。基于Swissprot、Nr、KOG、GO和KEGG數據庫,對所有轉錄本進行注釋,包括表達注釋和功能注釋,最終富集分析。
1.2.5 ?差異分析 ?用TPM方法計算轉錄本的表達水平。對于沒有生物學重復的樣本,先用TMM對read計數數據進行標準化,然后用DEGseq進行差異分析。為了獲得顯著差異的基因,設置篩選條件為:qValue<0.05和倍數差異|FoldChange|>2。顯著差異表達轉錄本的GO和Pathway富集分析。
1.2.6 ?qRT-PCR驗證 ?選擇火龍果TBP2基因作為內參基因,通過轉錄組數據分析,結合KEGG數據庫,篩選出甜菜途徑中色素相關轉錄因子、高表達基因和關鍵酶等15個unigenes進行qRT-PCR驗證篩選。引物設計使用引物5.0(表1),使用TB Green(TliRNaseH Plus)(Takara)試劑盒,將樣品放入實時熒光定量PCR儀(Mx3000P,Stratagene,美國)中完成反應,為防止技術失誤,每個反應做3次重復,結果用相對定量法分析(2–CT)。
2 ?結果與分析
2.1 ?轉錄組測序及質量評估
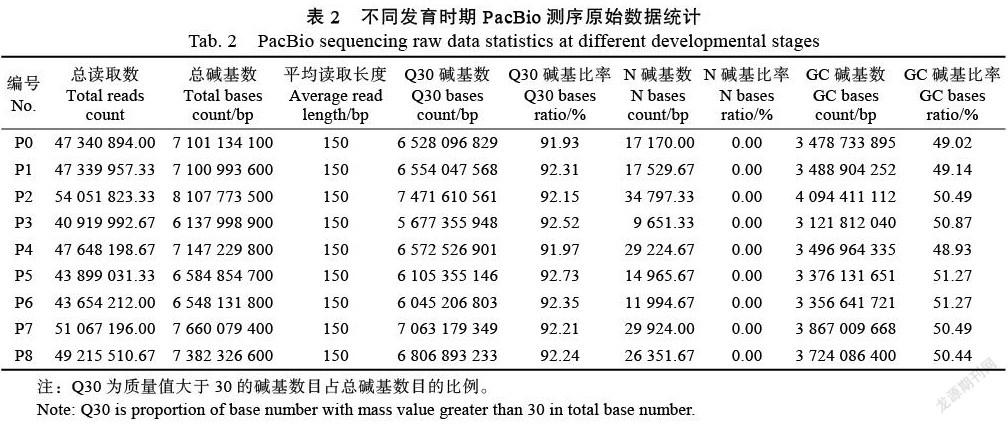
為了解析火龍果果肉著色機制,以紅心火龍果‘美紅一號’為研究對象,采集了果實9個不同發育時期(P0:小花蕾;P1:中花蕾;P2:大花苞;P3:開花期;P4:膨大期;P5破色期;P6:著色期;P7:果皮開始轉色期;P8:果實完全成熟期)的果肉樣品,進行轉錄組測序。利用CTAB法提取高質量RNA后構建插入片段為21 317 bp的cDNA文庫(3次生物學重復),并利用PacBio RS sequel測序平臺是基于單分子實時(SMRT)測序技術進行轉錄組測序。使用Trimmomatic對原始下機數據進行處理,去除原始數據中低質量、接頭污染以及未知堿基N含量過高的reads;質控后得到24 275條高質量reads,平均每個樣品的長度為2381.01。質量評估顯示用于后續轉錄組分析的數據質量Q30大于91.93%(表2),表明這批轉錄組數據質量值較高,能夠滿足后續數據分析需求。
對PacBio測序原始數據進行評估。使用SMRT Link的Iso-Seq protocol進行全長轉錄本分析,使用LoRDEC軟件利用Illumina二代數據對一致性轉錄本序列進行錯誤校正。其中去除reads長度小于35 nt的reads本身及其配對reads,且Q30均高于(91%),從整體上看,低質量(Quality<30)的堿基比例較低,說明測序質量較好。
2.2 ?基因功能注釋結果
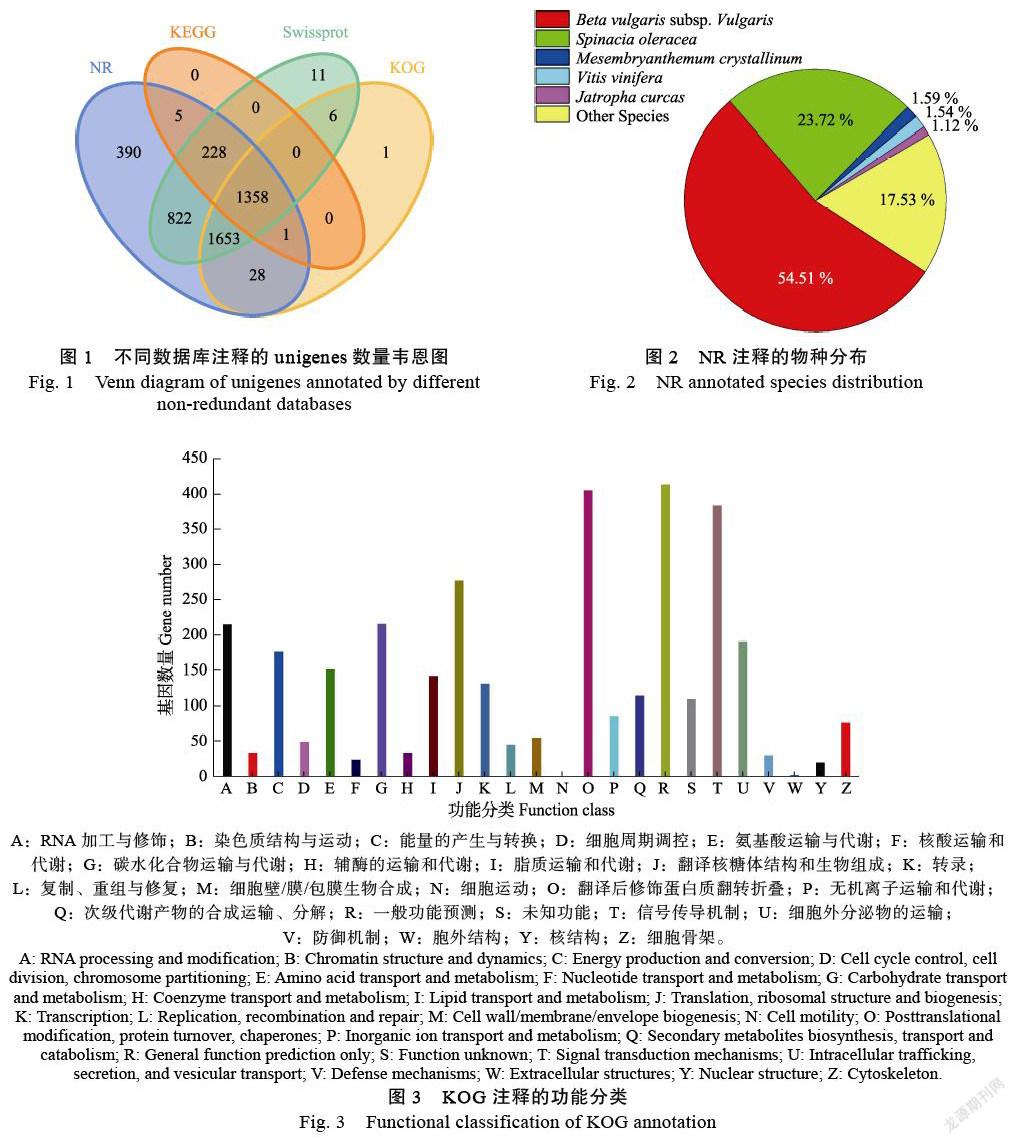
為了預測unigenes序列的功能信息,將24 275條unigenes序列分別在NR、SwissProt、KEGG和KOG數據庫進行BLAST比對(圖1)。根據NCBI Blast+,全長轉錄本模型與CDD、KOG、COG、NR、NT、PFAM、Swissprot、TrEMBL等多個數據庫進行對比篩選后總共有4626條序列能夠匹配到數據庫中,占全部unigenes序列19%。其中,NR數據庫4485條,Swissprot數據庫4078條,KOG數據庫3047條,KEGG數據庫1592條,四大數據庫同時注釋1358條序列。
在NR數據庫中進行物種比較分析(圖2),共比較了132個物種。前五名是:甜菜2441條(Beta vulgaris subsp. Vulgaris:54.51%)、菠菜1062條(Spinacia oleracea:23.72%)、非洲冰草71條(Mesembryanthemum crystallinum:1.59%)和葡萄69(Vitis vinifera:1.54%)、桐油樹50(Jatropha curcas:1.12%)。可以看出,火龍果和甜菜在基因序列上具有高度的同源性。KOG數據庫中基因同源物的比較分析(圖3),通過24個類別的比較,發現413個基因與一般功能預測相關,406個基因與翻譯后修飾、蛋白質轉運和分子伴侶相關十大類顯示這些蛋白質主要與基因轉錄、翻譯、蛋白質加工和細胞內轉運相關,與次級代謝產物相關的基因共115個。
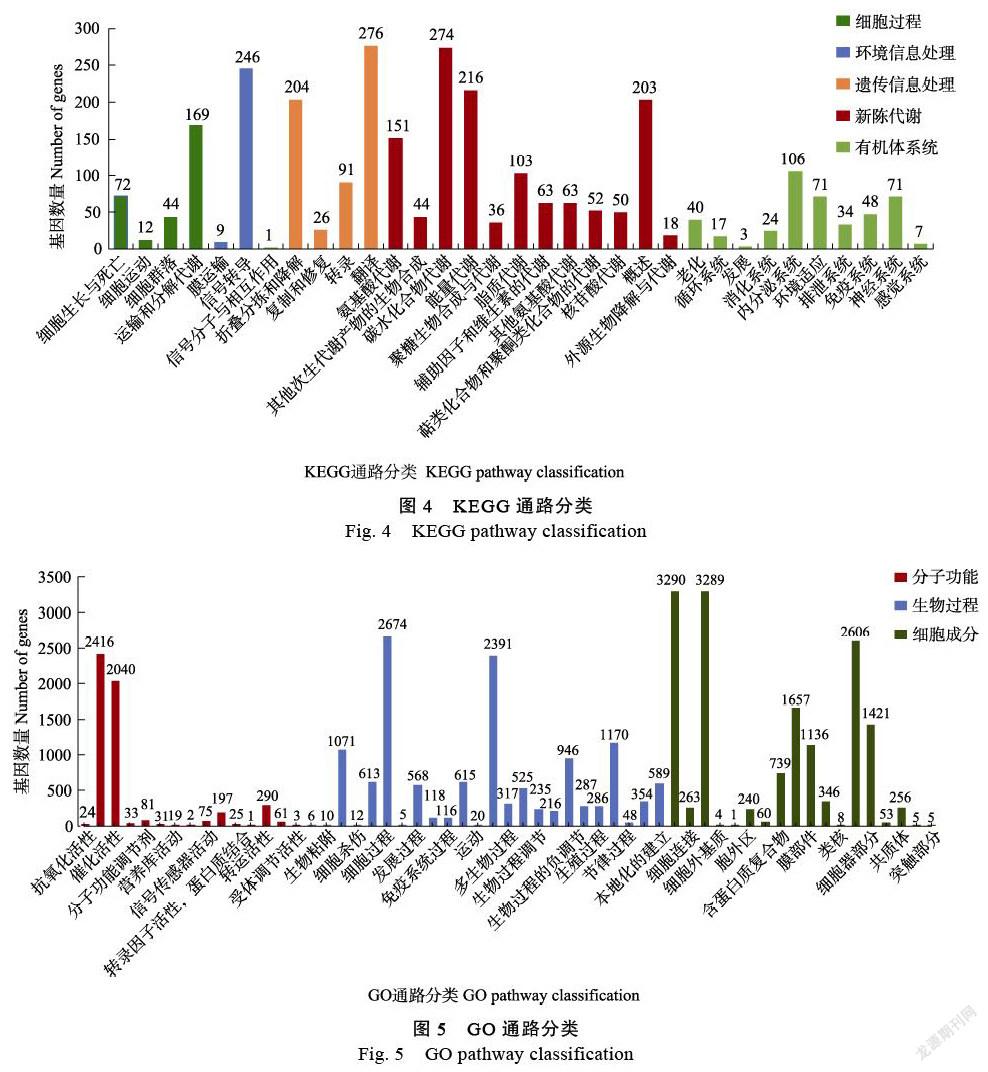
KEGG數據庫共注釋了2844個轉錄本。按代謝途徑可分為5個分支,細胞過程297個、環境信息處理(environmental information processing)256個、遺傳信息處理(genetic information processing)597個、代謝(metabolism)1273個、有機系統(organismal systems)421個碳水化合物代謝(274)和能量代謝(能量代謝)是代謝途徑中涉及最多的途徑,其次是概覽圖(246)。在KEGG代謝途徑分析中(圖4),更多的基因富集在次級代謝物合成途徑、氨基酸和核酸代謝途徑、酪氨酸代謝途徑中。
GO(gene ontology)功能注釋分析(圖5)富集了所有樣本的生物過程(biological process)、細胞成分(cellular component)和分子功能(molecular functon)三類基因,其中富集了更多的基因在細胞成分中,但分子功能較少。在生物過程中,2391個基因在代謝過程中富集,2674個基因在細胞過程中富集,1071個基因在生物調控和刺激反應中富集。這些過程與色素代謝密切相關。在細胞成分上,可以看出,細胞器或細胞器部分、細胞器或細胞器部分、膜或膜部分這3種類型的細胞或細胞器部分富含更多的基因;在分子功能方面,催化活性功能富集2040個基因,結合功能富集2416個,轉運活性富集290個基因。此外,一些基因富含蛋白質和轉錄因子的結合活性。執行GO(基因本體)分析(圖5)。在分子功能方面,4個部分明顯富集到更多的基因,即結合、催化活性、轉運活性、結構分子活性和色素代謝。
2.3 ?果實不同發育時期果肉組織代謝物含量與顏色變化
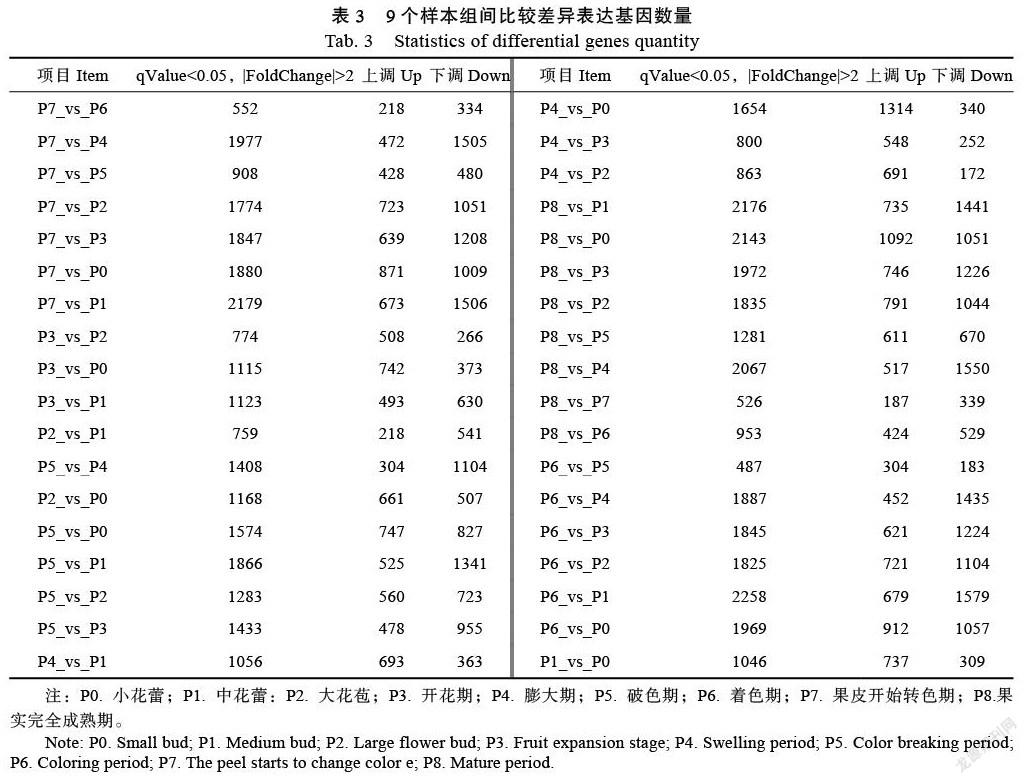
上述化合物中對火龍果果肉的顏色有影響的物質有花青苷含量、類胡蘿卜素、類黃酮和甜菜色素,這些化合物都在火龍果不同的發育時期,其含量都有明顯差異(圖7),可以看出花色苷在P4和P5要明顯高于其他發育時間,類胡蘿卜素在P7的含量要明顯高于其他發育時期。類黃酮在P4和P7的含量也要高于其他發育時期。甜菜色素在火龍果的P3~P6時期的含量較低,P7時期含量表達開始上調,P8時期含量最高。綜上所述,火龍果果肉的顏色直觀地由其所含的化學物質決定,不同的發育時期,火龍果果肉中的維生素C和甜菜色素均較高,導致果肉的顏色也在不同發育時期有差異(圖6)。
2.4 ?果實不同發育時期果肉組織間差異表達基因(Differently expressed genes,DEGs)
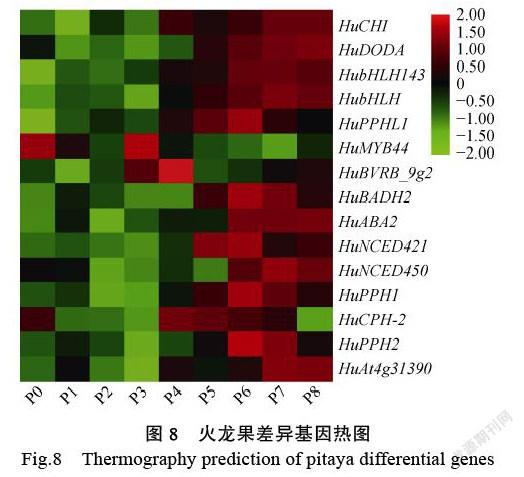
以qValue<0.05,|FoldChange|>2為標準,在9個樣品中(表3),進行了成對比較篩選。可以看出,同一物種在不同時期中幼花幼果期(P0、P1、P2、P3)與成熟期(P6、P7、P8)比較的差異基因。結合果實不同發育時期化合物測定結果得出,在果實轉色期(P4 vs P5)基因差異變化明顯。在P4 vs P5果實轉色期中,共有1408個基因顯著表達,其中304個上調,1104個下調。DEG由GO(GeneOntology)分析。在分子功能上,富集到更多基因是在催化活性、連接、轉運活性、核酸與轉錄因子結合活性、色素代謝等方面。在KEGG代謝途徑分析中,更多的基因富集在次級代謝物合成途徑、氨基酸和核酸代謝途徑、酪氨酸代謝途徑中。
2.5 ?差異表達基因qRT-PCR驗證
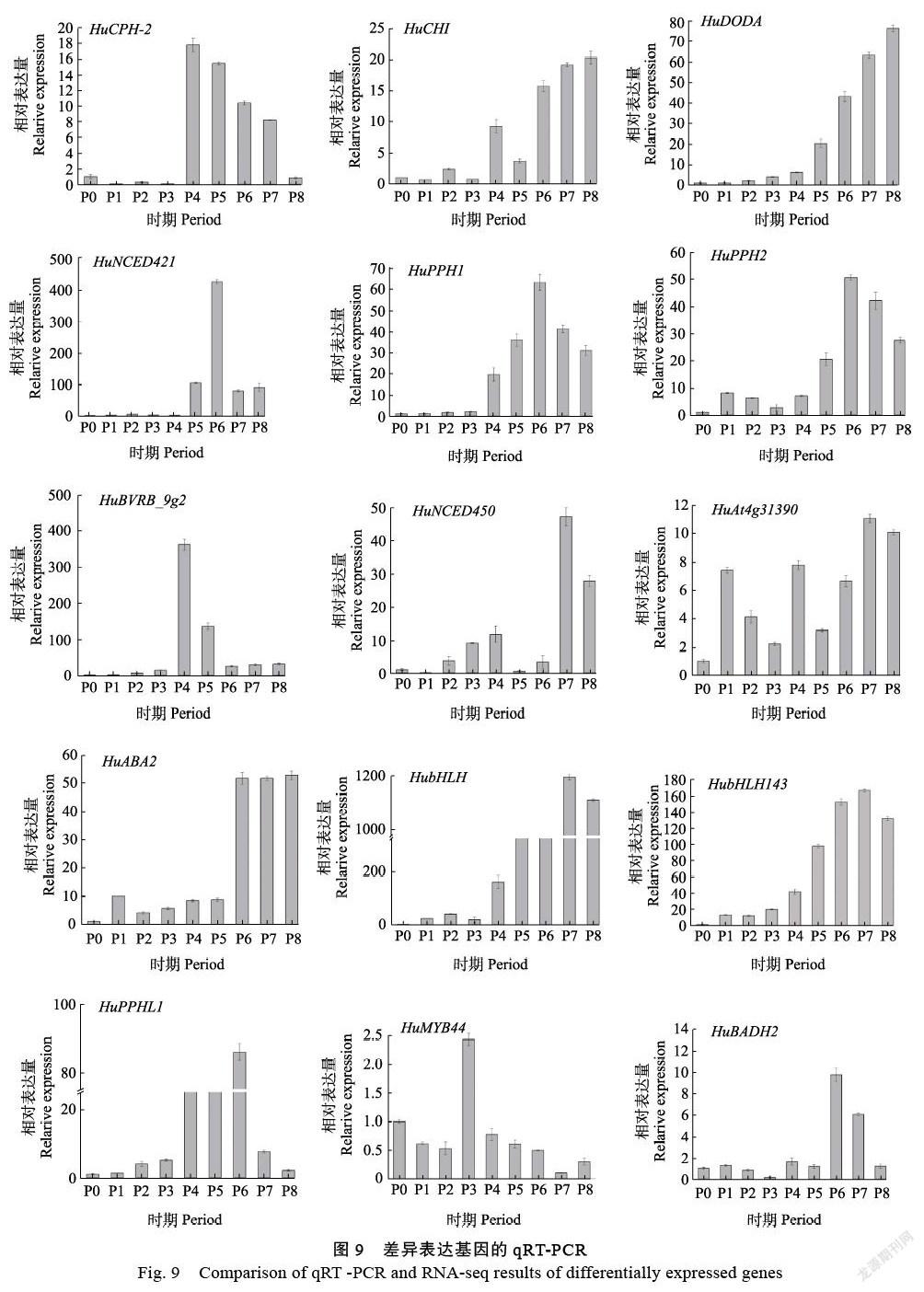
通過轉錄組分析結果分析,提取P0~P8全部發育時期的基因表達量繪制熱圖。根據(圖8)中結果來看,這些基因在P0~P3時期表達量都較低,P4期果實中不同基因的表達量差異較大,P5~P8期基因普遍高表達。具體來說,HuCHI、HuNCED 450、HuABA2、HubHLH143和HubHLH在果實的整個發育后期P6~P8表達量開始上升;HuPPHL1、HuPPH1、HuPPH2、HuBADH2在果實發育后期P6~P7中表達量高;HuCPH-2在P4期高表達后又開始逐漸下降;HuAt4g31390在P7~P8期中表達量陡然增加;HuMYB44在果實發育前期表達量較高,到了后期表達量則下降,HuNCED421隨著果實發育不斷成熟,該基因的表達量在P5和P6時期出現高表達,果實成熟期又逐漸下降;HuDODA則隨著時間累積,表達量一直增加。
為了轉錄組測序和分析結果的可靠性,進行了進一步的驗證,使用熒光定量PCR對15個差異表達基因進行表達量驗證(圖9)。在P0~P8九個發育時期,這些基因均表現出不同程度的表達變化。其中HuBVRB_9g2在P4期表達量較高;HuNCED421在P6期出現了高表達;HuPPH1和HuPPH2在P6期出現高表達后,表達量又開始下降;HuDODA和HubHLH基因隨著果實的發育表達量表現出明顯上升趨勢,尤其在P4時期表達量顯著升高;HuABA2在P6~P8期表達量陡然增高。15個關鍵基因在9個發育時期的熒光定量結果與轉錄組分析結果一致,表明本研究分析和實驗結果真實可靠。P4時期是果實轉色前的關鍵時期,因此,找到火龍果果肉轉色前后表達量顯著升高的基因對研究果肉顏色形成的分子機制具有重要意義。
3 ?討論
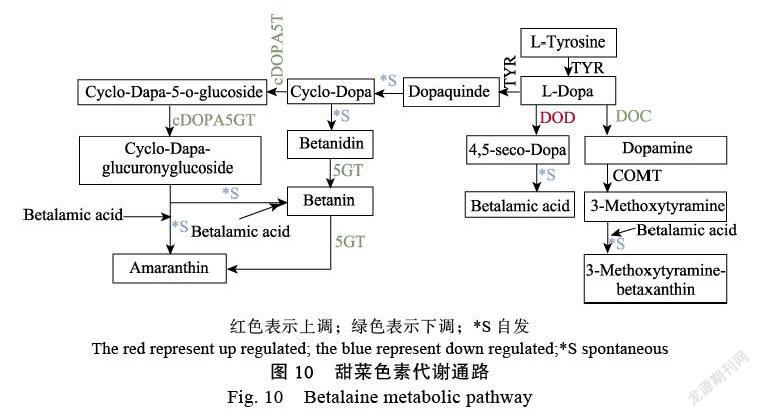
果肉的顏色變化是一個復雜的過程,需要各種基因、酶和轉錄因子的調控。還有許多外部環境影響,如溫度、光線和其他自然因素。甜菜色素的合成前體在酪氨酸和其他酶的催化下形成甜菜醛氨酸(betalammic acid),其中共軛雙鍵形成發色團[15]。另一方面,在細胞色素P450(CytP450)的催化下形成環多巴(cyclo-dopa)。環多巴自發形成甜菜堿。β苷元在GT等催化下與甜菜醛結合形成甜菜堿)[15-16],儲存于液泡中[17](圖10)。
本研究基于定量分析發現,結合轉錄組分析,DODA轉錄本HuDODA的結果呈現上調趨勢。在甜菜色素的生物合成途徑中,多巴(dopa)在4,5-多巴雌二醇雙加氧酶等酶的催化下形成甜菜醛氨酸,其中共軛雙鍵形成發色基團,而后通過自發反應形成甜菜色素[18]。1個HuCHI與黃酮類生物合成有關;3個(HuNCED450、HuABA2和HuNCED421)與類胡蘿卜素生物合成有關;1個HuBADH2與甘氨酸、絲氨酸和蘇氨酸代謝有關;1個(HuDODA)與DODA雙加氧(DOD)甜菜生物合成相關,DODA是甜菜色素代謝途徑中形成發色基團的關鍵酶,也是最有可能與甜菜色素關鍵基因表達相關的關鍵酶[16];3個(HuMYB44、HubHLH143和HubHLH)與色素相關的轉錄因子,4個(HuCPH-2、HuPPH1、HuAt4g31390和HuPPH2)卟啉與葉綠素代謝相關;2個(HuPPHL1和HuBVRB_9g2)預測蛋白類。在轉錄組數據代謝通路中發現(圖10),3個關鍵酶的只有DODA表達一直處于上調趨勢,并且該基因可能在果實臨近采收時期高表達,其可能參與果實品質形成過程。
甜菜色素是一種水溶性天然植物色素,種類比較少。目前,已鑒定出75種甜菜色素。在不同pH下,植株呈現紅、紫、黃、白等顏色,是火龍果顏色的重要組成部分[19-22]。據報道,在甜菜中,甜菜色素的合成需要4種酶的參與:酪氨酸酶[23-24]、4,5-DOPA雙加氧酶[25]、細胞色素P450和葡萄糖堿基轉移酶[26],火龍果中甜菜色素合成的分子調控機制尚未明確。
所有樣品的GO分析顯示,更多的基因富含催化活性、連接、轉運活性、核酸和轉錄因子結合活性,這表明色素的代謝需要多種酶和調節因子。對9個樣品進行配對篩選,發現同一品種不同時期(P8VSP1)(P6VSP1)的差異表達基因較多,說明火龍果肉的色素差異較大。與果實的發育階段有關。在果實的生長發育過程中,一些與顏色相關的關鍵基因可能會繼續發揮促進甜菜色素合成的作用。通過KEGG分析發現,大多數富集的酶與酶活性密切相關。同時,代謝途徑和酪氨酸代謝途徑中富含的酶較多。甜菜色素合成的第一個底物是L-酪氨酸合成的次級代謝產物[27-28],發育過程中可能存在與果實顏色發育相關的基因。趙思軍的研究表明苯丙氨酸是酪氨酸合成的前體[29]。黃酮和黃酮醇的合成與黃酮色素的合成密切相關。火龍果果實顏色的成分較為復雜,不僅包括甜菜色素,還可能含有花青素等黃酮醇色素,但據報道,花青素和甜菜色素不能共存[30]。郭攀陽等[31]對2個不同品種火龍果的果肉顏色進行轉錄組測序,通過DEGs分析發現,同一品種不同時期火龍果的差異比同一時期不同品種間的更大。因此可以從中挑選差異倍數較高的,在P8樣本中表達較為顯著的基因進行深入研究。
參考文獻
[1] 巴良杰, 羅冬蘭, 戴衛軍, 等. 紅肉火龍果HpERF1/2/3轉錄因子的特性及對HpCytP450-like1的調控[J]. 保鮮與加工, 2018, 18(1): 32-40.
[2] 吳 ?琳. 火龍果種質資源評價及繁育研究[D]. 南寧: 廣西大學, 2016.
[3] 蔡永強, 向青云, 陳家龍, 等. 火龍果的營養成分分析[J]. 經濟林研究, 2008, 26(4): 53-56.
[4] 趙湖冰, 姚媛媛, 楊樂樂, 等. 火龍果研究現狀與開發前景[J]. 山東化工, 2018, 47(14): 52-54.
[5] 申世輝, 馬玉華, 蔡永強. 火龍果研究進展[J]. 中國熱帶農業, 2015(1): 48-52.
[6] Xi X, Zong Y, Li S, et al. Transcriptome analysis clarified genes involved in betalain biosynthesis in the fruit of red pitayas (Hylocereus costaricensis) [J]. Molecules, 2019, 24(3): 445.
[7] 劉小玲, 許時嬰, 王 ?璋. 火龍果色素的基本性質及結構鑒定[J]. 無錫輕工大學學報, 2003(3): 62-66+75.
[8] 梁潔玲, 李蕓瑛, 羅文娟, 等. 火龍果色素的提取工藝優化及色素穩定性研究[J]. 中國食品添加劑, 2018(11): 73-77.
[9] 段曉嫣, 田 ?艷, 鄧放明. 火龍果色素生物活性及其提取純化研究進展[J]. 食品與機械, 2017, 33(10): 214-219.
[10] 唐 ?霓, 徐 ?寧, 韋敏雪, 等. 火龍果色素的穩定性及應用研究[J]. 現代食品, 2017(9): 115-117.
[11] 許 ?哲, 楊丹嬌, 李修輝, 等. 火龍果潰瘍病防治藥劑的篩選[J]. 植物醫生, 2021, 34(01): 72-75.
[12] 陸 ?漫, 王小云, 鄭霞林, 等. 我國火龍果病蟲害綠色防控技術研究進展[J]. 廣西植保, 2020, 33(01): 28-31.
[13] 曾燦彬. 紅肉與白肉火龍果果實發育的色素比較與差異表達基因研究[D]. 海口: 海南大學, 2017.
[14] 劉春曉, 黃小慶, 劉自廣, 等. 十字花科植物種子低分子RNA提取方法比較[J]. 基因組學與應用生物學, 2019, 38(3): 1236-1241.
[15] Polturak G, Heinig U, Grossman N, et al. Transcriptome and metabolic profiling provides insights into betalain biosynthesis and evolution in Mirabilis jalapa[J]. Molecular Plant, 2018, 11(1): 189-204.
[16] Wu Y, Xu J, He Y, et al. Metabolic profiling of pitaya (Hy-locereus polyrhizus) during fruit development and matura-tion[J]. Molecules, 2019, 24(6): 1114.
[17] Chen N, Yu Z H, Xiao X G. Cytosolic and nuclear co-localization of betalain biosynthetic enzymes in tobacco suggests that betalains are synthesized in the cytoplasm and/or nucleus of betalainic plant cells[J]. Frontiers in Plant Science, 2017, 8: 831.
[18] Fischer N, Dreiding A S. Biosynthesis of betalaines. on the cleavage of the aromatic ring during the enzymatic transformation of dopa into betalamic acid[J]. Helvetica Chimica Acta, 1972, 55(2): 649-658.
[19] Lee E J, An D, Nguyen C T T, et al. Betalain and betaine composition of greenhouse-or field-produced beetroot (Beta vulgaris L. ) and inhibition of HepG2 cell proliferation[J]. Journal of Agricultural and Food Chemistry, 2014, 62(6): 1324-1331.
[20] Clifford T, Howatson G, West D J, et al. The potential benefits of red beetroot supplementation in health and disease[J]. Nutrients, 2015, 7(4): 2801-2822.
[21] Martinez R M, Longhi-Balbinot D T, Zarpelon A C, et al. Anti-inflammatory activity of betalain-rich dye of Beta vul-garis: effect on edema, leukocyte recruitment, superoxide anion and cytokine production[J]. Archives of Pharmacal Research, 2015, 38(4): 494-504.
[22] Hua Q, Chen C, Chen Z, et al. Transcriptomic analysis reveals key genes related to betalain biosynthesis in pulp coloration of Hylocereus polyrhizus[J]. Frontiers in Plant Science, 2016, 6: 1179.
[23] Tanaka Y, Sasaki N, Ohmiya A. Biosynthesis of plant pig-ments: anthocyanins, betalains and carotenoids[J]. The Plant Journal, 2008, 54(4): 733-749.
[24] Sunnadeniya R, Bean A, Brown M, et al. Tyrosine hydrox-ylation in betalain pigment biosynthesis is performed by cytochrome P450 enzymes in beets (Beta vulgaris)[J]. PloS One, 2016, 11(2): e0149417.
[25] Hinz U G , ?Fivaz J , ?Girod P A , et al. The gene coding for the DOPA dioxygenase involved in betalain biosynthesis in Amanita muscaria and its regulation. [J]. Molecular & General Genetics Mgg, 1997, 256(1): 1-6.
[26] Fischer N, Dreiding A S. Biosynthesis of betalaines. on the cleavage of the aromatic ring during the enzymatic transformation of dopa into betalamic acid[J]. Helvetica Chimica Acta, 1972, 55(2): 649-658.
[27] Gao Z J, Han X H, Xiao X G. Purification and characterisa-tion of polyphenol oxidase from red Swiss chard (Beta vul-garis sub species cicla) leaves[J]. Food Chemistry, 2009, 117(2): 342-348.
[28] Wang C Q, Song H, Gong X Z, et al. Correlation of tyrosi-nase activity and betacyanin biosynthesis induced by dark in C3 halophyte Suaeda salsa seedlings[J]. Plant Science, 2007, 173(5): 487-494.
[29] 趙思俊, 趙曉喆, 向 ?歡, 等. 基于代謝通路調控的沙棘籽油抗抑郁作用機制研究[J]. 中草藥, 2017, 48(13): 2682-2690.
[30] Fan R, Sun Q, Zeng J, et al. Contribution of anthocyanin pathways to fruit flesh coloration in pitayas[J]. BMC Plant Biology, 2020, 20(1): 1-12.
[31] 郭攀陽, 曾燦彬, 劉成立, 等. 紅皮紅肉和紅皮白肉火龍果果肉呈色相關基因差異表達分析[J]. 分子植物育種, 2021, 19(13): 4311-4326.
責任編輯:沈德發

