海南檳榔黃化植原體分子檢測及其系統(tǒng)發(fā)育關系研究
于少帥 宋薇薇 覃偉權
摘 ?要:由植原體引起的檳榔黃化病是海南特色經濟作物檳榔種植上的一種毀滅性病害。本研究通過PCR擴增測序、序列多重比對和系統(tǒng)發(fā)育分析,對海南部分代表性地區(qū)檳榔致死性病原植原體的序列信息與系統(tǒng)發(fā)育關系進行檢測分析。結果表明:本研究檢測的保亭、屯昌、萬寧等海南部分代表性地區(qū)的檳榔黃化植原體的16S rDNA序列一致;BLAST分析表明各株系16S rDNA與16SrI組植原體同源性為100%。序列多重比對分析表明,本研究各檳榔黃化植原體株系與海南苦棟叢枝、長春花綠變、馬松子變葉、辣椒黃化皺縮、蛇婆子叢枝、細圓藤叢枝和日本洋蔥黃化、美國翠菊黃化等植原體同源性為100%;與已報道的海南萬寧、印度、海南三亞的檳榔黃化植原體16S rDNA序列同源性分別為99.9%、99.9%、99.8%。系統(tǒng)發(fā)育分析表明,本研究檳榔黃化植原體與海南苦棟叢枝、長春花綠變、馬松子變葉、辣椒黃化皺縮、蛇婆子叢枝、細圓藤叢枝等株系聚于一個分枝,支持率為100%。此外,在發(fā)病檳榔葉片、花穗、心葉等組織部位均可檢測到植原體。研究結果表明,海南檳榔黃化植原體與海南苦棟叢枝、長春花綠變、馬松子變葉、辣椒黃化皺縮、蛇婆子叢枝、細圓藤叢枝等植原體株系的同源性極高,檳榔黃化病很可能會以這些寄主植物作為病原傳播載體進行傳播擴散。
關鍵詞:植原體;檳榔黃化病;分子檢測;親緣關系;傳播載體
中圖分類號:S436.67 ? ? ?文獻標識碼:A
Abstract: Areca palm yellow leaf (AYL) disease caused by phytoplasma is a devastating disease in the cultivation of areca palm, an important economic crop in Hainan. Through PCR amplification and sequencing, multiple sequence alignment and phylogenetic analysis, the sequence information and phylogeny of the lethal pathogen infecting areca palm from part representative regions of Hainan were analyzed. The 16S rDNA sequence of the AYL phytoplasma in part representative areas of Hainan, such as Baoting, Tunchang, Wanning County, were identical. BLAST analysis based on 16S rDNA showed that the phytoplasm in the study was 100% homology with 16SrI group phytoplasma. Multiple sequence alignment indicated that the phytoplasma in the study was 100% homology with the phytoplasma strains of Chinaberry witches’-broom, Periwinkle virescence, Melochia corchorifolia phyllody, Pepper yellow crinkle, Waltheria indica virescence, Pericampylus glaucus witches’-broom in Hainan and Onion yellows in Japan, Aster yellow witches’-broom in USA. Homology with the AYL phytoplasma from Wanning, Sanya (Hainan, China) and India was 99.9%, 99.9% and 99.8%, respectively. Phylogenetic analysis indicated that AYL strains in the study were clustered into one clade with the phytoplasma strains infecting the plant hosts like chinaberry, periwinkle, Melochia corchorifolia, pepper, Waltheria indica, Pericampylus glaucus in Hainan with 100% bootstrap value. Furthermore, the phytoplasma could be detected in the leaves, flower spikes, and heart leaves from the diseased areca palm. The study indicated that the homology of the AYL phytoplasmas was significantly high with the strains of chinaberry witches’-broom, periwinkle virescence, Melochia corchorifolia phyllody, pepper yellow crinkle, Waltheria indica virescence, Pericampylus glaucus witches’-broom. AYL disease is very likely to spread using the host plants as pathogen transmission vectors.
Keywords: phytoplasma; areca palm yellow leaf disease; molecular detection; genetic relationship; transmission vector
DOI: 10.3969/j.issn.1000-2561.2021.11.003
植原體(phytoplasma)是一類寄生于植物韌皮部通過刺吸式口器昆蟲傳播的植物毀滅性病原菌,1967年由日本學者土居養(yǎng)二首次發(fā)現[1]。植原體很難從植物或昆蟲寄主中分離純化培養(yǎng),對其遺傳信息及表達代謝等了解相對不足,嚴重制約植原體研究[2-3]。植原體引起的病害寄主種類多、分布范圍廣、危害程度大,對社會經濟、生態(tài)環(huán)境等影響嚴重,該病害目前尚無有效的治療藥劑,以防為主。海南省植原體病害種類十分豐富,約占我國已鑒定植原體病害的五分之一,海南植原體病害遍及整個海南島且危害程度嚴重,給海南省農林業(yè)造成巨大損失[4]。海南省受植原體病害影響的作物有檳榔(Areca catechu L.)、花生(Arachis hypogaea)、苦楝(Melia azedarach)、長春花(Catharanthus roseus)、辣椒(Capsicum annuum)、細圓藤(Pericampylus glaucus)、山黃麻(Trema tomentosa)等海南特色經濟作物或綠化植物,對海南的社會經濟和生態(tài)環(huán)境等造成嚴重的影響[4-8],其中檳榔黃化病(areca palm yellow leaf disease, AYL)在海南發(fā)生普遍且嚴重,影響巨大。
檳榔是我國“四大南藥”之首和海南省重要特色經濟作物,具有很高的藥用價值和經濟價值。由植原體引起的檳榔黃化病是海南檳榔種植上的一種毀滅性病害,對海南的社會經濟和生態(tài)環(huán)境造成嚴重影響。海南檳榔黃化病于1981年首次發(fā)現于屯昌縣,目前已由發(fā)病初期的屯昌縣蔓延至海口、文昌、瓊海、萬寧、陵水、瓊中、定安、樂東、保亭、三亞、五指山等多個市(縣)[4, 9]。金開璇等[10]通過超薄電鏡切片在檳榔黃化病染病組織中觀察到了植原體。車海彥[4]、羅大全等[11]、通過超薄電鏡切片觀察、四環(huán)素注射處理、PCR擴增檢測等技術進一步證實植原體是海南檳榔黃化病的病原。近年來,在海南不同檳榔種植區(qū)均有不同程度的發(fā)生,且發(fā)病地區(qū)及面積仍在不斷擴大,嚴重影響海南檳榔產業(yè)的健康可持續(xù)發(fā)展[4, 9]。目前,海南植原體病害的發(fā)生傳播、擴散流行等問題尚不清楚,海南不同縣(市)、不同生境、不同發(fā)病區(qū)植原體的來源、傳播途徑等問題尚不明確,這些問題嚴重制約海南相關植原體病害的防控管理。
本研究對海南不同代表性地區(qū)的檳榔黃化病進行調查,采集檳榔黃化病及疑似植原體引起的其他植物病害樣品,通過PCR擴增檢測、序列多重比對、系統(tǒng)發(fā)育分析等技術方法,從分子水平上對海南檳榔黃化植原體進行檢測鑒定,豐富對檳榔黃化植原體分子水平上的認知。對本研究中檳榔黃化植原體與前期已報道的檳榔黃化植原體及親緣關系或地理分布密切相關的植原體株系間的系統(tǒng)發(fā)育關系進行分析,揭示不同寄主植原體株系間遺傳變異水平和系統(tǒng)發(fā)育關系。為檳榔黃化病在海南的傳播擴散、流行監(jiān)測和科學防控等研究提供科學參考,以促進海南該類病害防控理念的發(fā)展與提升。
1 ?材料與方法
1.1 ?材料
1.1.1 ?樣品采集 ?實驗材料于2019—2020年采自海南保亭、屯昌、萬寧等地疑似檳榔黃化植原體引起的檳榔黃化病植株,每個地點采集3份葉片樣品;針對同一株發(fā)病檳榔,采集葉片、花穗、心葉、莖皮、根等不同組織部位,每個組織部位采集3份樣品,同時采集健康的檳榔樣品作為對照,用作陽性對照的泡桐叢枝植原體樣品取自中國林業(yè)科學研究院,所采樣品低溫保存?zhèn)溆谩?/p>
1.1.2 ?試劑 ?植物基因組DNA提取試劑盒(離心柱型)、2×PCR Master Mix預混液、50×TAE、SYBR Green I染料、6×Loading Buffer、DNA分子量標準DL2000購自天根生化科技(北京)有限公司,其他試劑均為國產分析純。PCR擴增引物由生工生物(上海)工程股份有限公司合成。
1.2 ?方法
1.2.1 ?總DNA提取 ?葉片、花穗、心葉、莖皮、根等樣品取樣量均為0.1 g,利用CTAB法提取染病檳榔組織中的總DNA,植原體總DNA提取方法參考天根植物基因組DNA提取試劑盒說明書方法。
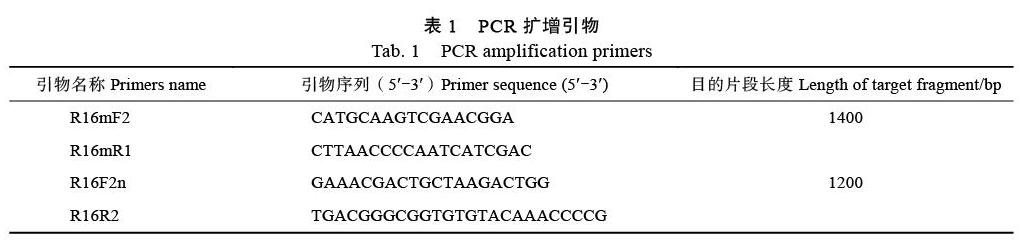
1.2.2 ?PCR擴增測序 ?檳榔黃化植原體通過植原體通用引物R16mF2/R16mR1、R16F2n/R16R2[2]進行擴增。用引物R16mF2/R16mR1擴增的PCR產物稀釋50倍后用作引物R16F2n/R16R2進行巢式PCR擴增的模板,引物序列信息見表1。PCR反應體系和條件如下:PCR反應體系為25 μL,包括1.0 μL DNA模板,1.0 μL上游引物和下游引物(10 μmol/L),12.5 μL 2×PCR Master Mix(包含0.05 U/μL Taq DNA聚合酶,4 mmol/L MgCl2和0.4 mmol/L dNTPs),用ddH2O補至25 μL。反應條件為94.0 ℃,5 min;94.0 ℃,30 s,53.0 ℃,40 s,72.0 ℃,1 min 30 s(直接PCR)或1 min 20 s(巢式PCR),共35個循環(huán);72.0 ℃,10 min。PCR擴增產物用SYBR Green I染色、經1.0%(w/V)瓊脂糖凝膠、凝膠成像系統(tǒng)檢測。相關PCR擴增引物由生工生物工程(上海)股份有限公司合成。PCR擴增產物用1.0%瓊脂糖凝膠檢測,有明顯目的條帶的擴增產物送生工生物工程(上海)股份有限公司測序。本研究所得核苷酸序列均上傳至GenBank數據庫。
1.2.3 ?序列比對分析 ?獲得的核苷酸序列采用DNAMAN 6.0軟件(Lynnon Corporation, Vau-dreuil-Dorion, Quebec, Canada)進行編輯,并進行多重序列比對,通過多重序列比對揭示不同植原體株系間的相似性及其變異位點。基于檳榔黃化植原體16S rDNA序列進行BLAST分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi)。
1.2.4 ?系統(tǒng)發(fā)育分析 ?利用MEGA 7.0軟件的鄰接法(neighbor-joining, NJ)構建系統(tǒng)發(fā)育樹[12]。自展值(bootstrap value)設為1000,用以評估軟件生成的系統(tǒng)進化樹的穩(wěn)定性和支持率[13]。洋蔥黃化植原體(onion yellows phytoplasma)OY-M(AP006628)、翠菊黃化植原體(aster yellow phytoplasma)AYWB(CP000061)、蘋果簇生植原體(apple proliferation phytoplasma)CPM(CU469464)、澳大利亞葡萄黃化植原體(Australia grape yellow phytoplasma)CPA(AM422018)和草莓致死黃化植原體(strawberry lethal yellow phytoplasma)SLY(CP002548)等全基因組測序已完成的植原體株系作為構建系統(tǒng)發(fā)育樹的外類群。
1.3 ?數據處理
本研究所得核苷酸序列均通過Submission Portal(https://submit.ncbi.nlm.nih.g-ov/subs/genb-ank/)上傳至GenBank數據庫并獲得序列號。
2 ?結果與分析
2.1 ?檳榔黃化植原體分子檢測
在海南保亭、屯昌、萬寧等3個地點采集的9份檳榔黃化病樣品中,均擴增到植原體目的條帶,在健康的檳榔樣品中未擴增到目的條帶,檳榔黃化病癥狀及其擴增檢測結果見圖1。部分樣品PCR擴增產物送測序,均獲得植原體靶標基因序列。所得靶標基因序列經BLAST比對分析表明:所得序列為植原體16S rDNA序列,與16SrI組植原體的16S rDNA序列同源性極高甚至一致,如本研究所得植原體的16S rDNA序列與GenBank數據庫中的16SrI組油菜變葉病植原體(rapeseed phyllody phytoplasma)(CP055264)的16S rDNA序列的同源性為100%,覆蓋率為100%。所得序列已上傳至GenBank數據庫,采自海南省保亭縣的檳榔黃化植原體株系AYL-hnbt的16S rDNA基因序列號為MZ427307,采自海南省屯昌縣的檳榔黃化植原體株系AYL-hntc的16S rDNA基因序列號為MZ427308,采自海南省萬寧市的2個檳榔黃化植原體株系AYL-hnwn1和AYL-hnwn2的16S rDNA基因序列號分別為MZ427309和MZ427310。
2.2 ?序列同源性分析
基于植原體16S rDNA序列多重比對分析表明:海南保亭、屯昌、萬寧等3個地點9份樣品中檢測到的檳榔黃化植原體16S rDNA序列一致,無變異位點,序列同源性為100%(表2)。同源比對分析表明:本研究采自海南保亭、屯昌、萬寧等3個地點的檳榔黃化植原體株系AYL-hnbt、AYL-hntc、AYL-hnwn1、AYL-hnwn2與前期已鑒定的來自海南萬寧(FJ998269)、印度(KF728948)的檳榔黃化植原體株系的16S rDNA序列同源性為99.9%,與來自海南三亞(FJ694685)的檳榔黃化植原體株系的16S rDNA序列同源性為99.8%。本研究采自海南保亭、屯昌、萬寧等3個地點的檳榔黃化植原體株系與前期已鑒定的來自海南的苦楝叢枝植原體(chinaberry witches’- broom phytoplasma)(KP662119、KP662120)、長春花綠變植原體(periwinkle virescence phytoplasma)(KP662136)、馬松子變葉植原體(Melochia corchorifolia phyllody phytoplasma)(KX150461)、辣椒黃化皺縮植原體(pepper yellow crinkle phytoplasma)(MT760793)、細圓藤叢枝植原體(Pericampylus glaucus witches’- broom phytoplasma)(MT872515)、蛇婆子綠變植原體(Waltheria indica virescence phytoplasma)(MW353909)及來自日本的洋蔥黃化植原體(AP006628)、來自美國的翠菊黃化叢枝植原體(CP000061)等各個植原體株系間的同源性為100%(表2)。
2.3 ?系統(tǒng)發(fā)育分析
采用MEGA 7.0軟件基于鄰接法構建系統(tǒng)發(fā)育樹。本研究中采自海南保亭、屯昌、萬寧等地的檳榔黃化植原體與車海彥[4]檢測的海南三亞檳榔黃化植原體株系(FJ694685)、周亞奎等[9]檢測的海南萬寧檳榔黃化植原體株系(FJ998269)、Muddumadiah等[14]檢測的印度檳榔黃化植原體株系(KF728948)聚于一個進化分枝,支持率為100%,均為16SrI組植原體(圖2)。Ramaswamy等[15]通過16S rRNA基因序列分析發(fā)現印度Sullia地區(qū)引起檳榔黃化病的檳榔黃化植原體屬于16SrXI組植原體株系(JN967909),與海南檳榔黃化植原體區(qū)別明顯(圖2,表2)。由此可見,檳榔黃化病可以由不同組或亞組的植原體導致,但目前未見2種以上植原體復合侵染引起檳榔黃化病的報道。此外,本研究鑒定的海南檳榔黃化植原體AYL-hnbt、AYL-hntc、AYL- hnwn1、AYL-hnwn2與海南引起苦楝叢枝(KP662119、KP662120)、長春黃花綠變(KP662136)、馬松子變葉(KX150461)、辣椒黃化皺縮(MT760793)、細圓藤叢枝(MT872515)、蛇婆子綠變(MW353909)等相關病害的植原體株系聚于一個進化分枝,支持率為100%(圖2)。
2.4 ?發(fā)病檳榔不同組織部位植原體檢測
在海南保亭、屯昌、萬寧采集表現黃化癥狀的同一株檳榔的不同組織部位進行檢測,基于植原體16S rRNA基因序列擴增分析表明:在發(fā)病檳榔的葉片、花穗、心葉這3個組織部位中均檢測到植原體16S rRNA基因序列目的條帶,目的條帶約為1200 bp;在發(fā)病檳榔的根、莖皮這2個組織部位均未檢測到植原體16S rRNA基因序列目的條帶;在健康無癥狀的檳榔葉片、花穗、心葉、莖皮、根等不同組織部位以及去離子水陰性對照中均未檢測到植原體16S rRNA基因序列的目的條帶(圖3)。
3 ?討論
本研究對我國海南保亭、屯昌、萬寧等地的檳榔黃化植原體檢測鑒定表明不同地區(qū)檳榔黃化植原體同源性很高甚至一致,本研究中不同檳榔黃化植原體株系間序列相似性為100%,均歸類于16SrI組植原體。研究結論與海南前期已報道的檳榔黃化植原體株系為同一組,但存在一定程度的變異。車海彥[4]基于16S rRNA基因在海南屯昌、瓊海、定安、萬寧、三亞等地均檢測到檳榔黃化植原體,通過序列比對和系統(tǒng)發(fā)育分析確定其鑒定的檳榔黃化植原體歸屬于16SrI組;周亞奎等[9]基于16S rRNA基因PCR擴增分析也表明海南檳榔黃化病是由16SrI組檳榔黃化植原體引起的。本研究中來自海南的檳榔黃化植原體與車海彥[4]、周亞奎等[9]檢測的海南檳榔黃化植原體的16S rDNA序列同源性極高,分別為99.9%和99.8%。
與國外檳榔黃化植原體檢測鑒定研究相比,本研究報道的檳榔黃化植原體與Muddumadiah等[14]報道的印度檳榔黃化植原體均屬于16SrI組植原體,16S rDNA序列同源高達99.9%。Ramaswamy等[15]基于16S rRNA基因序列分析表明印度檳榔黃化病可以由16SrXI組檳榔黃化植原體引起;Silva等[16]基于16S rRNA基因序列分析表明斯里蘭卡檳榔黃化病由16SrXIV組檳榔黃化植原體引起。目前,海南已報道的檳榔黃化植原體均為16SrI組植原體,未見其他16Sr組的植原體株系或2種以上的植原體復合侵染而引起檳榔黃化病的報道
海南屬熱帶島嶼,具有獨特的生物多樣性與地理生態(tài)特征。已有報道表明海南的植原體及其相關病害的種類十分豐富,數量相對較多,地理分布幾乎遍及整個海南,對海南一些主要的經濟作物、生態(tài)植物危害十分嚴重[3-4]。本研究表明海南引起檳榔黃化病的檳榔黃化植原體株系與海南引起苦楝叢枝、長春黃花綠變、馬松子叢枝、辣椒黃化皺縮、細圓藤叢枝、蛇婆子綠變等病害[5-7]的植原體株系同源性極高,親緣關系很近,相關植原體株系間的16Sr DNA序列的同源性高達100%,極有可能是同一種植原體侵染不同的植物寄主引起相應的植物病害癥狀。
植原體主要通過寄主種苗、媒介昆蟲、菟絲子(Cuscuta chinensis)等傳播介體進行長距離或短距離傳播。本研究發(fā)現海南檳榔黃化植原體與海南苦楝叢枝、長春黃花綠變、馬松子叢枝、辣椒黃化皺縮、細圓藤叢枝等植原體[5-7]同源性高達100%,相關植原體株系親緣關系極近,侵染檳榔引起檳榔黃化病的植原體可能侵染苦楝、長春花、馬松子(Melochia corchorifolia)等寄主植物引起相關植物叢枝、綠變等癥狀,即檳榔黃化植原體的傳播除了可以通過檳榔種苗、媒介昆蟲、菟絲子等載體進行傳播,也可能會通過苦楝、辣椒、長春花等植原體寄主植物的運輸流通而進行傳播擴散。因此,在檳榔黃化病的防控過程中,除了對檳榔種苗、媒介昆蟲等進行防控管理外,也應對苦楝、辣椒、長春花等相關植原體寄主植物的運輸流通加強檢疫管理,從源頭上切斷病原傳播途徑,杜絕病害傳播擴散。
參考文獻
[1] Doi Y, Teranaka M, Yora K, et al. Mycoplasma or PLT group like microorganisms found in the phloem elements of pants infected with mulberry dwarf, potato witches’-broom, aster yellows or pauwlonia witches’-broom[J]. Annals of the Phytopathological Society of Japan, 1967, 33(4): 259-266.
[2] Dickinson M, Hodgetts J. Phytoplasma: Methods and Protocols[M]. Totowa: Humana Press, 2013.
[3] 于少帥, 徐啟聰, 林彩麗, 等. 植原體遺傳多樣性研究現狀與展望[J]. 生物多樣性, 2016, 24(2): 205-215.
[4] 車海彥. 海南省植原體病害多樣性調查及檳榔黃化病植原體的分子檢測技術研究[D]. 楊凌: 西北農林科技大學, 2010.
[5] 于少帥, 李 ?永, 任爭光, 等. 多位點序列分析揭示我國16SrI組植原體不同株系間遺傳變異和系統(tǒng)發(fā)育關系[J]. 林業(yè)科學, 2017, 53(3): 105-118.
[6] Yu S S, Tang Q H, Fu D Q, et al. Molecular identification and characterization of a phytoplasma strain associated with pepper (Capsicum annuum L.) yellow crinkle disease in China[J]. Journal of General Plant Pathology, 2021, https://doi.org/10.1007/s10327-021-01012-x.
[7] Yu S S, Tang Q H, Wu Y, et al. First report of 16SrI-B subgroup related phytoplasma associated with witches’-broom symptoms in Pericampylus glaucus in China[J]. Plant Disease, 2021, 105(3): 695.
[8] Yu S S, Tang Q H, Wu Y, et al. First report of 16SrXXXII group related phytoplasma associated with Trema tomentosa witches’-broom disease in China[J]. Plant Disease, 2021, 105(4): 1191.
[9] 周亞奎, 甘炳春, 張 ?爭, 等. 利用巢式PCR對海南檳榔(Areca catechu L.)黃化病的初步檢測[J]. 中國農學通報, 2010, 26(22): 381-384.
[10] 金開璇, 孫福生, 陳慕容, 等. 檳榔黃化病的病原的研究初報[J]. 林業(yè)科學, 1995, 31(6): 556-558.
[11] 羅大全, 陳慕容, 葉沙冰, 等. 海南檳榔黃化病的病原鑒定研究[J]. 熱帶作物學報, 2001, 22(2): 43-46.
[12] Kumar S, Stecher G, Tamura K. MEGA7: Molecular evolu-tionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874.
[13] Felsenstein J. Confidence limits on phylogenies: An appro-ach using the bootstrap[J]. Evolution, 1985, 39(4): 783-791.
[14] Muddumadiah C, Madhupriya, Kumar S, et al. Detection and characterization of 16SrI-B phytoplasmas associated with yellow leaf disease of arecanut palm in India[J]. Phytopathogenic Mollicutes, 2014, 4(2): 77-82.
[15] Ramaswamy M, Nair S, Soumya VP, et al. Phylogenetic ana?lysis identifies, a ‘Candidatus phytoplasma oryzae’-re-lat?ed strain associated with yellow leaf disease of areca palm (Are?ca catechu L.) in India[J]. International Journal of System?atic and Evolutionary Microbiology, 2013, 63: 1376- 1382.
[16] Silva C K D, Dahanayake D, Silva R D, et al. Molecular and scanning electron microscopic proof of phytoplasma asso-ciated with areca palm yellow leaf disease in Sri Lanka[J]. Plant Disease, 2015, 99(11): 1641.
責任編輯:謝龍蓮

