GC法比較不同企業腦立清制劑中3種揮發性成分含量
尹 雪,焦 陽,梅桂雪,徐興燕,丁 勃,譚樂俊,林永強
(山東省食品藥品檢驗研究院 國家藥品監督管理局膠類產品質量評價重點實驗室,山東 濟南 250101)
腦立清制劑包括丸劑、膠囊劑和片劑3個制劑規格,處方組成一致,僅在制劑工藝上有所區別,腦立清丸和腦立清膠囊收載于《中國藥典》2020年版一部,腦立清片收載于《中國人民共和國衛生部藥品標準》(中藥成方制劑第十九冊)[1-2]。現行標準中,腦立清丸對龍腦進行了定量控制,腦立清膠囊對龍腦及薄荷腦進行了定量控制,而腦立清片中無含量測定項目。為全面評價腦立清制劑(丸劑、膠囊劑、片劑)的質量狀況,為質量監管提供科學依據,本文參考相關文獻[3-7],在《中國藥典》2020年版一部腦立清膠囊及腦立清丸含量測定的基礎上,建立了同時測定腦立清制劑(丸、膠囊、片)中薄荷腦、龍腦、冰片(以龍腦和異龍腦總和計)3種指標性成分含量的方法。
1 儀器與材料
1.1 儀器
METTLER AE240電子天平[梅特勒-托利多國際貿易(上海)有限公司];Agilent 7890氣相色譜儀(安捷倫科技有限公司);KQ-500DE數控超聲波清洗器(昆山市超聲儀器有限公司)。
1.2 材料
薄荷腦對照品(批號:110728-200506),龍腦對照品(批號:110881-201709,含量以99.6 %計),異龍腦對照品(批號:111512-201603,含量以96.7 %計),水楊酸甲酯對照品(批號:110707-201815,含量以100.0 %計,中國食品藥品檢定研究院);腦立清系列制劑為2020年國家藥品評價性抽驗樣品,涉及15家生產企業、88個生產批次(包括丸劑52批,膠囊劑34批,片劑2批)。按腦立清系列制劑的處方,從山東沃華醫藥科技股份有限公司購買正品藥材,經檢驗合格后按規定的處方和工藝自制腦立清丸、膠囊、片3種劑型,作為標準參比制劑使用。同時分別自制一批缺冰片、薄荷腦藥味的腦立清膠囊,作為腦立清陰性樣品。無水乙醇、乙醇均為色譜純。
2 方法與結果
2.1 GC條件
色譜柱:Agilent HP INNOWAX(柱長:30 m,內徑:0.32 mm,膜厚:0.25 μm);采用恒流模式,流速:1 ml/min;分流進樣,分流比:20:1;進樣口溫度:240 ℃;檢測器溫度:250 ℃;柱溫:160 ℃;檢測器:火焰離子化檢測器(FID)。
2.2 溶液的制備
2.2.1 內標溶液和對照品溶液的制備
2.2.1.1 腦立清丸劑(片劑)內標溶液和對照品溶液的制備 取水楊酸甲酯適量,精密稱定,加乙醇制成每1 ml含0.13 mg的溶液,作為腦立清丸劑(片劑)內標溶液。另取龍腦對照品8 mg,異龍腦對照品8 mg,薄荷腦對照品12 mg,精密稱定,置100 ml量瓶中,加內標溶液使溶解,并稀釋至刻度,搖勻,作為腦立清丸劑(片劑)對照品溶液。
2.2.1.2 腦立清膠囊劑內標溶液和對照品溶液的制備 取水楊酸甲酯適量,精密稱定,加無水乙醇制成每1 ml含13 mg的溶液,作為腦立清膠囊劑內標溶液。另取龍腦對照品約5 mg、異龍腦對照品約5 mg、薄荷腦對照品約7 mg,精密稱定,置10 ml量瓶中,加無水乙醇適量使溶解,精密加入內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻,作為腦立清膠囊劑對照品溶液。
2.2.2 供試品溶液的制備
2.2.2.1 丸劑供試品溶液制備 取腦立清丸30丸,精密稱定,研細,取約1 g,精密稱定,置錐形瓶中,精密加入腦立清丸劑(片劑)內標溶液25 ml,密塞,稱定重量,超聲處理(功率 250 W,頻率50 kHz)30 min,放冷,再稱定重量,用腦立清丸劑(片劑)內標溶液補足減失的重量,搖勻,濾過,取續濾液,即得。
2.2.2.2 膠囊劑供試品溶液制備 取腦立清膠囊內容物10粒,混勻,取約2 g,精密稱定,置錐形瓶中,精密加入無水乙醇25 ml,密塞,稱定重量,超聲處理(功率250 W,頻率50 kHz)30 min,放冷,再稱定重量,用無水乙醇補足減失的重量,搖勻,濾過,精密量取續濾液5 ml,置10 ml量瓶中,精密加入腦立清膠囊劑內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻,即得。
2.2.2.3 片劑供試品溶液制備 取腦立清片30片,精密稱定,研細,取相當于5片的重量,精密稱定,置錐形瓶中,精密加入腦立清丸劑(片劑)內標溶液25 ml,密塞,稱定重量,超聲處理(功率250 W,頻率50 kHz)30 min,放冷,再稱定重量,用腦立清丸劑(片劑)內標溶液補足減失的重量,搖勻,即得。
2.2.3 陰性供試品溶液的制備
2.2.3.1 缺冰片陰性供試品溶液制備 取缺冰片的腦立清陰性樣品,混勻,取約 2 g,精密稱定,置錐形瓶中,精密加入無水乙醇25 ml,密塞,稱定重量,超聲處理(功率250 W,頻率50 kHz)30 min,放冷,再稱定重量,用無水乙醇補足減失的重量,搖勻,濾過,精密量取續濾液5 ml,置10 ml量瓶中,精密加入腦立清膠囊劑內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻。
2.2.3.2 缺薄荷腦陰性供試品溶液制備 取缺薄荷腦的腦立清陰性樣品,混勻,取約2 g,精密稱定,置錐形瓶中,精密加入無水乙醇25 ml,密塞,稱定重量,超聲處理(功率250W,頻率50 kHz)30 min,放冷,再稱定重量,用無水乙醇補足減失的重量,搖勻,濾過,精密量取續濾液 5 ml,置10 ml量瓶中,精密加入腦立清膠囊劑內標內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻。
2.3 專屬性試驗
分別取上述對照品、缺冰片陰性供試品溶液、缺薄荷腦陰性供試品溶液及各劑型供試品溶液各1 μl,注入氣相色譜儀,進行測定。結果發現缺冰片陰性供試品溶液、缺薄荷腦陰性供試品溶液未檢出薄荷腦、龍腦、異龍腦,腦立清制劑供試品溶液檢出薄荷腦、龍腦、異龍腦3種成分,說明腦立清制劑中其他藥味對測定無干擾。氣相色譜圖見圖1。

圖1 專屬性試驗GC圖譜
2.4 線性關系考察
分別精密稱取薄荷腦、龍腦和異龍腦對照品適量,加無水乙醇制成濃度分別為3.5260,2.4245,2.5302 mg/ml的混合對照品儲備溶液。分別精密吸取上述混合對照品儲備液0.1,0.5,1.0,2.0,3.0,5.0 ml,置10 ml量瓶中,精密加入腦立清膠囊劑內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻,作為不同濃度的對照品溶液。分別精密吸取上述各不同濃度的混合對照品溶液1 μl,注入氣相色譜儀,進行測定。以內標濃度與對照品濃度比值為橫坐標(X),以內標峰面積與對照品峰面積比值為縱坐標(Y)進行線性回歸。結果見表1。

表1 3種成分線性關系
2.5 精密度試驗
精密吸取2.4項下混合對照品儲備液2 ml,置10 ml量瓶中,精密加入腦立清膠囊劑項下的內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻,即得到薄荷腦、異龍腦和龍腦濃度分別為0.7052,0.4849,0.5060 mg/ml的混合對照品溶液。精密吸取上述混合對照品溶液1 μl,連續進樣6次,計算薄荷腦、異龍腦和龍腦峰面積與內標峰面積比值,結果其RSD分別為0.02 %,0.06 %和0.05 %。表明儀器精密度良好。
2.6 穩定性試驗
精密吸取同一腦立清膠囊劑供試品溶液,在0,4,8,12,24,48 h分別進樣1 μl,計算薄荷腦、異龍腦和龍腦峰面積與內標峰面積比值,結果其RSD分別為0.21 %,0.26 %和0.23 %。表明供試品溶液中的3個待測成分在室溫放置48 h內基本穩定。
2.7 重復性試驗
2.7.1 膠囊劑 取腦立清膠囊參比制劑適量,按2.2.2.2項方法平行制備6份供試品溶液,分別進樣1 μl,結果薄荷腦、異龍腦和龍腦含量平均值分別為30.33,12.40,17.16 mg/g,RSD分別為1.18 %,1.33 %,1.20 %。表明該方法重復性良好。
2.7.2 丸劑 取腦立清丸參比制劑適量,按2.2.2.1項方法平行制備6份供試品溶液,分別進樣2 μl,結果薄荷腦、異龍腦和龍腦含量平均值分別為9.26,2.73、6.25 mg/g,RSD分別為1.65 %,1.58 %,1.79 %。表明該方法重復性良好。
2.7.3 片劑 取腦立清片參比制劑適量,按2.2.2.3項方法平行制備6份供試品溶液,分別進樣2 μl,結果薄荷腦、異龍腦和龍腦含量平均值分別為1.05,1.55,2.17 mg/g,RSD分別為1.41 %,1.81 %,1.71 %。表明該方法重復性良好。
2.8 加樣回收試驗
2.8.1 丸劑 取已測知含量的腦立清丸參比制劑0.5 g,精密稱定,置錐形瓶中,分別精密加入薄荷腦4.5 mg、異龍腦1.5 mg和龍腦3 mg,精密加入腦立清丸劑(片劑)內標溶液 25 ml,密塞,稱定重量,超聲處理(功率250 W,頻率 50 kHz)30 min,放冷,再稱定重量,用內標溶液補足減失的重量,搖勻,濾過,取續濾液,即得。平行制備6份供試品溶液,分別進樣2 μl,計算回收率。結果薄荷腦、異龍腦和龍腦的平均回收率(n=6)分別為99.5 %,99.9 %和100.4 %;RSD分別為0.76 %,1.15 %和1.75 %。測定結果表明,該方法回收率良好。
2.8.2 膠囊劑 取已測知含量的腦立清膠囊參比制劑1 g,精密稱定,置錐形瓶中,分別精密加入薄荷腦30 mg、異龍腦12 mg和龍腦17 mg,精密加入無水乙醇25 ml,密塞,稱定重量,超聲處理(功率250 W,頻率50 kHz)30 min,放冷,再稱定重量,用無水乙醇補足減失的重量,搖勻,濾過,精密量取續濾液5 ml,置10 ml量瓶中,精密加入腦立清膠囊劑內標溶液1 ml,用無水乙醇稀釋至刻度,搖勻,即得。平行制備6份供試品溶液,分別進樣1 μl,計算回收率。結果薄荷腦、異龍腦和龍腦的平均回收率(n=6)分別為99.1 %,99.9 %和99.8 %;RSD分別為1.51 %,1.39 %和1.39 %。測定結果表明,該方法回收率良好。
2.8.3 片劑 取腦立清片30片,精密稱定,研細,取相當于2.5片的重量,精密稱定,置錐形瓶中,分別精密加入薄荷腦2 mg、異龍腦3 mg和龍腦4 mg,精密加入內標溶液 25 ml,密塞,稱定重量,超聲處理(功率 250 W,頻率 50 kHz)30 min,放冷,再稱定重量,用腦立清丸劑(片劑)內標溶液補足減失的重量,搖勻,即得。平行制備6份供試品溶液,分別進樣2 μl,計算回收率。結果薄荷腦、異龍腦和龍腦的平均回收率(n=6)分別為100.2 %,99.9 %和99.6 %;RSD分別為1.57 %,1.73 %和1.42 %。測定結果表明,該方法回收率良好。
2.9 樣品的測定
按本文建立方法測定15家生產企業、88個生產批次的腦立清樣品。對測定結果進行頻數分布和箱線圖分析,由于腦立清片劑樣本量少,僅2批,未做統計學分析。含量測定結果及統計學分析結果見表2和圖2~13。

表2 腦立清制劑GC含量測定結果

表2(續)

圖2 丸劑薄荷腦測定結果頻數分布圖
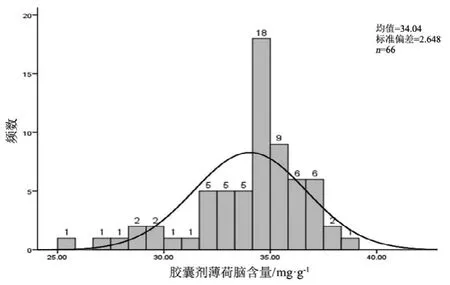
圖3 膠囊劑薄荷腦測定結果頻數分布圖

圖4 丸劑龍腦測定結果頻數分布圖

圖5 膠囊劑龍腦測定結果頻數分布圖

圖6 丸劑冰片測定結果頻數分布圖

圖7 膠囊劑冰片測定結果頻數分布圖

圖8 丸劑薄荷腦測定結果箱線圖

圖9 膠囊劑薄荷腦測定結果箱線圖

圖10 丸劑龍腦測定結果箱線圖

圖11 膠囊劑龍腦測定結果箱線圖
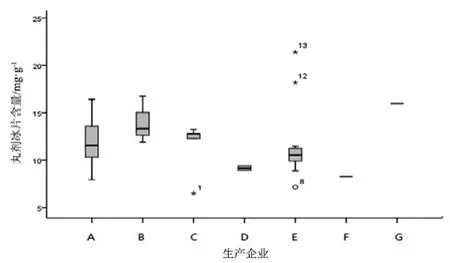
圖12 丸劑冰片測定結果箱線圖

圖13 膠囊劑冰片測定結果箱線圖
2.10 結果分析
觀察薄荷腦、龍腦和冰片3個指標成分的頻數分布圖(圖2~7),均大致呈正態分布。觀察3個指標成分的箱式分布圖,分布狀況基本一致,不同企業之間中位值差異較大,表明不同企業之間產品質量存在差異。部分企業不同批次之間測定結果的離散程度較高,說明該企業在生產工藝、原藥材的質量控制以及貯存環境上存在一定的問題。
冰片、薄荷腦屬揮發性藥材,原料質量、制備過程、貯存等因素都會影響其含量。腦立清膠囊中冰片、薄荷腦為乙醇溶解后入藥,未經受熱,轉移率高,結合藥典中腦立清膠囊和冰片藥材項下的既定限值,按薄荷腦轉移率57 %、冰片轉移率55 %計算限值。腦立清丸制備過程中經40 ℃干燥,對揮發性成分的轉移率影響較大,結合藥典中既定限值和標準制劑的實際轉移率,按薄荷腦、冰片轉移率12 %計算限值。腦立清片中冰片和薄荷腦受包合工藝、干燥等工藝的影響使轉移率進一步降低,結合藥典中既定限值和標準制劑的實際轉移率,按薄荷腦、冰片轉移率5 %計算限值。具體限值和腦立清各個劑型平均值見表3。

表3 腦立清制劑3種成分含量測定平均值統計表
比較均值與擬定的限度值,可看出3個指標成分結果較理想,含量限度值基本合理。各企業龍腦和冰片含量未出現不合格,有兩家生產企業2批次樣品(丸劑、片劑各1批)薄荷腦含量不合格,占總批次數的2.3 %。
3 討論
目前,腦立清系列制劑標準不統一,腦立清丸對龍腦進行了定量控制,腦立清膠囊對龍腦及薄荷腦進行了定量控制,而腦立清片中無含量測定項目。且現行標準中腦立清丸和腦立清膠囊僅對冰片藥材中龍腦進行了定量,單一龍腦無法客觀反映冰片藥材的整體質量,且部分企業為追求利潤可能會存在用龍腦這一化合物代替冰片的風險,因此本文建立了GC法同時測定腦立清制劑中薄荷腦、龍腦、冰片(以龍腦和異龍腦總和計)這3種指標性成分含量,以全面客觀的反映腦立清制劑中冰片、薄荷腦的質量。
冰片、薄荷腦屬于揮發性藥材,其原料質量、制備過程、貯存等因素都會影響其含量。腦立清制劑3種劑型因生產工藝存在較大差異,腦立清丸劑和片劑生產過程中都包括干燥環節,片劑還包括β-環糊精包合環節,工藝的差別影響了冰片、薄荷腦的含量,從而對藥品的質量和療效都會產生一定的影響。建議統一和完善腦立清3種劑型的質量標準,對處方中揮發性成分的含量進行全面評價,同時企業應加強對揮發性藥材的原料管控,優化生產工藝,確保藥品的質量,以保證廣大人民群眾用藥安全。

