敲減ATF3對結直腸癌腫瘤干細胞自我更新與上皮間質轉化及免疫抑制因子分泌的影響*
張勇 夏悅明 賴曉蘭 閔松林 雷文俤
(寧德市醫院 1.普外二科;2.血液科;3.急診科,福建 寧德 352100)
結直腸癌(colorectal cancer, CRC)是世界上第三大常見的胃腸道癌癥類型,其發病率和死亡率均較高。近年來,每年約有180萬新病例被診斷為CRC,占所有癌癥發病率的約10%,且每年有80萬的病例死于CRC[1-2]。各種環境因素和不良生活方式均會導致CRC的發生,例如吸煙、酒精攝入等。傳統上CRC的療法包括腹腔鏡切除手術、放療和化療,但治療后仍然會出現副作用,甚至癌癥復發,因此迫切需要探究CRC新的治療策略。結直腸癌腫瘤干細胞(colorectal cancer stem cells,CRC-CSCs)與其他腫瘤干細胞一樣,具有自我更新和無限增殖的能力,可介導CRC腫瘤的生長、轉移與復發。目前研究表明,CRC治療后復發的主要原因可能是CRC-CSCs無法根除[3],因此,靶向抑制CRC-CSCs的惡性生物學行為可能是CRC治療的重要策略。活化轉錄因子3(Activating transcription factor 3, ATF3)是具有堿性亮氨酸拉鏈結構的轉錄因子,屬于ATF/CREB家族的成員,可在多種條件下調節基因的表達[4]。研究表明,ATF3在動脈粥樣硬化、心肌肥大以及多種癌癥發病機制中均發揮重要作用,且已發現ATF3與CRC惡性演進相關[5-7]。因此,本研究以分選CD133+表達的CRC-CSCs為對象,探究靶向敲減ATF3對CRC-CSCs自我更新、上皮間質轉化等惡性生物學行為的影響。
1 材料與方法
1.1 材料 人結直腸癌細胞系HCT116購自中國上海科學院細胞庫,胰蛋白酶、胎牛血清、牛血清白蛋白、雙抗、McCoy’s 5a培養基以及DMEM/F12培養基購自Hyclone公司,TRIzol試劑、PrimeScriptTM1st Strand cDNA Synthesis Kit、SYBR?Premix Ex TaqTMII試劑盒購自日本Takara公司,CCK-8試劑盒和ELISA試劑盒購自凱基生物公司,免疫熒光染色試劑盒購自博士德生物公司,結晶紫染液、BCA蛋白質檢測試劑盒、ECL化學發光液購自碧云天公司,抗體CD133、E-cadherin、Vimentin、Fas、FasL購自英國Abcam公司,辣根過氧化物酶標記的山羊抗兔購自昊鑫生物公司,sh-ATF3慢病毒載體由上海生工生物公司設計構建。
1.2 方法
1.2.1 HCT116細胞的培養 取HCT116細胞復蘇,添加含10%胎牛血清與1%雙抗(青霉素與鏈霉素)的McCoy’s 5a培養基,置于37℃、CO2恒溫孵育箱進行培養,待細胞融合度達80%時,采用胰蛋白酶進行消化,并以1∶3的比例傳代培養。
1.2.2 流式細胞術分選CRC-CSCs細胞 取對數生長期的HCT116細胞,加入含20%胎牛血清與 0.4%牛血清白蛋白的PBS封閉液,調整細胞濃度為2×106個/mL,置于4℃下作用 2 h,離心收集細胞,加入50 μL封閉液重懸細胞,然后分別加入5 μL CD133-PE,在4℃下避光孵育30 min,離心收集細胞,再使用1 mL預冷的PBS重懸細胞,加入磁珠4℃下避光孵育15 min,采用終濃度為2 μg/mL的嘌呤霉素室溫處理10 min 以去除空白死細胞,按照說明書進行操作,通過流式細胞儀分選獲得CD133+表達的CRC-CSCs細胞。在分選獲得的CRC-CSCs細胞中加入含5 mg/mL胰島素、0.4% BSA、2% B27、10 ng/mL FGF、10 ng/mL EGF 的無血清DMEM/F12 培養基中培養以進行后續實驗。
1.2.3 慢病毒轉染CRC-CSCs細胞 取生長狀態良好的CRC-CSCs細胞,置于37℃、CO2恒溫孵育箱中培養,待細胞融合度達80%時消化,調整細胞密度為4×105個/mL,取100 μL接種于24孔板進行轉染。實驗設置分組包括對照組、sh-NC組、sh-ATF3組,其中sh-ATF3組轉染sh-ATF3慢病毒載體,sh-NC組轉染陰性對照慢病毒載體,對照組細胞正常培養。以感染復數為20的比例加入慢病毒,轉染培養12 h,收集兩組細胞,培養于新鮮DMEM/F12培養液中,采用0.5 μg/mL嘌呤霉素進行篩選,每隔1天換液1次,持續2周。
1.2.4 實時熒光定量PCR檢測敲減效率 收集轉染后的3組CRC-CSCs細胞,加入TRIzol試劑提取細胞總RNA,通過紫外分光光度計檢測提取的總RNA純度與濃度。根據PrimeScriptTM1st Strand cDNA Synthesis Kit說明書進行操作,將總RNA進行反轉錄獲得cDNA,以cDNA為模板,進行實時熒光定量PCR檢測mRNA表達水平,步驟按照SYBR?Premix Ex TaqTMII試劑盒進行,以β-actin作為內參基因。擴增條件為:95℃ 5 min,循環1次;95℃ 30 s、60℃ 30 s、58℃ 30 s,此步驟一共循環42次。采用2-ΔΔCt法計算各基因的相對表達水平,利用Primer Premier 5軟件設計基因引物,具體序列如下:ATF3上游引物5′-GACAAGGGAGACCTGGAGAA-3′,下游引物5′-GAGAAGGACAAGAAAGCCACA-3′;β-actin上游引物5′-ATGGTGGGAATGGGTCAGA AG-3′,下游引物5′-TCTCCATGTCGTCCCAGTTG。
1.2.5 CCK-8檢測CRC-CSCs細胞活性 取對數期生長的轉染后的3組CRC-CSCs細胞,調整細胞密度為4×105個/mL,取100 μL接種于96孔板中,置于37℃、CO2恒溫孵育箱中培養12、24、48、72 h,每孔加入10 μL 的CCK-8試劑液,繼續置于恒溫孵育箱中孵育1 h,采用酶標儀檢測450 nm處吸光度(A)值。
1.2.6 CRC-CSCs細胞成球能力檢測 收集轉染后的3組CRC-CSCs細胞,進行消化、離心,加入含生長因子的無血清培養基并吹打分散為單細胞懸浮液,調整細胞濃度以1×103個/孔的密度接種在96孔板,放置于37℃、CO2恒溫孵育箱中培養,1周后于倒置顯微鏡下觀察并計數每視野下形成的細胞球,以>50 μm作為一個細胞球。
1.2.7 平板克隆形成實驗檢測CRC-CSCs細胞克隆形成能力 收集轉染后的3組CRC-CSCs細胞,離心并吹打分散為單細胞懸浮液,調整細胞濃度,以1×103個接種到無菌培養皿中,接種時輕晃培養皿使細胞分散均勻,置于37℃、CO2恒溫孵育箱中培養,14 d后出現明顯的細胞集落,PBS洗滌,加入4%多聚甲醛固定菌落,0.5%結晶紫染液染色15 min,流水沖洗干凈,干燥后置于光鏡下觀察并計數細胞克隆形成數目,將≥50個細胞聚集作為1個細胞菌落。
1.2.8 免疫熒光染色檢測E-cadherin、Vimentin表達 收集轉染后的3組CRC-CSCs細胞,PBS洗滌后,加入 4%多聚甲醛室溫固定10 min,自來水沖洗干凈,滴加 0.5% TritonX-100 透膜處理15 min,加入10%山羊血清室溫下封閉2 h后,接著加入E-cadherin(1∶100)、Vimentin(1∶100)一抗工作液,4℃下孵育過夜;次日,棄去一抗液,PBS洗滌后加入熒光二抗工作液(1∶500),暗室室溫孵育1 h,洗去未結合二抗,滴加 DAPI 室溫染色 10 min,PBS再次洗滌后封片,于熒光顯微鏡下觀察并拍照。
1.2.9 Western Blot檢測E-cadherin、Vimentin蛋白表達水平 取轉染后的3組CRC-CSCs細胞,分別用PBS洗滌后,添加新鮮配制的RIPA裂解溶液,冰上靜置裂解20 min后,離心收集各組上清液,BCA法測定蛋白質濃度。配制12%SDS-PAGE凝膠,分別取50 μg的各組蛋白樣品上樣,經過電泳分離蛋白質。并電轉至PVDF膜(4℃,300 mA恒流1.5 h),接著置于5%脫脂奶粉中室溫封閉2 h,TBST洗膜,將膜與E-cadherin(1∶1000)、Vimentin(1∶1000)、Fas(1∶1000)、FasL(1∶1000)一抗工作液共同置于4℃下孵育過夜;次日,洗膜后,加入辣根過氧化物酶標記的山羊抗兔(1∶5000)二抗工作液,37℃孵育1 h,TBST再次洗膜,滴加ECL化學發光液顯色曝光,凝膠成像系統掃描圖像后,Quantity One軟件分析各條帶的灰度值,并以GAPDH條帶灰度值作為參照。
1.2.10 ELISA法檢測細胞分泌的TGF-β1、VEGF、IL-6、IL-10水平 收集培養48 h后的3組CRC-CSCs細胞培養液上清,采用ELISA 法檢測細胞培養液上清中TGF-β1、VEGF、IL-6以及IL-10的含量,實驗步驟嚴格按照ELISA試劑盒說明書進行,采用酶標儀檢測450 nm處各孔的A值。
2 結果
2.1 CRC-CSCs細胞鑒定 通過流式細胞術分選CRC-CSCs細胞,CD133+CRC-CSCs細胞在分選前占23%,而分選后CD133+CRC-CSCs細胞達到了93%,見圖1。

圖1 流式細胞術分選CD133+CRC-CSCs細胞
2.2 轉染后各組CRC-CSCs細胞中ATF3 mRNA表達比較 qRT-PCR檢測結果顯示,與對照組比較,sh-ATF3組CRC-CSCs細胞中ATF3 mRNA相對表達量顯著下降(P<0.05),而sh-NC組與對照組的ATF3 mRNA相對表達量之間無統計學差異(P>0.05),見圖2A。表明在CRC-CSCs細胞中敲減ATF3成功。
2.3 敲減ATF3對CRC-CSCs細胞活性的影響 與對照組比較,sh-ATF3組ATE3 mRNA表達水平降低(P<0.05),sh-NC組和對照組比較ATE3mRNA表達水平差異無統計學意義(P>0.05);CCK-8檢測各組CRC-CSCs細胞活性結果顯示,與對照組比較,sh-ATF3組CRC-CSCs細胞在48 h和72 h活性均顯著降低,差異具有統計學意義(P<0.05);而在不同時刻,sh-NC組與對照組活性比較差異均無統計學意義(P>0.05),見圖2B。

圖2 各組CRC-CSCs細胞中ATF3 mRNA表達及活性比較
2.4 敲減ATF3對CRC-CSCs細胞成球能力的影響 成球實驗結果顯示,對照組、sh-NC組和sh-ATF3組CRC-CSCs細胞的成球個數分別為(87.56±5.89)、(84.70±5.06)、(20.12±1.58)。與對照組比較,sh-ATF3組細胞球體積明顯縮小,成球個數也顯著減少(P<0.01);sh-NC組和對照組比較細胞球體積無明顯變化,成球個數之間差異無統計學意義(P>0.05),見圖3。表明敲減ATF3能抑制結直腸癌腫瘤干細胞細胞球的形成。

圖3 各組CRC-CSCs細胞成球能力檢測
2.5 敲減ATF3對CRC-CSCs細胞克隆形成能力的影響 平板克隆形成實驗結果顯示,對照組、sh-NC組和sh-ATF3組CRC-CSCs細胞克隆形成數量分別為(87.56±5.89)、(84.70±5.06)、(20.12±1.58)個,sh-ATF3組CRC-CSCs細胞克隆形成數量較對照組減少,差異具有統計學意義(P<0.01);而sh-NC組細胞克隆形成數量與對照組比較,差異無統計學意義(P>0.05),見圖4。

圖4 平板克隆形成實驗檢測各組CRC-CSCs細胞克隆形成能力
2.6 敲減ATF3對CRC-CSCs細胞上皮間質轉化過程的影響 免疫熒光染色結果顯示,對照組和sh-ATF3組CRC-CSCs細胞中E-cadherin熒光染色較弱,E-cadherin蛋白表達少,而Vimentin熒光染色較強,蛋白表達相對較多;sh-ATF3組CRC-CSCs細胞中E-cadherin熒光染色明顯增強,Vimentin熒光染色強度明顯減弱,表明E-cadherin蛋白表達增加、Vimentin蛋白表達下降,見圖5。Western Blot檢測結果顯示,與對照組比較,sh-ATF3組CRC-CSCs細胞中E-cadherin蛋白相對表達量較高,Vimentin蛋白相對表達量較低,差異具有統計學意義(P<0.05); sh-NC組與對照組比較,細胞中E-cadherin與Vimentin蛋白表達差異無統計學意義(P>0.05),見圖6。
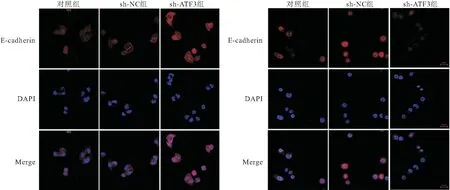
圖5 免疫熒光染色檢測各組CRC-CSCs細胞中E-cadherin、Vimentin表達

圖6 Western Blot檢測各組CRC-CSCs細胞中E-cadherin、Vimentin蛋白表達量
2.7 敲減ATF3對CRC-CSCs細胞分泌TGF-β1、VEGF、IL-6及IL-10的影響 ELISA實驗檢測結果顯示,與對照組比較,sh-ATF3組CRC-CSCs細胞上清液中TGF-β1、VEGF、IL-10的含量均明顯下降,差異具有統計學意義(P<0.01),而IL-6含量變化無統計學差異(P>0.05);sh-NC組與對照組比較,各組細胞上清液中TGF-β1、VEGF、IL-6、IL-10的含量之間的差異均無統計學意義(P>0.05),見表1。Western Blot檢測結果顯示,與對照組比較,sh-ATF3組CRC-CSCs細胞中Fas蛋白相對表達量較高,FasL蛋白相對表達量較低,差異具有統計學意義(P<0.05),sh-NC組和對照組比較,細胞中Fas和FasL蛋白相對表達量差異無統計學意義(P>0.05),見圖7。

表1 各組CRC-CSCs細胞分泌TGF-β1、VEGF、IL-6、IL-10的含量比較

圖7 Western Blot檢測各組CRC-CSCs細胞中Fas、FasL蛋白表達量
3 討論
CRC是全球常見的癌癥類型之一,給患者和社會均帶來了巨大負擔。常規化學療法常運用于CRC患者的臨床治療中,但是,除了具有潛在不良反應外,化療藥物還會誘導毒性產生限制化療效果。CRC-CSCs細胞具有多向分化潛能和自我更新能力,致瘤性較高。此外,CRC-CSCs細胞在表型和分子結構上均與腫瘤內的其他細胞不同,其對化學藥物和放射療法都具有抵抗力,常規化療藥物只能消除腫瘤細胞,但對CSCs細胞的影響并不大,這在很大程度上導致了CRC患者治療后的復發[3,8-9]。因此,確定新穎而特異的方法來靶向根除CRC-CSCs細胞,對于CRC患者的來說至關重要。
腫瘤是由多種具有異質性的細胞組成的復合物,可以輕松適應其環境并逃脫機體的免疫系統。腫瘤微環境在決定各種癌癥的進展和反應中起著至關重要的作用,其可誘導非CSC向CSC的轉化,此過程受許多因素的影響。而在多項研究中已將腫瘤微環境的改變與不同癌癥干細胞表面標志物的表達聯系起來[10]。CRC-CSCs細胞可以使用不同的細胞表面標記物進行識別,如CD133、CD24、CD44、CD29和ALDH1等[11]。其中,CD133是一種跨膜蛋白,被認為是許多類型腫瘤中癌癥干細胞的標志物。研究表明,CD133+的CRC細胞對常規化療具有抗性,且CD133高表達是CRC預后不良的一項重要標志[12-14]。目前,通過靶向腫瘤干細胞的表面標記物來消除CRC-CSCs細胞已成為CRC治療的新靶點。此外,靶向CRC-CSCs細胞相關信號通路也是一種抑制CRC-CSCs細胞的方法,例如Valverde等[15]通過COX-2抑制劑靶向CRC-CSCs細胞中對于維持細胞更新能力起重要作用的WNT/β-catenin信號途徑后發現,CRC-CSCs細胞生長受到了明顯的抑制。Network等[16]研究表明了BMI1在CRC細胞中呈現過表達,能夠誘導腫瘤發生轉移,敲低BMI1可抑制癌癥干細胞的自我更新能力。
ATF3是一種適應性基因,可對細胞外和細胞內的變化做出反應并調節細胞周期與凋亡,現已證明ATF3參與了癌癥的易感性,其表達變化可引起相關信號途徑發生改變,從而影響腫瘤的發生與發展[5,17]。據報道,在乳腺癌中ATF3能夠促進癌細胞的增殖、遷移和侵襲,與癌癥轉移密切相關,因此可被用作乳腺癌死亡相關的獨立預測因子[18]。本研究結果顯示,在分選的CRC-CSCs細胞中敲減ATF3表達后,細胞活性下降,細胞的成球個數與菌落克隆形成數目也均下降,同時,細胞中E-cadherin蛋白表達較高而Vimentin蛋白表達較低,由此說明敲減ATF3可能抑制了CRC-CSCs細胞的惡性生物學行為。
腫瘤免疫逃逸與腫瘤的發生密切相關,通過分泌免疫抑制分子來抑制免疫功能,從而發揮免疫監視逃避的作用,這也是CRC發展的一項重要機制[19]。研究表明,CRC-CSCs細胞可能參與了免疫逃逸和免疫抑制,這有助于維持腫瘤相關的巨噬細胞以及調節性T細胞介導的免疫抑制的清除作用[20]。因此,靶向CRC-CSCs已被證明是克服免疫抑制作用的一種潛在方法。本研究結果顯示,在敲減ATF3的CRC-CSCs細胞上清液中免疫抑制因子TGF-β1、VEGF、IL-10的含量均明顯下降。TGF-β1作為腫瘤細胞分泌的優勢免疫抑制分子,與腫瘤的浸潤、轉移以及分化等密切相關,VEGF參與調控腫瘤血管的生成與增生,IL-10在免疫反應和炎癥中起多方向作用,由活化的T淋巴細胞、B淋巴細胞、巨噬細胞和單核細胞所產生[21-22]。本研究發現在敲減ATF3后可上調CRC-CSCs細胞中Fas蛋白表達,并且抑制FasL蛋白表達。而免疫保護作用由Fas/FasL介導,FasL誘導的T細胞凋亡是Fas介導的凋亡過程相關因子,其細胞外結構域可以與配體FasL結合,并且傳遞死亡信號至胞質區。當FasL與Fas結合后,可形成能夠將凋亡信號傳遞至caspase 8的活性三聚體,從而激活一系列酶聯反應,最終破壞腫瘤細胞[23]。
綜上所述,本研究表明敲減ATF3可抑制結直腸癌腫瘤干細胞自我更新、上皮間質轉化,下調相關免疫抑制因子的表達,其機制可能與調控Fas/FasL途徑相關,這為CRC的診療提供一定的理論依據。盡管目前靶向腫瘤干細胞的研究發展趨勢迅速,但仍然存在許多丞待解決的問題,了解相關分子信號傳導途徑維持并調節腫瘤干細胞的作用可能是改善癌癥治療的主要手段。此外,在了解腫瘤干細胞分子和基因特征后,進一步考慮研究以檢測和靶向其他關鍵失調的途徑,從而尋找腫瘤干細胞自我更新的新治療靶標,可為闡明根除大多數惡性腫瘤細胞提供有效途徑。
4 結論
敲減ATF3可抑制結直腸癌腫瘤干細胞自我更新與上皮間質轉化,下調免疫抑制因子TGF-β1、VEGF、IL-10表達,并且上調Fas蛋白,下調FasL蛋白的表達。

