RAD51和XRCC4在伴有淋巴結轉移食管鱗癌中的表達及臨床病理意義*
張仁靜 李雨珊 莫琳 蹇順海 何欣蓉
(1.川北醫學院附屬醫院病理科,四川 南充 637000;2.川北醫學院病理教研室,四川 南充 637000;3.南充市中心醫院檢驗科,四川 南充 637000)
食管癌是我國四大最常見的腫瘤之一[1],發病隱匿,80% 以上患者確診時已進入中晚期,5 年生存率僅為 10%~30%[2]。我國食管癌患者的組織學分類以鱗狀細胞癌為主,占90%左右,發現能夠預測食管鱗癌預后的生物標志物和治療的潛在新靶點極為迫切。DNA 雙鏈斷裂(double-strand break,DSB)可以通過兩種主要途徑修復:同源重組(homologousrecombination,HR)和非同源末端連接(nonhomologous end joining,NHEJ)[3-4]。HR需要同源序列作為修復模板,其途徑的主要蛋白包括由 RAD51、BRCA1、BRCA2 和 PALB2 基因編碼的蛋白[5],RAD51是HR修復途徑的核心因子,因為其介導同源 DNA 序列和鏈入侵的配對[5-6]。 NHEJ 涉及兩個 DSB 末端的直接連接,幾乎不需要序列同源性,需要四種核心因子Ku、DNA-PKcs、XLF 和 XRCC4-LIG4,XRCC4通過與單個 XLF 二聚體兩個頭部結構域相互作用而結合 DNA 末端〔7〕,促進 LIG4 獨立的斷端橋接[7-8]。HR 或 NHEJ 中的缺陷可導致基因組不穩定性和腫瘤發生[9-10]。本實驗擬通過檢測RAD51、XRCC4蛋白在食管鱗癌細胞及組織中的表達情況,探討RAD51、XRCC4蛋白與食管鱗癌發生、發展及預后的關系,為食管鱗癌的預后預測和治療探索潛在的新臨床靶點。
1 資料與方法
1.1 一般資料 收集川北醫學院附屬醫院病理科2017~2018年食管癌根治術標本62例。術前均未行放、化療,術后活檢證實為食管鱗狀細胞癌且有淋巴結轉移,標本完整。本組患者發病年齡 41~82歲,平均年齡 62.8歲。男性 45例,女性 17 例。另從中取14例癌旁組織( 距癌灶≥3 cm)作對照。食管癌細胞系TE-1及人食管上皮細胞株HEEp均獲贈于川北醫學院風濕病研究所,新生牛血清(浙江天杭生物科技股份有限公司),DMEM(Hyclone),0.25%胰酶(Gibco),即用型快捷免疫組化MaxVisionTM試劑盒(產品編號: KIT-5010/5020/5030) 及DAB 顯色試劑盒(產品編號: DAB-2031/2032) (福州邁新生物技術開發有限公司),XRCC4(C-4):sc271087(santa CRUZ);Rad51(ab133543)(abcam)。
1.2 細胞復蘇與傳代 將人食管正常上皮細胞株HEEp、人食管癌細胞系TE-1置于37℃水浴箱中快速融化,加入含10% 胎牛血清的DMEM培養液 2 mL,1000 r/min 離心5 min,棄去上清,重懸后將細胞加入含10% 胎牛血清的DMEM培養基中,置于37℃、5% CO2培養箱中培養,待細胞融合至80%~90% 時傳代。
1.3 免疫細胞化學 制作細胞爬片,分TE-1、HEEP兩組,將細胞接種于放有爬片的六孔板中,待細胞鋪滿后,用PBS漂洗,4%多聚甲醛固定,0.5% Txiton X-100打孔,3% H2O2封閉,PBS漂洗,取出并風干爬片,分別加入RAD51抗體(1∶300)、XRCC4抗體(1∶300)4℃孵育過夜,PBS漂洗,二抗室溫孵育25 min,DAB顯色,蘇木素復染,封片劑封片。
1.4 石蠟包埋組織免疫化學 所有標本均采用4%中性緩沖甲醛固定、脫水、常規石蠟包埋、經3~5 μm連續切片,環保透明劑脫蠟,免疫組化采用MaxVisionTM染色,嚴格按照試劑盒說明操作。DAB顯色后,蘇木素復染,鹽酸酒精分化,脫水,吹干,中性樹膠封片。以PBS 緩沖液代替一抗作陰性對照,已知的陽性組織作為陽性對照。免疫組織化學結果判讀:RAD51、XRCC4蛋白均主要定位在食管鱗狀細胞癌細胞核,表現為細胞核呈淺黃色、棕黃色或棕褐色,在細胞質中也有少量表達。RAD51蛋白根據著色強度的分值: 無著色、淡黃色、棕黃色、棕褐色分別計為 0、1、2、3分,根據陽性細胞占總細胞數百分比的分值: 陽性細胞 <10%、10% ~ 24%、25%~49%、50%~74%、≥75%分別為 0、1、2、3、4分,著色強度分值×陽性細胞百分數分值計為免疫組化,本實驗0~1分判為陰性,≥2分為陽性(+)(圖1、2);XRCC4蛋白根據著色強度的分值: 無著色、淡黃色、棕黃色、棕褐色分別計為 0、1、2、3 分,根據陽性細胞占總細胞數百分比的分值 <10%、10%~50%、51%~75%、≥75%分別為 1、2、3、4 分,著色強度分值×陽性細胞百分數分值計為免疫組化,本實驗0~4分判為陰性,≥5分為陽性(+)(圖3、4)。

圖1 免疫組織化學法檢測RAD51蛋白在分化食管鱗癌組織中的表達

圖3 免疫組織化學法檢測XRCC4蛋白在分化食管鱗癌組織中的表達

圖4 免疫組織化學法檢測XRCC4蛋白在分化食管鱗癌配對癌轉移淋巴結組織中的表達
1.5 統計學分析 應用 SPSS 17.0統計軟件進行統計分析,計數資料以百分數(%)表示,采用2檢驗、 Spearman等級相關檢驗進行結果分析,Kaplan-meier進行生存分析,P<0.05為差異具有統計學意義。
2 結果
2.1 免疫細胞化學結果 RAD51、XRCC4蛋白均主要定位癌細胞核,表現為細胞核呈淺黃色、棕黃色或棕褐色,在細胞質中也有少量表達。RAD51、XRCC蛋白在食管癌細胞TE-1中呈陽性表達,而在正常食管上皮HEEp細胞中呈陰性表達(圖5)。

圖5 免疫組織化學法檢測RAD51蛋白和XRCC4蛋白的表達
2.2 RAD51、XRCC4蛋白在石蠟包埋有淋巴結轉移的食管鱗癌組織中呈陽性表達 RAD51在食管鱗癌原發灶中的陽性表達率高于癌旁組織的陽性表達率,高于配對癌轉移淋巴結中癌組織陽性表達率(P=0.000,P=0.065)(表1),XRCC4在食管鱗癌原發灶灶中的陽性表達率為62.90%,高于癌旁組織的陽性表達率,高于配對癌轉移淋巴結中癌組織的陽性表達率(P=0.041,P=0.007)(表2)。
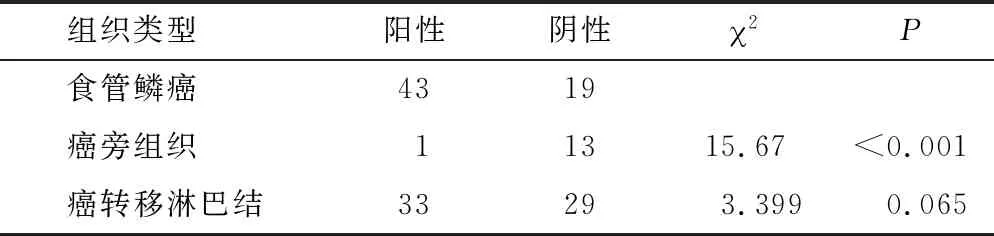
表1 RAD51蛋白在食管鱗癌及癌旁組織中的表達
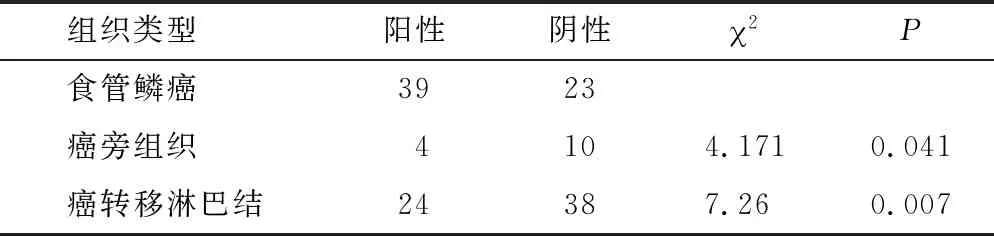
表2 XRCC4蛋白食管鱗癌及癌旁組織中的表達
2.3 RAD51、XRCC4蛋白的表達水平與患者臨床病理指標之間均無明顯相關,除了RAD51在女性中的陽性表達高于男性 RAD51在女性中的陽性表達高于男性,差異有統計學意義(P=0.022),在低分化中的陽性表達率高于在高中分化中的陽性表達率,患者年齡≥50歲的陽性表達高于<50歲的陽性表達,腫瘤最大徑≥4 cm的陽性表達高于最大徑<4 cm的陽性表達,浸潤深達全層的陽性表達低于其他組,不同P-TNM分期陽性表達不同,分期越早陽性表達率越高,但差異均無統計學意義(P=0.079,P=1.000,P=0.409,P=0.743,P=0.649)。XRCC4蛋白在男性中的陽性表達高于女性,患者年齡≥50歲的陽性表達高于<50歲的陽性表達,腫瘤最大徑≥4 cm的陽性表達高于最大徑<4cm的陽性表達,低分化的陽性表達高于高中分化的陽性表達,浸潤深達全層的陽性表達低于其他組,不同P-TNM分期陽性表達不同,分期越晚陽性表達率越高,但差異均無統計學意義(P=0.318,P=0.533,P=0.235,P=0.459,P=0.733,P=0.868)(表3)。
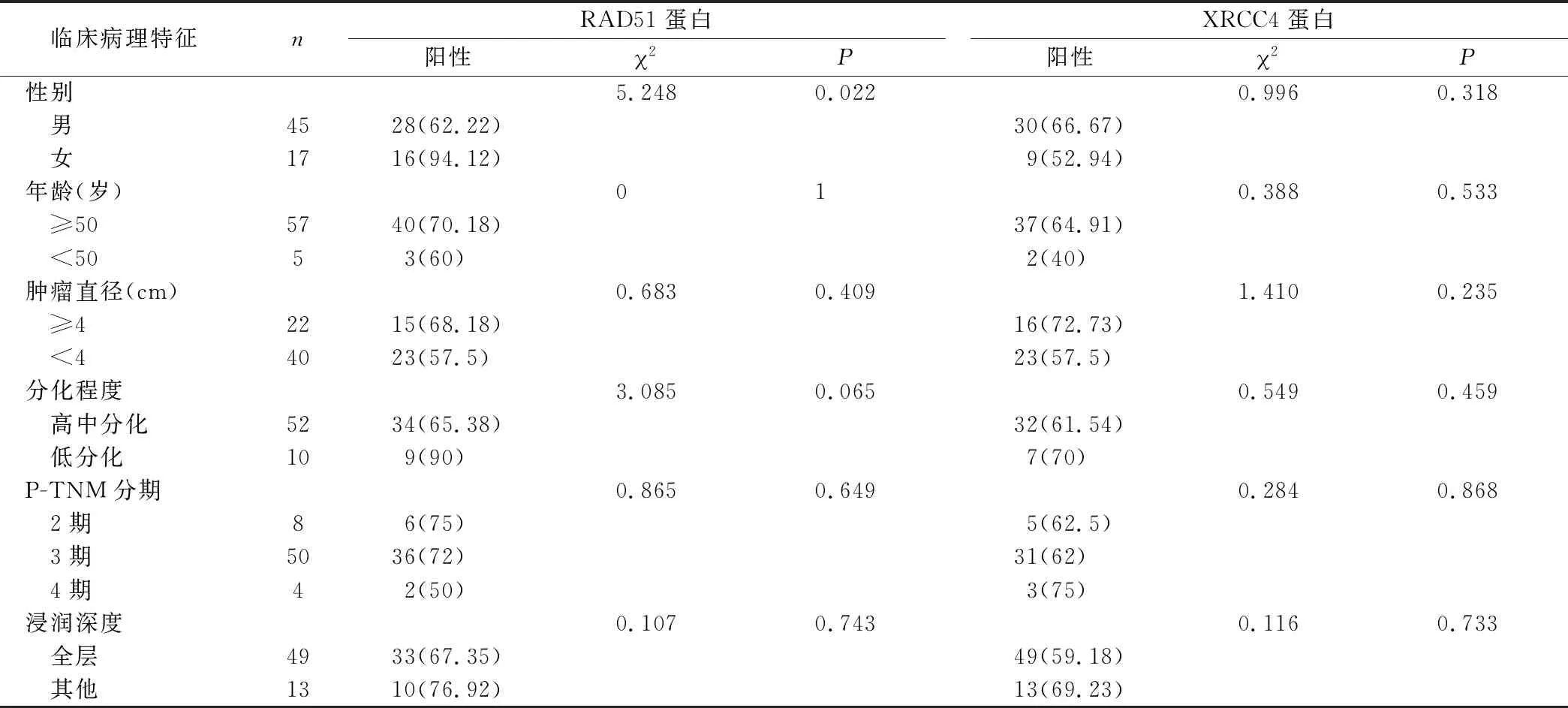
表3 RAD51、XRCC4蛋白在食管鱗癌組織中的表達及其臨床病理特征
2.4 RAD51、XRCC4蛋白在有淋巴結轉移的食管鱗癌中的陽性表達無相關 經Spearsman等級相關性分析,RAD51、XRCC4蛋白在有淋巴結轉移的食管鱗癌中的陽性表達無相關性(r=0.158,P=0.219)。
2.5 RAD51、XRCC4蛋白陽性表達與陰性表達患者的PFS無明顯差異 本研究共隨訪到了53例患者,其中 29人已有復發,4 人死亡,20人依據最后一次影像檢查時間定為刪失值。生存分析發現RAD51蛋白陽性表達與RAD51蛋白陰性表達患者的無病進展生存期(PFS)無明顯差異(2=0.029,P=0.866),見圖6;而XRCC4蛋白陽性表達患者相較XRCC4蛋白陰性表達能有較好的生存獲益,但差異無統計學意義(2=2.607,P=0.106),見圖7。

圖6 RAD51蛋白陽性表達與陰性表達患者的PFS分析

圖7 XRCC4蛋白陽性表達與陰性表達患者的PFS分析
3 討論
食管癌是我國最常見的惡性腫瘤之一,而川東北地區的閬中市、鹽亭縣等又是我國食管癌的高發區。很多原因都可以導致食管癌的發生,其中DNA雙鏈斷裂(DNA double-Strand-break, DSB)發揮了重要作用。 DSB是細胞的嚴重損傷,如果不修復,可導致染色體丟失和/或細胞死亡,如果修復不當會引起基因突變和染色體重排,從而使生物體易患免疫缺陷,神經損傷和癌癥[11];修復DNA 雙鏈斷裂的NHEJ途徑只基于斷裂末端的結構而容易出錯,可以導致DSB 位點短缺、大的缺失或染色體重排,與NHEJ相比HR途徑更精準,但也可以觸發染色體易位[12]。
據報道,RAD51 蛋白在胰腺導管腺癌、甲狀腺乳頭狀癌、乳腺癌、上皮性卵巢癌患者中過度表達[13-16],XRCC4也與食管癌、膀胱癌、星形細胞瘤的發病機制有關[17-19]。我們實驗結果顯示RAD51、XRCC4蛋白在食管鱗癌細胞系TE-1中均呈陽性表達,在食管鱗癌組織中的陽性表達水平相較癌旁組織均顯著上調。本研究臨床病理特征分析顯示,年齡越高、腫瘤直徑越大、分化程度越低,RAD51、XRCC4蛋白陽性表達率越高的趨勢,但可能由于本實驗樣本量較少,后期將增大樣本量,以驗證RAD51蛋白表達水平與臨床病理特征的關系,尤其發現RAD51蛋白在女性患者中的陽性率高于男性(P<0.05),分析可能與女性患者中組織學分類以低分化為主有關,進一步說明RAD51蛋白表達水平可能與腫瘤分化程度有關,分化越低,陽性表達越強。總之我們的實驗結果表明RAD51、XRCC4蛋白可能參與了食管鱗癌的發生和進展。選擇NHEJ還是HR途徑的關鍵在于斷裂末端的切除處理[20],NHEJ 修復的抑制促進了基于 HR 的精準修復[21-22]。比較RAD51、XRCC4蛋白在有淋巴結轉移的食管鱗癌中的陽性表達率,差異無統計學意義(P>0.05),表明兩者可能相互配合,共同參與DSB。Spearman等級相關檢驗顯示兩者無相關性,也可能和實驗樣本較少有關。
RAD51 過表達與淋巴結和遠處轉移顯著相關[23-24]。我們的實驗數據顯示 RAD51、XRCC4蛋白在食管鱗癌組織中的表達水平高于配對癌轉移淋巴結中癌組織(均P<0.05),兩者可能起著抑制食管鱗癌的淋巴結轉移作用。有研究顯示,與RAD51陽性表達的患者相比,RAD51陰性表達患者PFS 顯著延長[25],XRCC4 與星形細胞瘤預后不良相關[26]。生存分析顯示RAD51、XRCC4蛋白陽性表達與陰性表達患者的PFS無明顯差異,分析可能與實驗病例數較少,后期將加大病例量以進一步揭示RAD51、XRCC4蛋白表達在食管鱗癌中的生存意義。以上這些數據表明,我們一直認為修復DNA損傷的蛋白可能在腫瘤的發生、進展、轉移、生存預后等方面起著重要作用,但具體機制還有待進一步驗證。
4 結論
RAD51、XRCC4蛋白參與了食管鱗癌的發病機制、淋巴結轉移并可能和預后相關,是潛在的食管鱗癌診斷和預后的生物標志物。

