LncRNA MIR4435-1HG對(duì)胃癌細(xì)胞生物學(xué)特性的影響
邊康麒 費(fèi)素娟 李莉
(徐州醫(yī)科大學(xué)附屬醫(yī)院消化內(nèi)科,江蘇 徐州 221000)
近年來(lái)腫瘤的治療技術(shù)顯著提高,明顯改善了患者的預(yù)后及生存率,但胃癌患者的5年生存率仍然較低[1]。雖然有大量的研究探究了胃癌的臨床診斷方法以及化療藥物,但胃癌患者依然存在預(yù)后較差、復(fù)發(fā)率高等問(wèn)題[2]。胃癌細(xì)胞的惡性增殖以及侵襲、遷移能力的增強(qiáng)是導(dǎo)致患者腫瘤組織生長(zhǎng)、轉(zhuǎn)移的主要原因,也是患者死亡率較高的主要誘導(dǎo)因素[3]。因此,探究胃癌細(xì)胞增殖、侵襲、轉(zhuǎn)移的分子機(jī)制對(duì)改善患者的生活質(zhì)量,提高預(yù)后存活率具有重要的意義。長(zhǎng)鏈非編碼RNA(long chain non-coding RNA, LncRNA)是一類非編碼蛋白的RNA,可通過(guò)介導(dǎo)下游靶基因的沉默或激活,參與腫瘤細(xì)胞的增殖、侵襲、遷移等生物學(xué)過(guò)程[4-6]。LncRNA MIR4435-1HG 位于人染色體2q13,目前其對(duì)胃癌細(xì)胞惡性生物學(xué)行為的影響和機(jī)制還未知。因此,本文通過(guò)下調(diào)LncRNA MIR4435-1HG的表達(dá)量,觀察其對(duì)胃癌細(xì)胞增殖、凋亡、侵襲、遷移的影響,為胃癌的靶向分子診斷以及新藥物的研發(fā)提供實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1 實(shí)驗(yàn)主要材料 人胃癌細(xì)胞系(MGC-803、MKN45、AGS)以及胃黏膜上皮細(xì)胞GES-1購(gòu)自美國(guó)生物標(biāo)準(zhǔn)品收藏中心公司,胎牛血清、RPMI-1640、DMEM培養(yǎng)基、F-12K培養(yǎng)基購(gòu)自杭州四季青生物工程有限公司,Trizol試劑、Lipofectamine 2000、熒光定量PCR(Quantitative polymerase chain reaction, qPCR)試劑盒、凋亡試劑盒購(gòu)自美國(guó)Invitrogen公司,細(xì)胞計(jì)數(shù)試劑盒(Cell Counting Kit-8, CCK-8)購(gòu)自日本株式會(huì)社同仁化學(xué)研究所,MIR4435-1HG-wt、MIR4435-1HG-mut雙熒光素酶報(bào)告載體購(gòu)自上海吉?jiǎng)P基因公司,Mataigel膠購(gòu)自美國(guó)BD公司,Transwell小室購(gòu)自美國(guó)Corning公司。
1.2 實(shí)驗(yàn)方法
1.2.1 細(xì)胞的培養(yǎng) GES-1、MGC-803細(xì)胞培養(yǎng)于DMEM培養(yǎng)基,MKN45細(xì)胞培養(yǎng)于RPMI-1640培養(yǎng)基,AGS細(xì)胞培養(yǎng)于F-12K培養(yǎng)基,各培養(yǎng)基中均含有10%胎牛血清,置于5%CO2、37℃、飽和濕度的細(xì)胞培養(yǎng)箱中,每2~3 d換液,加入胰酶?jìng)鞔?1∶3)。
1.2.2 細(xì)胞的轉(zhuǎn)染 選取對(duì)數(shù)期AGS細(xì)胞,分為對(duì)照組、siRNA-NC組、siRNA-MIR4435-1HG組。對(duì)照組AGS細(xì)胞常規(guī)培養(yǎng),siRNA-NC組、siRNA-MIR4435-1HG組根據(jù)Lipofectamine 2000說(shuō)明書的指示將siRNA NC和siRNA MIR4435-1HG質(zhì)粒轉(zhuǎn)染入AGS細(xì)胞,繼續(xù)培養(yǎng)24 h。siRNA-MIR4435-1HG(5′-CACCGTTCTCCGAACGTGTCACGTCAAGA GATTACGTGACACGTTCGGAGAATTTTTTG-3′)、siRNA-NC(5′-CACCGCCCAGATTTAAGGGCTAT TTCAAGAGAATAGCCCTTAAATCTGGGCCTTT TTTG-3′)質(zhì)粒合成于上海吉瑪生物科技有限公司。
1.2.3 qPCR實(shí)驗(yàn)檢測(cè)LncRNA MIR4435-1HG表達(dá)量 加入Trizol試劑提取各組AGS細(xì)胞總RNA,在反轉(zhuǎn)錄試劑的誘導(dǎo)下合成cDNA。LncRNA MIR4435-1HG、miR-150-5p、U6引物均合成于上海生工公司,見(jiàn)表1。以U6為內(nèi)參,進(jìn)行熒光定量PCR,擴(kuò)增條件為95℃ 10 min,95℃ 20 s,59℃ 30 s,35個(gè)循環(huán),2-ΔΔCt法計(jì)算LncRNA MIR4435-1HG表達(dá)量。

表1 引物序列
1.2.4 CCK-8檢測(cè)各組AGS細(xì)胞吸光值 收集對(duì)照組、siRNA-NC組、siRNA-MIR4435-1HG組AGS細(xì)胞,接種至96孔板(1×104個(gè)/孔),5%CO2、37℃分別培養(yǎng)24、48、72 h,每孔加入10 μL CCK-8,繼續(xù)培養(yǎng)2.5 h,酶標(biāo)儀檢測(cè)450 nm下AGS細(xì)胞吸光值(OD值)。
1.2.5 流式細(xì)胞術(shù)檢測(cè)各組凋亡率 在凋亡試劑盒說(shuō)明書的指示下,將對(duì)照組、siRNA-NC組、siRNA-MIR4435-1HG組AGS細(xì)胞密度調(diào)整為1×106/mL,培養(yǎng)24 h,每孔加入10 μL 磷脂酰結(jié)合蛋白V-FITC和5 μL 碘化丙啶,4℃染色15 min,置于流式細(xì)胞儀上分析凋亡率。
1.2.6 細(xì)胞劃痕實(shí)驗(yàn)檢測(cè)劃痕愈合率 分別收集2×105個(gè)對(duì)照組、siRNA-NC組、siRNA-MIR4435-1HG組AGS細(xì)胞,接種至6孔板,5%CO2、37℃培養(yǎng)24 h,待細(xì)胞密度為80%~90%,通過(guò)一次性吸頭在培養(yǎng)板中劃線,記錄0、24 h劃痕寬度,計(jì)算劃痕愈合率。劃痕愈合率(%)=(0 h劃痕寬度-24 h劃痕寬度)/0 h劃痕寬度×100%。
1.2.7 Transwell實(shí)驗(yàn)檢測(cè)各組遷移能力 將Mataigel膠與無(wú)血清培養(yǎng)基1∶8混合,吸取50 μL Mataigel膠稀釋液加入Transwell上室膜,37℃靜置2 h,凝固后備用。收集各組轉(zhuǎn)染24 h AGS細(xì)胞,更換為無(wú)血清培養(yǎng)基,吸取200 μL(5×105個(gè)/mL) AGS細(xì)胞懸液加入Transwell上室中,下室加入600 μL含10%胎牛血清的培養(yǎng)基,37℃孵育24 h,棉簽去除殘留AGS細(xì)胞,4%多聚甲醛固定30 min,0.1%結(jié)晶紫染色30 min,顯微鏡下計(jì)數(shù)。
1.2.8 雙熒光素酶報(bào)告基因 在線數(shù)據(jù)庫(kù)DIANA-LncBase v2(http://www.microrna.gr/LncBase)預(yù)測(cè)LncRNA MIR4435-1HG與微小RNA-150-5p(micro RNA-150-5p,miR-150-5p)的靶向關(guān)系。MIR4435-1HG-wt為野生型雙熒光素酶報(bào)告載體,含有與miR-150-5p靶向結(jié)合的位點(diǎn);MIR4435-1HG-mut為突變型雙熒光素酶報(bào)告載體,不含與miR-150-5p靶向結(jié)合的位點(diǎn);將MIR4435-1HG-wt和MIR4435-1HG-mut分別與過(guò)表達(dá)miR-150-5p、miR-NC質(zhì)粒共轉(zhuǎn)染,測(cè)定AGS細(xì)胞中熒光素酶的相對(duì)活性。
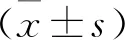
2 結(jié)果
2.1 LncRNA MIR4435-1HG在細(xì)胞系中的表達(dá)量 與胃黏膜上皮細(xì)胞GES-1相比,LncRNA MIR4435-1 HG在MGC-803、AGS、MKN45細(xì)胞系中的表達(dá)量上調(diào),差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表2。其中在AGS細(xì)胞中的表達(dá)量相對(duì)較高,因此作為后續(xù)研究對(duì)象。

表2 LncRNA MIR4435-1HG在胃癌細(xì)胞系中的表達(dá)量
2.2 轉(zhuǎn)染后AGS細(xì)胞中LncRNA MIR4435-1HG表達(dá)量的變化 siRNA-NC組AGS細(xì)胞中LncRNA MIR4435-1HG表達(dá)量與對(duì)照組相比差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),但siRNA-MIR4435-1HG組AGS細(xì)胞中LncRNA MIR4435-1HG表達(dá)量降低,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表3。

表3 轉(zhuǎn)染后AGS細(xì)胞中LncRNA MIR4435-1HG表達(dá)量的變化
2.3 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞增殖、凋亡的影響 siRNA-NC組AGS細(xì)胞增殖與對(duì)照組相比差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),但siRNA-MIR4435-1HG組AGS細(xì)胞增殖在24 h差異不顯著,在48、72 h增殖明顯降低,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表4。siRNA-NC組AGS細(xì)胞與對(duì)照組凋亡率比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),但siRNA-MIR4435-1HG組細(xì)胞凋亡率明顯增加(P<0.05),見(jiàn)圖1。

表4 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞增殖的影響

圖1 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞凋亡的影響
2.4 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞侵襲、遷移的影響 siRNA-NC組AGS細(xì)胞劃痕愈合率、侵襲細(xì)胞數(shù)與對(duì)照組相比差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),但siRNA-MIR4435-1HG組AGS細(xì)胞劃痕愈合率、侵襲細(xì)胞數(shù)明顯降低,差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),見(jiàn)表5、圖2~3。

表5 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞侵襲、遷移的影響

圖2 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞劃痕愈合率的影響

圖3 下調(diào)LncRNA MIR4435-1HG對(duì)AGS細(xì)胞侵襲的影響
2.5 靶基因的預(yù)測(cè)和驗(yàn)證 在線軟件DIANA-LncBase v2預(yù)測(cè)LncRNA MIR4435-1HG的下游靶基因結(jié)果顯示,LncRNA MIR4435-1HG基因3′端非翻譯區(qū)域可特異性結(jié)合于miR-150-5p,見(jiàn)圖4。雙熒光素酶驗(yàn)證報(bào)告進(jìn)一步驗(yàn)證結(jié)果顯示,上調(diào)miR-150-5p與MIR4435-1HG-wt共轉(zhuǎn)染較miR-NC組與MIR4435-1HG-wt共轉(zhuǎn)染降低AGS細(xì)胞熒光素酶活性(P<0.05);但上調(diào)miR-150-5p與MIR4435-1HG-mut共轉(zhuǎn)染對(duì)AGS細(xì)胞熒光素酶相對(duì)活性無(wú)明顯影響,見(jiàn)表6。

圖4 LncRNA MIR4435-1HG與miR-150-5p結(jié)合位點(diǎn)

表6 雙熒光素酶活性檢測(cè)結(jié)果
3 討論
胃癌的病理進(jìn)程與多種病因相關(guān),如吸煙、遺傳因素、飲食習(xí)慣等均可誘導(dǎo)胃癌的發(fā)生、發(fā)展[7]。胃癌患者約95%為腺癌,早發(fā)現(xiàn)、早治療是臨床治療胃癌最有效的方法,但由于早期診斷方法的局限性,導(dǎo)致大部分患者確診時(shí)已是晚期或已發(fā)生轉(zhuǎn)移[8]。因此明確胃癌的發(fā)生、發(fā)展分子機(jī)制對(duì)臨床探究特異性的分子診斷物尤為重要。
LncRNA是一類長(zhǎng)度超過(guò)200個(gè)核苷酸的小分子非編碼RNA,參與腫瘤的發(fā)生、發(fā)展過(guò)程[9]。LncRNA MIR4435-1HG是近年來(lái)發(fā)現(xiàn)的一種非編碼RNA,在多種腫瘤中發(fā)揮調(diào)控作用。研究[10]表明,LncRNA MIR4435-1HG在腎癌中表達(dá)升高,其高表達(dá)與TNM分期、腫瘤大小和Fuhrman等級(jí)及患者預(yù)后密切相關(guān),敲低其表達(dá)可抑制腎癌細(xì)胞增殖、遷移和侵襲。LncRNA MIR4435-1HG在口腔癌組織中表達(dá)上調(diào),其高表達(dá)的患者總生存期和無(wú)復(fù)發(fā)生存期相對(duì)較短[11]。但目前,LncRNA MIR4435-1HG對(duì)胃癌發(fā)生、發(fā)展的影響還未知。本研究顯示,LncRNA MIR4435-1HG在胃癌細(xì)胞系中的表達(dá)量明顯上調(diào),進(jìn)一步下調(diào)LncRNA MIR4435-1HG的表達(dá)量發(fā)現(xiàn),降低LncRNA MIR4435-1HG的水平抑制了胃癌AGS細(xì)胞增殖、侵襲和遷移,且誘導(dǎo)其凋亡,提示LncRNA MIR4435-1HG在胃癌中也發(fā)揮促癌基因作用,促進(jìn)胃癌的發(fā)展進(jìn)程,其可能是胃癌治療的潛在分子靶點(diǎn)。
LncRNA可作為競(jìng)爭(zhēng)性內(nèi)源性RNA與miRNA靶向結(jié)合,調(diào)控其靶基因的表達(dá),進(jìn)而影響疾病的發(fā)展進(jìn)程[12-13]。miRNA也是一類廣泛存在于真核生物中的小分子非編碼RNA,其長(zhǎng)度為18~25個(gè)核苷酸,在腫瘤的病理進(jìn)程中發(fā)揮重要調(diào)節(jié)作用[14-16]。miR-150-5p在骨肉瘤[17]、肺鱗癌[18]、膠質(zhì)瘤[19]、結(jié)腸癌[20]和黑色素瘤[21]等多種腫瘤組織中表達(dá)下調(diào),上調(diào)其表達(dá)抑制了腫瘤細(xì)胞的增殖、侵襲等惡性行為;而在乳腺癌[22]、宮頸癌[23]等腫瘤中表達(dá)升高,發(fā)揮促癌基因作用。為進(jìn)一步探究LncRNA MIR4435-1HG調(diào)節(jié)胃癌細(xì)胞增殖、侵襲的作用機(jī)制,本實(shí)驗(yàn)通過(guò)在線數(shù)據(jù)庫(kù)預(yù)測(cè)LncRNA MIR4435-1HG的下游靶miRNA結(jié)果顯示,miR-150-5p可能是LncRNA MIR4435-1HG的靶基因,進(jìn)一步通過(guò)雙熒光素酶報(bào)告基因?qū)嶒?yàn)證實(shí)了這一結(jié)果,提示LncRNA MIR4435-1HG可能通過(guò)靶向調(diào)控miR-150-5p促進(jìn)AGS細(xì)胞增殖、侵襲、遷移。當(dāng)然,本研究尚存在一些不足,如缺乏動(dòng)物模型、臨床樣本等研究數(shù)據(jù)以及LncRNA MIR4435-1HG靶向調(diào)節(jié)miR-150-5p的分子機(jī)制尚不十分清楚,均需進(jìn)一步深入研究。
4 結(jié)論
LncRNA MIR4435-1HG在多種胃癌細(xì)胞系中表達(dá)量上調(diào);下調(diào)LncRNA MIR4435-1HG抑制AGS細(xì)胞增殖、侵襲、遷移,誘導(dǎo)凋亡,可能通過(guò)靶向調(diào)控miR-150-5p發(fā)揮作用,為胃癌的早期診斷、治療提供了基礎(chǔ)實(shí)驗(yàn)。

