氧化法去除循環冷卻水中氯離子的應用研究
李 楊
(深圳市碩創環保科技有限公司,深圳 518115)
石化企業在生產過程中會產生大量的循環冷卻廢水,由于其含有較高濃度的氯離子,不能夠繼續循環利用[1]。氯離子是一種活性離子,能破壞合金、不銹鋼、碳鋼和鋁表面的鈍化膜,加速設備的腐蝕速度[2]。如果高氯廢水未經處理,就直接排放到自然水體中,會給水體帶來較多的不利影響,長期以往會導致水生生物的死亡;含氯廢水進入土壤還會導致土壤硬化結塊,影響農作物的生長,所以,研究氯離子的去除技術是很有必要的。
目前,氯離子的去除方法主要有離子交換法[3]、膜分離法[4]、電化學法[5]、化學沉淀法[6-7]。離子交換法主要通過離子交換劑將廢水中的氯離子置換出來,以達到去除氯離子的目的。該方法存在交換劑容易飽和、操作過程繁瑣和產生大量再生廢液等不足,使其在實際生產過程中的應用受到限制。膜分離法是利用物質透過一層特殊膜的速度差而進行分離、濃縮或脫鹽的一種分離過程。其中反滲透膜脫氯技術已經得到了廣泛的應用,但是該技術具有分離效率低、膜組件易損耗、運行成本高等問題,也需要得到進一步地解決。電化學法是利用不同離子在正負極間具有不同吸引力的特點,進行脫鹽除氯的技術。該方法對電極材料的要求極高,運行能耗成本也非常大,所以應用范圍較窄。化學沉淀法主要是通過鈣鹽和鋁鹽與氯離子在一定的條件下形成穩定的鈣鋁氯弗氏鹽Ca2AlCl(OH)6沉淀,從而將氯離子去除的方法。化學沉淀法具有原材料來源廣泛、對設備要求低、處理效率高等優點,但是也存在氯離子去除率低和污泥產生量大等不足。氧化還原法脫除氯離子的文獻研究較少,該方法的具體使用條件不清楚,除氯過程中同時也會產生有害氣體氯氣,對人體和環境都會造成危害,因此其應用受到一定的限制。本實驗是在綜合考慮處理效果、經濟成本、環保安全等因素的前提下,選用次氯酸鈉和硫酸作為藥劑處理循環冷卻水。在酸性條件下,通過次氯酸的氧化作用將氯離子氧化成氯氣,實現了對水中氯離子的去除,產生的廢氣氯氣用氯化亞鐵溶液吸收后得到水處理用的氯化鐵混凝劑,從而達到了整個除氯過程綠色環保和資源循環的目的,最終實現了含氯廢水的循環使用。
1 實驗過程
1.1 實驗材料與儀器
主要實驗藥品:次氯酸鈉、濃硫酸、氯化亞鐵,均購自國藥集團化學試劑有限公司;
含氯廢水:山東東營石化生產冷卻循環水;
實驗儀器:精密電子天平,賽多利斯BSA1245-CW;八孔磁力攪拌恒溫水浴鍋:天津予華SHJ-8D;水樣抽濾裝置:天青島路博LB-315。
1.2 實驗方法
準確移取500 mL廢水加入到燒杯中,依次加入適量的次氯酸鈉和濃硫酸,然后置于八孔磁力攪拌恒溫水浴鍋上進行攪拌反應,反應一定時間后抽濾,并從濾液中取樣分析氯離子濃度。濾液中氯離子濃度的測定參考GB11896-89《水質 氯化物的測定 硝酸銀滴定法》。氯離子去除率的計算公式:氯離子去除率式中:C0—初始氯離子濃度,單位:ppm;C1—濾液氯離子濃度,單位:ppm。
2 結果與分析
2.1 次氯酸鈉加藥量對氯離子去除的影響
在反應溫度為35 ℃、攪拌時間為60 min、硫酸和Cl-摩爾比為2的條件下,次氯酸鈉投加量分別為0.31、0.62、0.93、1.24、1.55、1.86 g,考察次氯酸鈉對Cl-去除效果的影響。采用氧化法處理初始Cl-質量濃度為1 200 mg/L的東營石化循環冷卻水。具體實驗結果如圖1所示。
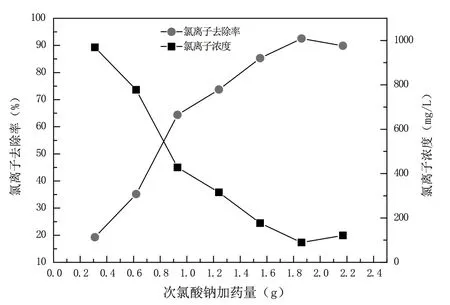
圖1 次氯酸鈉加藥量對氯離子去除率的影響
由圖1可知,隨著次氯酸鈉投加量的增加,Cl-去除率先增大后減小,當次氯酸鈉投加量超過0.93 g后,Cl-去除率明顯增大,達到64.36%。繼續增加次氯酸鈉的投加量,Cl-去除率開始緩慢增加,當次氯酸鈉的加藥量為1.86 g時,Cl-去除率最高能達到92.55%,其反應式如下:
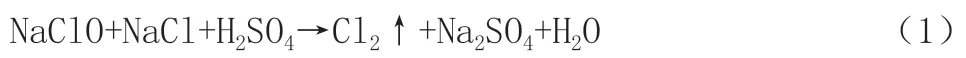
當次氯酸鈉投加量為2.17 g時,Cl-去除率減小到89.86%,分析其原因,可能是過量的未參與反應的次氯酸鈉在酸性條件下,自身分解成氯離子,從而導致溶液中氯離子含量的增大,反應式如下:

從經濟成本的角度考慮,在保障氯離子濃度小于200 mg/L的前提下,后續實驗選定的次氯酸鈉投加量為1.55 g。
2.2 硫酸加藥量對氯離子去除的影響
在反應溫度為35 ℃、攪拌時間為60 min、次氯酸鈉投加量為1.55 g的條件下,硫酸與Cl-摩爾比分別為0.5、1.0、2.0、3.0、4.0、5.0時,考察硫酸加藥量對Cl-去除效果的影響。采用氧化法還原法處理初始Cl-質量濃度為1 200 mg/L的東營石化循環冷卻水。具體實驗結果如圖2所示。
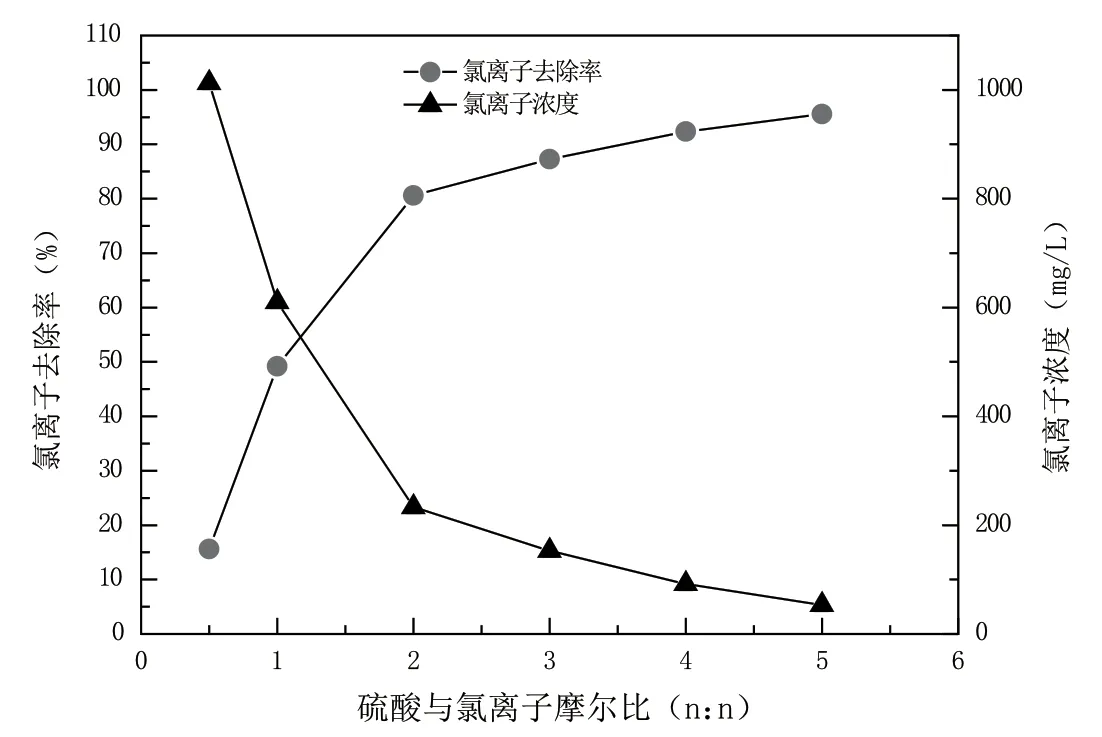
圖2 硫酸加藥量對氯離子去除率的影響
由圖2可知,隨著H2SO4投加量的增加,Cl-的去除率迅速降低,當硫酸與Cl-摩爾比為2.0時,Cl-的去除速度達到最大,為80.60%。分析原因可能是隨著硫酸投加量的增大,溶液中氫離子濃度也會增加,EClO-/Cl2電極電勢將變大,次氯酸鈉氧化Cl-的能力變強,因此,反應越有利于向生成氯氣的方向移動。同時,在強酸性條件下,氯氣在溶液中的化學平衡向左移動,可加快其逸出速度,反應式如下:

硫酸與Cl-摩爾比大于2.0之后,Cl-的去除率將緩慢增加,當硫酸與Cl-摩爾比為4.0時,Cl-的去除率最大能達到92.37%,氯離子濃度為153 mg/L,可以滿足工業循環冷卻水處理設計規范的再生水回用標準(GB50050-2017)。從經濟角度考慮,硫酸與Cl-摩爾比為3.0時,綜合成本最低。
2.3 反應溫度對氯離子去除的影響
在攪拌時間為60 min、硫酸和Cl-摩爾比為3.0,次氯酸鈉投加量為1.55 g,反應溫度為分別為15 ℃、25 ℃、35 ℃、45 ℃、55 ℃、65 ℃時,考察溫度對Cl-去除效果的影響。采用氧化法還原法處理初始Cl-質量濃度為1 200 mg/L的東營石化循環冷卻水。具體實驗結果如圖3所示。
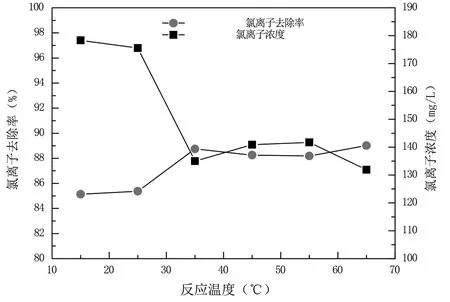
圖3 溫度對氯離子去除的影響
從圖3可以看出:隨著反應溫度的逐漸升高,氯離子的去除率持續增大,但是整體增加幅度不大,其原因是采用氧化還原法去除石化冷卻循環水中的氯離子時,生成的氯氣在酸性條件下,溶解度比較低,當反應溫度較低時,生成的氯氣也能迅速逸出,從而加快了反應的正向進行;隨著反應溫度的升高,生成的氯氣被蒸餾排出,反應持續正向進行,氯離子的去除率進一步增大。考慮到實際應用條件,能耗最小時,35 ℃為最佳反應溫度。
2.4 反應時間對氯離子去除的影響
在反應溫度為35 ℃、硫酸和Cl-摩爾比為3.0,次氯酸鈉投加量為1.55 g,反應時間分別為20 min、40 min、60 min、80 min、100 min、120 min,考察反應時間對Cl-去除效果的影響。采用氧化法還原法處理初始Cl-質量濃度為1 200 mg/L的東營石化循環冷卻水。具體實驗結果如圖4所示。
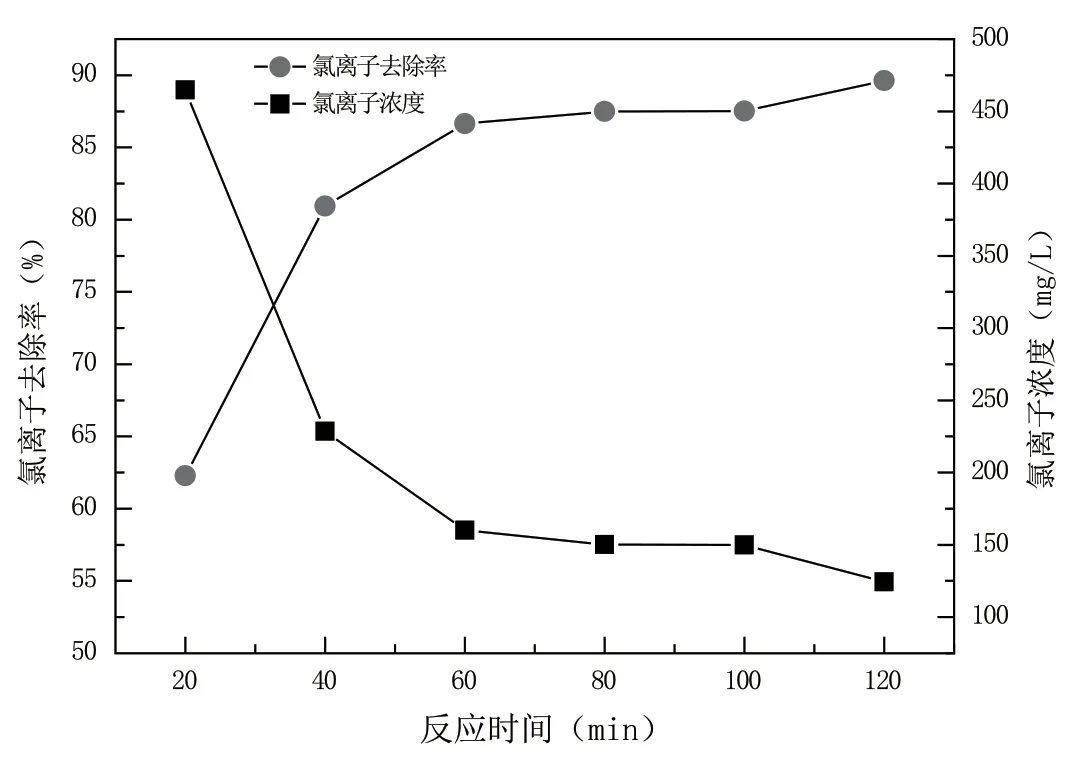
圖4 反應時間對氯離子去除的影響
由圖4可知,反應時間對氯離子去除效果影響顯著,隨著反應時間的增加,氯離子的濃度逐漸降低,當反應時間為40 min時,氯離子的去除速度達到最大值。當反應時間大于60 min后,氯離子的去除率變化不大。表明溶液中次氯酸鈉與氯離子反應完全,增加時間只是排除溶液中殘留的氯氣,對提高氯離子的去除率效果不明顯。所以,60 min為氧化還原除氯離子的最佳反應時間。
2.5 氯氣無害化處置與資源化利用
用質量分數為20%的FeCl2溶液吸收上述反應所產生的廢氣氯氣,氯氣將Fe2+氧化成Fe3+,溶液顏色由黃綠色變成紅棕色,最后吸收液經過水解陳化后,得到符合《水處理劑聚氯化鐵》(HG/T4482—2018)要求的產品,達到資源化利用的目的,化學反應式如下:
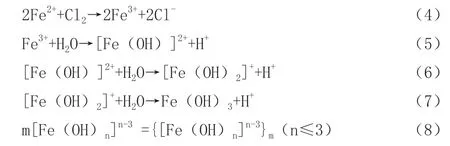
試驗結果表明,氯化亞鐵溶液基本可以完全吸收氯氣,且吸收效果好,尾氣能夠滿足大氣污染物綜合排放標準《GB16297-1996》要求,具體工藝流程如圖5所示。

圖5 FeCl2吸收廢氯氣制氯化鐵工藝流程
3 結論
(1)利用次氯酸鈉和硫酸氧化還原法處理氯離子初始濃度為1 200 mg/L的東營石化冷卻循環水的廢水時,廢水中的氯離子可與次氯酸根離子反應生成氯氣,在次氯酸鈉投加量為1.55 g、硫酸與Cl-摩爾比為3:1、反應溫度為35 ℃、反應時間為60 min的條件下,Cl-的去除率可達到86.65%,濃度為160.2 mg/L,處理后能夠滿足工業循環冷卻水處理設計規范的再生水回用標準(GB50050-2017)。
(2)充分利用氯氣具有氧化性的特點,在不造成二次污染的情況下,將其用20%的FeCl2溶液吸收并制備成水處理劑FeCl3,整個除氯過程無廢渣、廢氣的產生,達到了安全環保的效果。

