苯乙基異硫氰酸酯對良性前列腺上皮細胞增殖凋亡的影響及相關機制研究
劉志斌 靳 松 牛亦農
(1.無錫市第二人民醫院泌尿外科,江蘇無錫 214001; 2.清華大學附屬北京清華長庚醫院泌尿外科,北京 102200; 3. 首都醫科大學附屬北京世紀壇醫院泌尿外科, 北京 100038)
良性前列腺增生(benign prostatic hyperplasia, BPH)是引起中老年男性排尿功能障礙原因中最常見的一種良性疾病。其主要表現為尿急、尿頻、排尿不暢、終末滴瀝及夜尿增多等下尿路癥狀,后期可逐漸加重為排尿困難、尿潴留等。BPH發病率隨年齡的增長而增加,60歲男性發病率為50%,70歲男性發病率達80%,85歲以上發病率達90%[1-4]。隨著人口老齡化的增加,良性前列腺增生已經成為泌尿外科最常見的疾病之一,嚴重影響著患者的生活質量。
目前針對前列腺增生的治療包括藥物治療(5α-還原酶抑制劑、α-腎上腺素能受體拮抗劑、中藥制劑以及植物制劑等)和手術治療(經尿道或開放式手術)。對于大多數有癥狀的BPH男性,藥物治療是首選的初始治療方法。
苯乙基異硫氰酸酯(phenethyl isothiocyanate, PEITC)是植物制劑異硫氰酸酯的一種,廣泛存在于橄欖、花菜等十字花科蔬菜中[5]。現已發現其在多種腫瘤治療中具有抑制細胞增殖、促進細胞凋亡的作用[5-6]。現有研究[7]表明,針對良性前列腺增生的治療中,PEITC可以通過下調雄激素受體轉錄因子sp1的表達而下調雄激素受體的表達,從而抑制大鼠前列腺上皮細胞的增殖。但對體外培養的良性前列腺上皮細胞的作用還未見相關報道。X染色體連鎖凋亡抑制蛋白(X-linked inhibitor of apoptosis, XIAP)是凋亡抑制蛋白家族中的典型成員,可通過抑制啟動Caspase-9,從而抑制其效應蛋白Caspase-3和Caspase-7,最終抑制細胞凋亡[8]。
PEITC作為潛在的治療前列腺增生的植物制劑,能否對前列腺上皮細胞的存活產生影響,能否成為有效的治療藥物尚需進一步研究。本研究采用PEITC作用于前列腺上皮細胞(benign prostatic hyperplasia cell line,BPH-1),觀察PEITC對BPH-1細胞增殖、凋亡與自噬的影響;檢測XIAP mRNA及其蛋白表達,以及自噬相關蛋白的表達情況,初步探討PEITC對前列腺上皮細胞增殖凋亡的影響及相關機制。
1 材料與方法
1.1 實驗材料
人永生化良性前列腺上皮細胞(BPH-1)購于中國醫學科學院細胞中心。PEITC(純度≥98%)由無錫杰西醫藥科技有限公司贈送。 二甲基亞砜(dimethyl sulfoxide,DMSO)購買于美國Invitrogen 公司。PEITC使用前用DMSO稀釋,同時將等體積的DMSO(最終質量濃度<0.1%)添加到對照組中。細胞培養試劑包括RPMI-1640培養基、胎牛血清(fetal bovine serum,FBS)和青霉素/鏈霉素抗生素混合物,均購自澳洲Gibco公司。CCK-8細胞增殖毒性檢測試劑盒購自日本株式會社同仁化學研究所。Annexin V-FITC/PI細胞凋亡檢測試劑盒購自中國南京凱基生物科技公司。XIAP-Atg 5-12和β-actin抗體購自美國Cell Signaling Technology公司。Fast Quant RT試劑盒和Talent qPCR PreMix(SYBR Green)購自北京天根生物科技公司。
1.2 細胞培養及活性檢測
BPH-1細胞用含有10%(體積分數)FBS的RPMI-1640培養基于37 ℃,5%(體積分數) CO2條件下培養。取對數期生長的細胞接種于96孔培養板中,每孔1 000個細胞,加入培養基200 μL。37 ℃,5%(體積分數)CO2條件下培養24 h,使細胞貼壁。更換細胞培養基,分別向96孔板中加入終濃度為6、12、24 μmol/L的PEITC作為實驗組,對照組加入等體積的DMSO,分別作用6、12、24、36 h。孵育結束后,每孔分別加入10 μL CCK-8溶液,充分混勻,繼續孵育2 h。用酶標儀測定各孔450 nm處吸光度,并計算細胞活性。細胞存活率=(實驗孔-空白孔)/(對照孔-空白孔)。
1.3 流式細胞技術檢測細胞凋亡率
取對數期生長的BPH-1細胞接種于6孔培養板中,每孔5×106個細胞,加入培養基2 mL。37 ℃,5%(體積分數)CO2條件下培養24 h,使細胞貼壁。分別向6孔板中加入終濃度為6、12、24 μmol/L的PEITC作為實驗組,對照組加入等體積的DMSO,繼續孵育24 h。磷酸鹽緩沖液(phosphate buffered saline,PBS)清洗2次,用不含乙二胺四乙酸的胰酶消化后1 200 r/min 離心,棄上清,制備單細胞懸濁液。細胞計數板進行細胞密度計算,計數并調整細胞密度至106個/mL。取1 mL懸濁液,1 200 r/min離心5 min,棄上清。加入400 μL Binding Buffer 及5 μL Annexin-V/FITC 輕混勻,避光冰上放置15 min。加入10 μL PI后輕混勻,避光冰上放置5 min。流式上機檢測細胞凋亡率。
1.4 Western blotting法檢測細胞蛋白表達水平
取對數期生長的BPH-1細胞接種于6孔培養板中,方法同上,附壁過夜培養24 h。分別向6孔板中加入終濃度為6、12、24 μmol/L的PEITC作為實驗組,對照組加入等體積的DMSO,繼續孵育24 h。預冷的PBS 3 μL清洗細胞3次,加入含有苯甲基磺酰氟的RIPA細胞裂解液400 μL后置于冰上30 min,充分裂解,取樣本置于1.5 mL離心管中。渦旋震蕩充分混勻,于4 ℃預冷的離心機內,12 000 r/min離心5 min。取上清液即細胞全蛋白。BCA法制作標準曲線,測定蛋白濃度。制備10%(質量分數)的SDS-PAGE分離膠及聚集膠。配平后,分別加樣Loading Buffer及蛋白共10 μL,80 V恒壓電泳。400 mA恒流電轉90 min,將蛋白轉移至PVDF膜上。脫脂牛奶封閉抗原30 min,TBST清洗3次,每次10 min。XIAP抗體,Atg5-12 抗體1∶1 000稀釋,β-actin 抗體1∶1 500稀釋。4 ℃孵育抗體過夜,TBST洗脫3次,孵育二抗2 h。Odyssey雙色紅外激光成像系統曝光,軟件Image J V 4.0計算蛋白表達。
1.5 Real-time PCR 檢測BPH-1細胞XIAP mRNA表達
按照如上方式培養BPH-1細胞24 h,采用TRIzol-異丙醇-氯仿-乙醇三步法進行細胞總RNA提取。測定RNA濃度,用QuantScript Kit將1mg總RNA反轉錄為cDNA。 然后按照Talent熒光定量檢測試劑盒(SYBR Green),25 μL反應體系配比各試劑。RT-PCR反應引物及體系如下:XIAP反應引物為:Forward:5′-TACCGTGCGGTGCTTTAGTT-3′;Reverse:5′-TTTGTAGACTGCGTGGCACT-3′;GAPDH反應引物為:Forward:5′-GAAGGTGAAGGTCGGATGC-3′;Reverse:5′-GAAGATGGTGATGGGATTTC-3′;反應體系:預變性:95 ℃,15 min;變性:95 ℃、10 s;退火:57 ℃、30 s;延伸:72 ℃、30 s,40個循環。所得數據與內參GAPDH之比作為相對值,通過公式2-ΔΔCt計算得到目的基因的相對表達量。
1.6 統計學方法

2 結果
2.1 PEITC對BPH-1細胞增殖的影響
BPH-1細胞經過6、12、24 μmol/L PEITC 處理6 h后,細胞相對活性分別為71.22%、48.90%、13.57%;處理12 h后細胞相對活性分別為52.57%、42.37%、10.11%;處理24 h后細胞相對活性分別為36.73%、25.88%、8.39%;處理36 h后,細胞相對活性分別為33.57%、25.83%、13.06%(圖1)。細胞相對活性呈現時間和濃度依賴性。
2.2 流式細胞技術檢測PEITC對于BPH-1細胞凋亡的影響
Annexin-V/PI 染色結果如下圖所示(圖2A)。BPH-1細胞經過6、12、24 μmol/L PEITC處理24 h后,細胞總凋亡率分別為19.5%、30.4%、40.1% (圖2B),與對照組相比,12、24 μmol/L處理組差異具有統計學意義(P<0.05)。
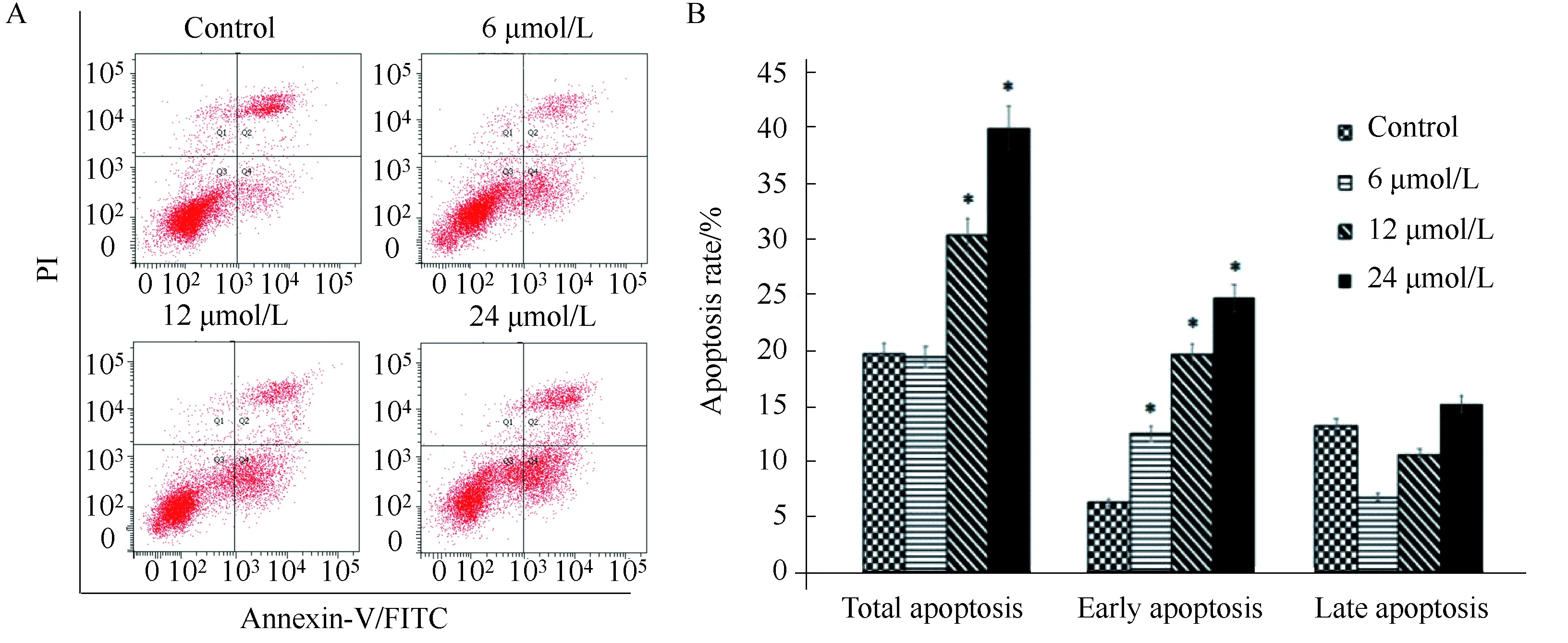
圖2 PEITC處理的BPH-1細胞的細胞凋亡率Fig.2 Apoptosis of BPH-1 cells treated with PEITCA: PEITC promoted apoptosis of BPH-1 cells; B: PEITC promoted early apoptosis of BPH-1 cells in a concentration-dependent; *P<0.05 vs control. Early apoptosis: Annexin V+/PI-; Late apoptosis: Annexin V+/PI+; PEITC: phenethyl isothiocyanate; BPH-1: benign prostatic hyperplasia cell line.
2.3 PEITC下調XIAP蛋白表達
Western blotting結果顯示,BPH-1細胞經過6、12、24 μmol/L PEITC 處理24 h后,細胞內XIAP蛋白表達量較對照組下降(圖3)。
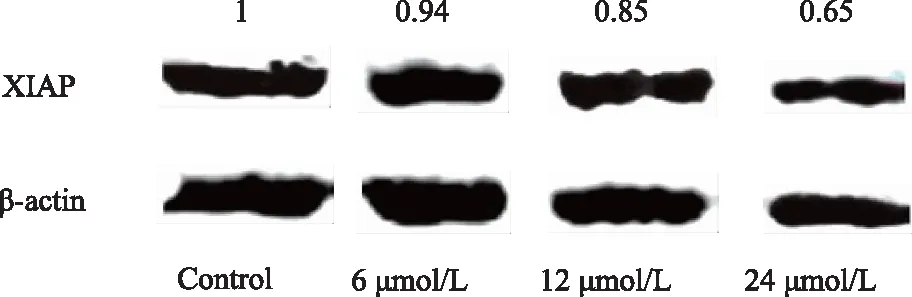
圖3 PEITC對BPH-1細胞中XIAP表達的影響Fig.3 The effects of PEITC on the expression of XIAP in BPH-1 cells PEITC suppressed the expression of XIAP in BPH-1 cells in a concentration-dependent way. β-Actin was used as a loading control; PEITC: phenethyl isothiocyanate; BPH-1: benign prostatic hyperplasia cell line; XIAP: X-linked inhibitor of apoptosis.
2.4 PEITC下調XIAP mRNA的表達
Real-time PCR結果顯示,BPH-1細胞經過6、12、24 μmol/L PEITC處理24 h后,XIAP mRNA相對表達量較對照組分別下調了1.212倍、1.37倍、2.918倍。與對照組相比,12、24 μmol/L處理組差異具有統計學意義(P<0.05)(圖4)。
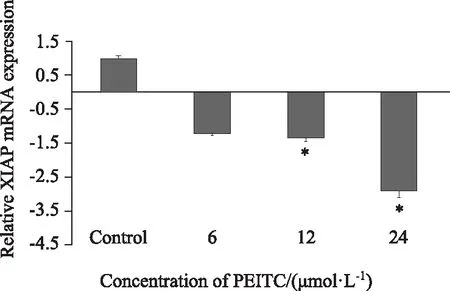
圖4 PEITC對BPH-1細胞中XIAP mRNA表達的影響Fig.4 The effects of PEITC on the expression of XIAP mRNA in BPH-1 Cells Suppressed transcription of XIAP mRNA was detected with real-time PCR in BPH-1 cells treated with PEITC. The level of mRNA was normalized to the value of the β-actin housekeeping gene mRNA.*P<0.05 vs control; PEITC: phenethyl isothiocyanate;BPH-1: benign prostatic hyperplasia cell line; XIAP: X-linked inhibitor of apoptosis.
2.5 PEITC下調Atg5-12 蛋白的表達
Western blotting結果顯示,BPH-1細胞經過6、12、24 μmol/L PEITC 處理24 h后,細胞內XIAP蛋白表達量較對照組下降(圖5)。
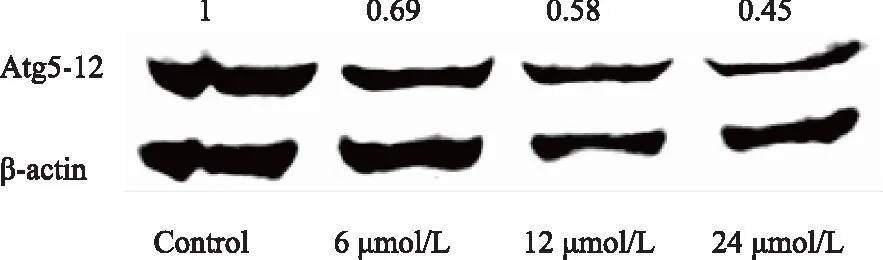
圖5 PEITC對BPH-1細胞中Atg5-12表達的影響Fig.5 The effects of PEITC on the expression of Atg 5-12 in BPH-1 cells PEITC suppressed the expression of Atg5-12 protein in a concentration-dependent way in BPH-1 cells.β-Actin was used as a loading control. PEITC: phenethyl isothiocyanate; BPH-1: benign prostatic hyperplasia cell line.
3 討論
前列腺的正常大小有賴于腺體內細胞增殖與程序性死亡的平衡,細胞的過度增殖和程序性死亡的減少均可導致前列腺體積的增大[9]。細胞程序性死亡是多細胞有機體為了調控機體發育,維護內環境穩定,由基因控制的細胞主動死亡過程。在正常組織中,細胞增殖速率和細胞死亡速率間保持平衡狀態。一旦平衡失調,無論是細胞復制速率增加還是細胞程序性死亡速率減少,都將導致前列腺增生[10]。
本研究前期實驗顯示,不同濃度的PEITC處理細胞時,在相同的處理時間內,隨著藥物濃度的增加,BPH-1細胞相對存活率下降。在同等濃度作用下,隨著藥物作用時間的增加,細胞的相對存活率也逐漸下降,并在作用24 h后,細胞的相對活性下降至50%以下。同時本研究顯示,作用36 h后細胞的相對活性相比于作用24 h后不再下降,說明PEITC在作用24 h后可以達到最大的抑制效果。因此在后續實驗中,筆者選擇不同濃度的PEITC作用BPH-1細胞24 h觀察實驗結果。
本研究顯示,隨著PEITC濃度的增加,細胞總凋亡率及早期凋亡率也逐漸增加。說明PEITC可誘導BPH-1細胞產生凋亡,并呈現出劑量依賴性。
細胞程序性死亡包括細胞凋亡及細胞自噬。細胞凋亡是細胞的特殊程序性死亡之一,目前研究[11-12]表明,細胞凋亡主要有死亡受體途徑和線粒體途徑。無論哪種途徑,細胞凋亡信號最終需要Caspase酶的激活而執行。目前已發現的Caspase有11種,分為兩類,一部分是以Caspase-2、Caspase-8、Caspase-9和Caspase-10為代表的凋亡起始相關蛋白,一部分是以Caspase-3、Caspase-6和Caspase-7為代表的凋亡執行蛋白。其中Caspase-9作為重要的啟動因子,發揮重要的作用[11, 13]。Caspase-9與Apaf-1(apoptotic protease activating factor-1)結合為復合物而激活,然后激活下游的效應分子Caspase-3產生凋亡級聯反應而引起凋亡的發生[14]。XIAP可競爭性與Apaf-1結合,通過抑制Caspase-9-Apaf-1復合體的產生而抑制細胞凋亡[15]。Sakao等[16]報道,在前列腺癌細胞中,PEITC可以通過下調XIAP蛋白的表達而誘導細胞凋亡。本研究結果表明,PEITC作用于BPH-1細胞24 h后,隨著PEITC濃度的增加,XIAP的表達量逐漸下降。同樣地,Real-time PCR結果表明,隨著PEITC作用濃度的增加,XIAP mRNA表達量逐漸下調。說明PEITC通過下調BPH-1中XIAP mRNA的表達來降低XIAP蛋白表達,并呈現出劑量依賴性,從而促進了BPH-1細胞的凋亡。
細胞的程序性死亡除了凋亡還包括自噬。自噬是面對外界環境刺激而自發程序性出現的細胞分解代謝過程,其通過自噬溶酶體途徑來維持內環境的穩定[17-18]。自噬過程受到一系列自噬相關蛋白的調控,研究[19-20]顯示,自噬相關蛋白Atg5在自噬形成過程中必不可少。Atg5泛素化修飾Atg12后,與其形成Atg5-12復合體,促進自噬囊泡的形成,后者是自噬發生的關鍵效應。研究[21]結果表明,誘導Atg 5的表達可以促進自噬的發生。Bommareddy等[22]報道了在前列腺癌細胞中,PEITC可以通過上調Atg5蛋白表達從而誘導細胞自噬及凋亡。隨后筆者檢測了BPH-1細胞在不同濃度PEITC作用下Atg5蛋白的表達變化。結果顯示,隨著PEITC濃度的增加,Atg5蛋白表達量逐漸下降。結果恰恰與在前列腺癌細胞中的作用相反,PEITC處理后BPH-1細胞自噬的過程受到了抑制。目前對于細胞凋亡及自噬相關性還沒有統一的觀點。有學者[23-24]提出,細胞凋亡和自噬是相互抑制的。例如在淋巴細胞模型中發現,通過抑制細胞自噬過程可提高細胞凋亡的比例[23]。也有研究[24]結果表明,在肝癌細胞中,用Atg5 siRNA干擾后,細胞自噬作用受到顯著抑制,同時細胞凋亡比例顯著增加。本研究結果與此相一致,PEITC通過下調Atg 5 蛋白的表達而抑制BPH-1細胞自噬的發生,可能由此促進了細胞的凋亡。
綜上所述,PEITC 抑制前列腺上皮細胞增殖,通過下調 BPH-1中XIAP mRNA降低XIAP蛋白表達,促進前列腺上皮細胞的凋亡并呈現出劑量依賴性;同時PEITC下調了自噬相關蛋白Atg-5;PEITC對凋亡與自噬的調節可能存在相關性。

